基于Masquelet诱导膜技术比较不同固定方式构建的胫骨大段骨缺损模型
申震,姜自伟,李定,曾志奎,陈国茜,张严,李紫阁,陈柏行,黄枫,李悦
(1. 广州中医药大学,广州 510405; 2. 广州中医药大学第一附属医院,广州 510405; 3. 江西省中医院,南昌 330006)
大段骨缺损(massive bone defect, MBD),是指由高能创伤、感染、骨肿瘤等各种原因导致的一类病理学变化,是导致肢体功能丧失并影响生活质量的重要原因[1]。MBD不仅给患者生理和心理上造成了巨大的痛苦,还会产生严重的社会经济负担,而对于MBD的治疗无论从解剖结构重建还是功能角度重建都是骨科临床中面临的极大挑战[2-3]。因而深入了解MBD并寻求行之有效的治疗方法一直是国内外学者的研究热点。近些年,针对MBD涌现出许多新观点和新技术[4],其中Masquelet技术因其操作简单、治疗周期短、愈合率高、适应症广等优点被广泛应用于治疗各部位、各类型的MBD[1,5-6]。而且无论是各类型临床报道[5]还是相关Meta分析[7]均表明Masquelet技术是临床中治疗MBD的有效方法。故而基于Masquelet技术构建MBD模型并研究诱导膜特性和作用机制,对指导临床深入开展该技术治疗MBD具有重要的现实意义。目前,有多种MBD诱导膜模型构建方法,在模型动物(新西兰白兔、大鼠、小鼠等)、缺损部位(股骨、胫骨、尺桡骨等)、固定方式(内固定钢板、髓内针、外固定支架等)等方面多种多样[6,8-12],但标准各异,尤其是各方法之间在模型质量、应用范围、操作难易程度及可重复性等方面缺乏统一的评价标准。而构建稳定的、标准化的动物模型是深入研究相关疾病的基础,对探究其病生理特点、相关作用机制以及治疗方法都至关重要。因而为统一评价标准,提高实验的可靠性和重复性,构建标准化的动物模型,有必要选择一种操作简便、快捷、质量稳定可靠的MBD模型构建方法。鉴于SD大鼠是医学实验研究最常用的动物之一[13],而临床中MBD最多见于胫骨部位[14-16],故而,本研究基于Masquelet技术构建大鼠胫骨大段骨缺损(massive tibial bone defect,MTBD)模型,并比较内固定钢板、髓内针和外固定架三种固定方式在此模型中的特点,从而选择较优的造模方法,继而为构建稳定的、标准化的MBD诱导膜动物模型提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
选用60只10周龄SPF级SD雄性大鼠,体重(308.50±6.00)g,购自广东省医学实验动物中心【SCXK (粤)2013-0034】。饲养及实验操作在广州中医药大学第一附属医院SPF级实验动物中【SYXK(粤)2013-0092】,实验室温度22~24℃,相对湿度60%~70%。常规饲料喂养,自由饮水。本实验科研项目伦理审查编号:TCMF1-2018002,实验中对动物处置符合科技部颁行的《关于善待实验动物的指导性意见》,满足动物保护、动物福利以及伦理原则的相关要求,严格遵守动物使用的3R原则。
1.1.2 主要试剂与仪器
自主设计并取得专利的大鼠胫骨牵张外固定装置(专利号:ZL201520667-424.3),定制6孔不锈钢钢板,1.5 mm螺钉,直径1 mm医用不锈钢克氏针,4% 多聚甲醛固定液(北京Biosharp公司,批号1704464),注射用青霉素钠(华北制药股份有限公司,160万单位/瓶,国药准字H13020655),DR拍片机(广州中医药大学第一附属医院影像科,柯达DR7500,管电压50 kV,电流4 mA)等。
1.2 方法
1.2.1 实验分组
按照随机数字表法随机分为内固定钢板组(internal fixation plate,IFP)、髓内针组(intramedullary pin,IMP)和环形外固定架组(circular external fixator,CEF)3个组,每组20只。
1.2.2 MTBD模型的建立
所有大鼠术前禁食禁饮12 h, 3%戊巴比妥钠(1.5 mL/kg)腹腔注射麻醉,右后肢剃毛备皮,麻醉起效、消毒、铺单后,分别选用六孔不锈钢钢板、直径1 mm克氏针和自制外固定架进行模型构建(见图1),具体如下:
(1)内固定钢板组(IFP)
沿小腿前外侧依次切开皮肤、浅筋膜,深筋膜,钝性分离胫骨前肌等肌肉组织,显露胫骨中上段骨骼;于胫骨干中部外侧置入一枚6 孔、1.5 mm 不锈钢微型接骨板,于接骨板远近两端各拧入2 枚1.5 mm 皮质骨螺钉,将接骨板固定于胫骨干外侧。采用微型电动摆锯于胫骨干中部截骨,截取4 mm 长骨缺损区;将聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)骨水泥塑形后置入骨缺损区(见图2 A-C)。
(2)髓内针组(IMP)
于右胫骨结节以下约2 cm处行1 cm纵行手术切口,逐层分离浅筋膜,深筋膜,钝性分离胫骨前肌等肌肉组织,显露胫骨中上段骨骼;用摆锯截断胫骨截取4 mm 长骨缺损区,将事先准备好的带有骨水泥的长约2 cm克氏针插入髓腔行髓内固定(见图2D-F)。
(3)环形外固定架组(CEF)
助手双手轻柔固定大鼠右侧膝关节及踝关节,轻轻牵引皮肤,在胫骨弧度顶点行1 cm纵行手术切口,钝性分离皮下组织,暴露胫骨;然后首先置第1枚环形压片,电钻装0.5 mm 克氏针,胫骨上段前内侧45°垂直于胫骨轴线进针,穿透双侧皮质,对侧出针;同法用第2 根克氏针与第1根冠状面成角30°~45°,靠近第1 根进针点穿入;置第2枚环形压片,调整位置,尽量使大鼠小腿中轴与环形压片中轴重合;置第3枚环形压片,同法在胫骨中段穿入克氏针2 枚后置第4枚压片,用3根长2.5 cm螺杆将两端压片连接,并拧紧螺丝;用摆锯截取4 mm长骨缺损区;将PMMA 骨水泥塑形后置入骨缺损区(见图2G-I)。
此外,上述3种固定方式在胫骨干中部截4 mm骨缺损区,置入PMMA骨水泥塑形后,用生理盐水冲洗术区,4-0可吸收缝线依次缝合深筋膜、浅筋膜,1-0 丝线缝合皮肤。术后连续3 d肌注青霉素5万U预防感染,术后完全负重活动,单笼饲养至皮肤切口愈合。
1.2.3 观察指标
(1)造模过程前后一般情况观察
观察并记录3种方式造模用时、术中出血量、术后肿胀持续时间以及骨水泥、固定装置松动率、感染率和模型成功率等指标。
(2)X线影像学观察
于术后第1天,第2周,第4周行X线检查,观察骨水泥、固定装置是否有断钉、松动、滑脱、移位等情况以评价固定方式的稳定性。
(3)诱导膜组织形态观察
于造模术后第4周,大鼠麻醉后采用颈椎脱臼法将其处死,收集各组诱导膜组织,肉眼直观下观察诱导膜颜色、质地、厚度等特征,之后立即用4%多聚甲醛固定,石蜡包埋切片等操作后行HE染色,光镜下观察诱导膜组织形态结构。
1.3 统计学方法
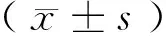
2 结果
2.1 造模前后一般情况观察
IFP组在造模用时及出血量方面明显大于IMP和CEF两组(P< 0.05),且IMP组造模用时最短,而CEF组出血量最少(完全浸湿1.0 cm×1.0 cm的纱块约是0.1 mL血,见图3A);而在术后肢体肿胀持续时间方面,CEF组肿胀时间最短,但三组之间差异无显著性(P> 0.05)(见表1)。此外,与IFP组相比,IMP和CEF两组的松动率偏低(P< 0.05),但模型成功率偏高P< 0.05),而在感染率方面,CEF组无感染发生,明显低于IFP和IMP两组(P< 0.05),而IFP组出现皮肤坏死感染、钢板外露情况,IMP组有脓性包块形成(见表2,图3B-C)。
2.2 X线影像学观察
术后第1天X线检查结果显示内固定钢板、髓内针、外固定架3种固定方式构建的MTBD模型质量可靠。其中,钢板、螺钉,克氏针及外固定架固定在位,骨水泥位置良好,未见松动、移位迹象(见图4 A-C)。但在术后第2周、第4周,IFP组出现螺钉松动、骨水泥移位等情况(见图4D),CEF组出现骨水泥移位表现(见图4E),而IMP组无异常表现。

注:A.IFP组;B.IMP组;C.CEF组。图1 各固定方式所需的材料装置Note. A. IFP group. B. IMP group. C. CEF group.Figure 1 Material devices required for each fixation method

注: A-C. IFP组:显露胫骨及安装钢板,截骨,置放骨水泥;D-F. IMP组:显露胫骨,截骨并置放骨水泥,缝合皮肤;G-I.CEF组:显露胫骨并安装外固定架,截骨,置放骨水泥。图2 各固定方式简要步骤造模流程图Note. A-C. IFP group, tibia exposure, steel plate installation, osteotomy, and placing the PMMA. D-F. IMP group, tibia exposure, osteotomy, and placing the PMMA. G-I. CEF group, tibia exposure, external fixator installation, osteotomy, and placing the PMMA. Figure 2 Brief steps of the modeling flow chart in each fixation method

组别Groups造模用时(min)Modeling time(min)出血量(mL)Blood loss(mL)肿胀时间(d)Duration of edema(d)钢板组IFP group45.70±3.332.04±0.167.90±0.88髓内针组IMP group30.10±2.13* 1.05±1.04* 7.80±0.79外固定架组CEF group32.80±2.30*0.92±0.10* 7.60±0.84
注:与IFP组比较,*P<0.05。
Note. Compared with the IFP group,*P<0.05.

表2 三种固定方式松动率、感染率及成功率比较(%,n=20)Table 2 Comparison of loosening rate, infection rate, and success rate in the three groups (%, n=20)
注:与IFP组比较,*P< 0.05;与IMP组比较,#P< 0.05。
Note. Compared with the IFP group,*P< 0.05. Compared with the IMP group,#P< 0.05.

注: A. 改制小型血垫;B. 钢板外露;C. 脓性包块。图3 造模前后一般情况观察Note. A. Small modified gauze. B. Plate exposure. C. Purulent mass. Figure 3 General observation during the perioperative period

注: A.内固定钢板固定术后第1天;B.髓内针固定术后第1天;C.环形外固定架固定术后第1天;D.螺钉松动、骨水泥移位;E.骨水泥移位。图4 造模术后固定装置及骨水泥稳定情况Note. A. IFP at day 1 postoperatively. B. IMP at day 1 postoperatively. C. CEF at day 1 postoperatively. D. Loose screws and displaced PMMA. E. Displaced PMMA.Figure 4 Fixation devices and PMMA stability after the modeling operation
2.3 诱导膜组织形态观察
肉眼直观下诱导膜组织均颜色红润鲜活,质地柔软,膜表面四周存在少许网状结构微小血管(见图5A);光镜下HE染色结果显示各组诱导膜厚度在460~520 μm,差异无显著性(P> 0.05),结构也基本一致,呈现明显的分层结构,其中内层主要由滑膜样上皮细胞构成,外层则富含成纤维细胞和胶原纤维,此外诱导膜中含有丰富的血管系统(见图5B)。
3 讨论
MBD是骨科医生在临床中常见的但又极其难以处理的一类病症,缺损的部位、周围软组织情况以及患者的全身状况等都会影响骨缺损的愈合。正是由于其发病机理及影响因素多样性,导致MBD的治疗也十分复杂[17]。而Masquelet诱导膜技术是治疗MBD的一种有效方法,自1986年由法国医生Masquelet[18]报道以来,就得到了广泛的关注和应用,国内外诸多学者对其进行不断深入的研究,在临床中也取得不错的治疗效果。据报道[19],Masquelet 技术成功治愈了缺损长度为25 cm的患者,而且重建后平均 8.5个月就可以正常行走并完全负重。更为重要的是,Masquelet 技术不仅可以避免在可能存在感染的情况下行带血管蒂骨移植术产生的潜在风险,而且在整个治疗过程中可以有效地控制感染[19-20]。在2010 年,Masquelet等[21]再次报道了运用该技术治疗手腕部骨缺损,扩大了该技术的应用范围,随后该技术广泛用于无菌性骨不连、感染性及肿瘤切除后骨缺损的治疗,并取得良好临床疗效[22-28]。然而,当前对于MBD以及Masquelet技术促进骨缺损修复的认识尚不够全面,甚至无论在临床上还是动物实验中对于MBD始终没有统一、准确的定义[29],这也说明当前对于MBD的研究还有诸多不足或是亟待阐明的内容,而Masquelet技术等诸多治疗方式以及相应的作用机制都还需更深入、更全面的研究。
在本实验中,我们选择了国内常用的实验动物SD大鼠,选择临床中骨缺损最多见的胫骨部位构建模型[14-16],并比较钢板、髓内针、外固定架三种最常见的固定方式的特点。本研究发现,与IMP和CEF两组相比,采用IFP固定方式术中所需时间较长,出血量较大,考虑到在安装钢板之前需要广泛分离周围软组织,还需植入4枚螺钉,这在一定程度上增加了操作难度,一方面考验着术者所具备的外科手术基础,稍有不慎就可能伤及周围的血管、神经,另一方面无疑增加了操作时间和出血概率。此外,结果表明手术时间与术中出血量之间存在正相关关系这也符合临床中的一般规律[30]。而相比之下,IMP和CEF两种固定方式对周围软组织损伤较小,在造模用时及出血量方面优于IFP。由于三种方式截骨部分相同,截骨方式相同,且截取长度均为4 mm,术后给予的护理措施也大体一致,这或许是三者之间肿胀持续时间无明显差异的原因,但考虑到CEF除了上述相同操作之外,主要步骤均在肢体外操作,对肢体损伤程度最小,故而肿胀持续时间最短。在感染方面,胫骨部皮下软组织组织较少,置放钢板使局部组织间间隙缩窄,压力增大,在皮肤缝合后局部张力也会明显增大,则缝合后皮肤坏死几率较大,一旦出现坏死就会导致局部皮肤缺损,继而出现钢板外露,而IMP出现的脓包是在深肌层之下、骨干附近,可能是由于在置放髓内针时出现骨髓内感染所致。与此同时,感染问题会引起持续疼痛[31],也会一定程度上延长肿胀时间,这或许是解释IFP组肿胀时间最长的原因之一。此外,感染会导致固定装置松动以致固定失败[32],这与本研究结果相一致,在IFP组其感染率最高,对应松动率也最高,出现了多次螺钉松动、滑脱、骨水泥移位现象,继而模型成功率最低。而CEF组出现的1例骨水泥松动现象或许可以用无菌性松动的知识加以解释,由于骨-针界面力学及生物学条件相对较差,长期的应力刺激反而导致骨质磨损和骨吸收现象,继而出现克氏针松动,固定不良的情况[33],但有别于IFP出现的感染性松动。虽然IMP暂未发现有松动迹象,但早有文献报道在骨修复动物模型中与外固定架相比,克氏针髓内固定方式固定强度不够,易发生旋转,支撑作用有限[34],而当取掉骨水泥植入颗粒状松质骨时,由于缺少骨水泥的“占位”支撑,对于IMP而言植入骨只能松散的包裹在细小克氏针周围,在颗粒状松质骨尚未完全皮质化之前植骨区缺乏牢靠的支撑和固定,不利于植骨重建。在诱导膜结构形态方面,本研究发现三组收集的膜组织无论是肉眼直观下的大体形态还是光镜下HE染色结果均显示无明显差别,而且与之前研究报道的诱导膜形态结构相一致[35],这说明3种固定方式均可成功复制Masquelet技术产生诱导膜组织,且在组织形态方面无明显差异。
综上,IFP、IMP和CEF三种固定方式均可成功构建MTBD诱导膜模型,而CEF为模拟Masquelet技术构建大鼠MTBD模型较优的方式。

