追赶生长饮食诱导小鼠代谢综合征并发脑衰老样病变模型的建立
金贺,赵志炜,王玉兰,张旭,王蓉,2*
(1. 首都医科大学宣武医院中心实验室,北京市老年病医疗研究中心,神经变性病教育部重点实验室,北京 100053; 2. 北京脑重大疾病研究院,北京 100053)
衰老是生命过程中的必然规律,神经系统作为重要的人体机能调节系统,是受衰老影响最大的系统之一。衰老脑组织发生的一系列特征性改变,包括脂褐素沉积、髓鞘发育受损、神经细胞萎缩、细胞间突触联系减少、生化物质异常等与神经退行性疾病的发生密切相关, 可能是疾病的初级阶段[1-2]。因此,了解导致脑衰老,尤其是病理性脑衰老的危险因素及其相关分子机制对预防神经系统退行性疾病具有重要意义。
代谢综合征(metabolic syndrome, MS)是以胰岛素抵抗(insulin resistance, IR)为核心病理改变的各种代谢性疾病的总称,是腹型肥胖、糖代谢异常、2型糖尿病、脂代谢紊乱、高血压、高胰岛素血症等多种代谢异常症状集中发生在某一个体的异常病理现象。代谢综合征在机制上可引起机体发生胰岛素抵抗、能量代谢异常、氧化应激、炎性反应、自噬过程改变等,而近年来基础及临床研究表明这些可调节性信号转导通路的异常与脑衰老、阿尔茨海默病等神经退行性病变密切相关[3-7]。大量流行病学研究证实,与代谢综合征相关的糖尿病、高血压、肥胖等是脑衰老的潜在独立危险因素,故代谢紊乱可能是病理性脑衰老发生的始动因子[8]。
对代谢综合征的研究目前大多采用高脂高糖饮食喂养模型,但这一模型忽略了饮食结构的改变对机体造成的影响[9]。追赶生长的概念由Leitch在1951年总结提出,饥荒、饮食不当或某些引起生长发育受限的疾病都可继发出现追赶生长(catch-up growth, CUG)[10-11]。CUG主要表现为生长抑制在营养恢复后机体出现的代偿性快速生长现象。成年期遭遇营养不良的个体,后续由于生活水平快速提高导致营养过剩的“追赶生长”现象在我国及其他发展中国家经历饥荒40-50年后普遍存在,并且节食减肥突然中断的现象在当今社会人群中亦为广泛[12]。大量研究证实,CUG会对机体造成长期不利影响,导致代谢综合征、冠状动脉粥样硬化性心脏病、高血压、二型糖尿病等疾病的发病率增高,但对衰老及神经系统的影响尚鲜有报道[13]。本研究以不同能量饮食喂养为切入点,诱导C57小鼠出现代谢综合征模型,以期为代谢综合征及其并发神经功能损害的防治提供新的研究思路和防治策略。
1 材料与方法
1.1 材料
1.1.1 实验动物
4周龄SPF级C57BL/6 J小鼠40只,雄性,体重(17.2±0.9)g,购自北京维通利华实验动物技术有限公司【SCXK(京)2016-0011】,饲养于首都医科大学宣武医院实验动物中心屏障环境中【SYXK(京)2015-0016】。
课题得到首都医科大学宣武医院动物伦理委员会的批准(伦理审批号:20170630)。
1.1.2 主要试剂和仪器
血糖仪及血糖试纸(美国罗氏);三酰甘油(triglyceride, TG)试剂盒、总胆固醇(total cholesterol,TC)试剂盒、胰岛素样生长因子-1(IGF-1)试剂盒、胰岛素(Insulin)试剂盒(南京建成生物工程研究所); H-7500透射电子显微镜(日本),P53抗体、磷酸化P53抗体(美国,Cell Signaling Technology)。
1.2 方法
1.2.1 实验动物分组及模型的建立
40只C57小鼠适应性喂养1周后,随机分为4组:正常对照组(normal control group, NC),以正常能量饲料(粗蛋白19.1%,粗脂肪4%,碳水化合物59%,总代谢能3.484 Kcal/g)喂养;低能量组(calorie-restricted group,CR),以低能量饲料(粗蛋白19.145%,粗脂肪2.52%,碳水化合物37.17%,总代谢能2.479 Kcal/g)喂养;高能量组(high energy group, HE),以高能量饲料(粗蛋白19.145%,粗脂肪21.52%,碳水化合物47.17%,总代谢能4.589 Kcal/g)喂养;追赶生长组(catch-up growth group,CUG),低能量饮食喂养六周后开放高能饮食喂养,各组动物均连续喂养12周。饲料配方购自军事医学科学院实验动物中心。以上动物均于天黑前投食,低能量饮食喂养的动物投食量与同体重正常对照组动物的进食量相一致。动物喂养员每周2~3次更换锯末垫料,每周室温和相对湿度控制在(23±2)℃和(55±5)%,每天12 h光照/12 h黑夜,动物可自由摄水。
1.2.2 生化指标检测严格按照试剂盒说明书进行
计算胰岛素抵抗指数(HOMA-IR):HOMA-IR=(FPG×FINS)/22.5。
1.2.3 蛋白质印迹技术检测海马组织P53蛋白和磷酸化P53蛋白水平
10%水合氯醛麻醉小鼠,牺牲取脑,冰浴中分离海马组织,包入预先做好的锡箔纸中,投入液氮速冻,-80℃保存。取冻存的海马组织,置于玻璃匀浆器内匀浆,随后加入蛋白裂解液冰上裂解30 min,4℃ 12 000 r/min离心10 min取上清。各吸取3 μL,BCA法检测蛋白浓度,加入6×蛋白上样缓冲液调整上样量15 μL /孔,100℃变性5 min。采用10%SDS聚丙烯酰胺凝胶电泳法上样电泳,PVDF转膜,5%脱脂奶粉室温封闭2 h; 然后分别与目的抗体P53(1∶1000)和磷酸化P53(1∶1000)4℃杂交过夜;TBST洗膜3次×10 min; 杂交二抗,室温孵育2 h,TBST洗膜3次×10 min;使用Millipore发光液,计算机凝胶显影系统曝光、显影,Image J软件进行条带灰度分析。
1.2.4 电镜技术观察海马区脂褐素
10%水合氯醛对小鼠进行腹腔注射麻醉,经左心室-升主动脉插管灌注并固定,首先灌注生理盐水100~150 mL,同时剪开右心耳,待肝完全变白,右心耳流出澄清液体后,注入4℃预冷的4%多聚甲醛固定液缓慢灌注,待肝变硬、四肢僵硬,断头取脑,分离海马组织,切成1 mm3组织块。置于2%多聚甲醛 + 2.5%戊二醛固定液中4℃固定2 h。梯度酒精脱水、置换、包埋,半薄切片定位,超薄切片机切片,厚度为100 nm, 捞在150目的铜网上,1%醋酸双氧铀染色20 min,冲洗晾干后柠檬酸铅染色2 min,透射电镜观察。
1.3 统计学方法
采用统计软件SPSS21.0,结果以均数±标准差表示。体重、血糖采用重复测量数据方差分析,组间比较采用单因素方差分析。P< 0.05认为差异有统计学意义,P< 0.01认为差异有显著统计学意义。
2 结果
2.1 小鼠体重和血糖的变化
低能量组体重持续低于正常对照组(P< 0.05);高能量组体重显著高于正常对照组,差异有显著性(P< 0.01);追赶生长组于开放饮食两周后,体重追赶上正常对照组(P< 0.05),但未追赶上高能量组。低能量组血糖处于最低状态,于实验第6周开始与正常对照组相比差异有显著性(P< 0.05); 高能量组血糖持续高于正常对照组,差异有显著性(P< 0.01);追赶生长组在开放饮食两周后,血糖明显高于正常对照组(P< 0.01),并接近高能量组血糖水平。(图1)
2.2 代谢综合征相关指标的变化
低能量组小鼠胆固醇、三酰甘油、胰岛素样生长因子1、胰岛素、HOMA-IR均低于正常对照组,其中胰岛素样生长因子1显著低于正常对照组,差异有显著性(P< 0.05); 高能量组各指标均高于正常对照组,胆固醇和胰岛素样生长因子1差异有显著性(P< 0.05); 追赶生长组胆固醇水平和胰岛素样生长因子1水平显著高于正常对照组(P< 0.01),HOMA-IR高于正常对照组(P< 0.05)。(表1)
2.3 海马组织P53蛋白与磷酸化P53蛋白的表达
低能量组P53与磷酸化P53蛋白表达水平低于正常对照组,但在统计学上差异无显著性(P> 0.05); 高能量组和追赶生长组P53与磷酸化P53蛋白表达水平均高于正常对照组(P< 0.05),其中追赶生长组升高尤为明显(P< 0.01)(图2)。
2.4 海马组织脂褐素沉积
与正常对照组相比,在特定大小的脑区内低能量组脂褐素沉着较少,可见少量散在的脂褐素颗粒;高能量组和追赶生长组可见明显脂褐素蓄积,胞质内脂褐素小体沉积成簇状;其中追赶生长组脂褐素沉积最为明显(图3)。
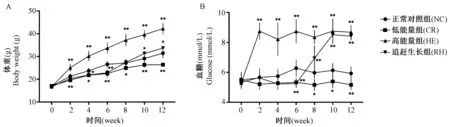
注:A. 各组小鼠体重变化;B. 各组小鼠血糖变化。与正常对照组比较,*P< 0.05, **P< 0.01。图1 小鼠体重和血糖的变化Note. A. Changes in body weight of mice in each group. B. Changes in blood glucose of mice in each group. NC,normal control group. CR,calorie-restricted group. HE,high-energy group. RH,catch-up growth group. Compared with the normal control group,*P< 0.05,**P< 0.01.Figure 1 Changes in body weight and blood glucose in mice
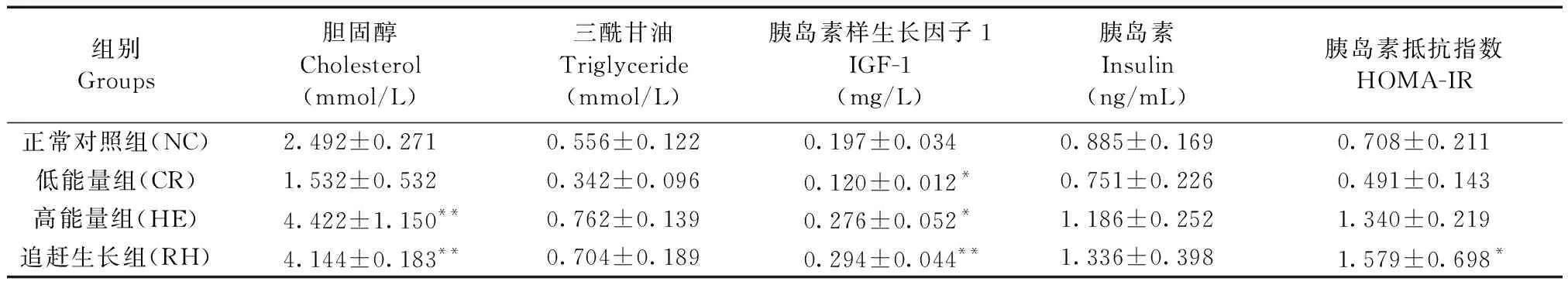
组别Groups胆固醇Cholesterol(mmol/L)三酰甘油Triglyceride(mmol/L)胰岛素样生长因子1 IGF-1 (mg/L) 胰岛素Insulin(ng/mL)胰岛素抵抗指数HOMA-IR正常对照组(NC)2.492±0.2710.556±0.1220.197±0.0340.885±0.1690.708±0.211低能量组(CR)1.532±0.5320.342±0.0960.120±0.012*0.751±0.2260.491±0.143高能量组(HE)4.422±1.150**0.762±0.1390.276±0.052*1.186±0.2521.340±0.219追赶生长组(RH)4.144±0.183**0.704±0.1890.294±0.044**1.336±0.398 1.579±0.698*
注:与正常对照组比较,*P< 0.05,**P< 0.01。
Note. NC,normal control group. CR,calorie-restricted group. HE,high-energy group. RH, catch-up growth group. Compared with the normal control group,*P< 0.05,**P< 0.01.
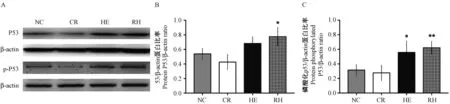
注:A. 各组小鼠脑海马组织P53蛋白和磷酸化P53蛋白免疫印迹;B. P53蛋白表达水平;C. 磷酸化P53蛋白表达水平。NC,正常对照组; CR低能量组; HE,高能量组;RH,追赶生长组。与正常对照组比较, *P< 0.05,**P< 0.01。图2 小鼠脑海马组织P53蛋白与磷酸化P53蛋白表达水平Note. A. Immunoblotting of P53 protein and phosphorylated P53 protein in hippocampus of mice in each group. B. P53 protein expression level. C. Phosphorylated P53 protein expression level. NC,normal control group. CR, calorie-restricted group. HE,high-energy group. RH, catch-up growth group. Compared with the normal control group,*P< 0.05,**P< 0.01.Figure 2 Expression of P53 protein and phosphorylated P53 protein in hippocampus of brain tissue
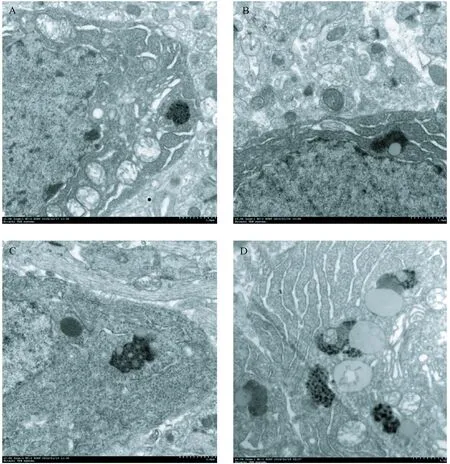
注:A. 正常对照组;B. 低能量组;C. 高能量组;D. 追赶生长组。图3 电镜下脑组织海马区脂褐素(× 30 000,标尺:1.0 μm)Note. A. normal control group. B. calorie-restricted group. C. high-energy group. D. catch-up growth group.Figure 3 Lipofuscin in the hippocampus of brain tissue under an electron microscope (×30 000, scale=1.0 μm)
3 讨论
动物饮食由低能量骤然提升至高能量的改变被称为“追赶生长饮食模式”,可导致机体发生加速生长,不同组织追赶生长的速度不同,脂肪组织的生长速度明显高于其他组织,可形成“追赶性肥胖”[14]。在本实验之前,对追赶生长的研究一直较多关注内分泌系统,少有文章报道机体发生追赶生长对神经系统的影响,直到最近肖荣教授课题组通过大规模流行病学研究发现生命早期经历营养不良,而后营养水平大幅提升的人群,在中老年期出现认知功能下降的风险显著增高[15]。本研究采用不同能量饮食喂养小鼠,试从机制上探讨饮食模式的改变对神经系统的影响。
实验结果显示,追赶生长组小鼠胆固醇、三酰甘油、胰岛素样生长因子1等代谢指标升高的同时,表现出明显的胰岛素抵抗倾向。胰岛素受体亦分布在大脑的广泛区域,尤其是与记忆功能密切相关的海马组织。大量临床、基础和流行病学研究提供了充分的证据表明胰岛素抵抗参与神经退行性疾病的病理过程,与认知功能下降具有明显相关性[16-17]。中年期肥胖个体并同时伴有胰岛素抵抗,是其老年期神经退行性疾病发病的独立危险因素[8]。
形态学检测发现追赶生长喂养的小鼠海马区出现明显的P53和磷酸化P53-ser15蛋白表达水平升高。P53基因作为一种重要的抑癌基因,编码 393 个氨基酸组成的含磷蛋白质,可诱发多种细胞凋亡,是公认的衰老标志分子。体外实验和动物实验均表明,神经细胞发生凋亡时,伴随P53 基因的高水平表达[18-21]。DNA损伤可引起P53在ser15位点磷酸化(P53-ser15),磷酸化的P53在神经细胞凋亡中起重要作用,而且P53-ser15磷酸化及P53蛋白高水平表达可能会加快脑老化和神经退行性疾病的进展[19]。
进一步对脑组织进行病理学检查,我们发现追赶生长饮食喂养的小鼠海马区出现明显的脂褐素沉积现象。神经元内脂褐素沉积可使生物膜的通透性、酶的催化功能、受体的结构等发生异常改变,并常伴随晚期糖基化终末产物(advanced glycation end products, AGEs)和丙二醛(malonedialdehyde, MDA)的积聚,导致正常生化代谢过程减慢或停滞,最终引起脑内蛋白质发生改变,是迄今唯一较为明确而公认的脑衰老的特征性金标准[22]。
本课题研究表明,追赶生长饮食模式可引起小鼠代谢综合征,同时诱发中枢神经系统促凋亡基因P53显著表达,以及明显的脂褐素沉积现象,进一步从病理学角度提供了追赶生长饮食模式导致小鼠发生病理性脑衰老的证据。而值得引起关注的是,追赶生长组动物肥胖水平虽不及高能量组动物,但脑衰老样病变却更加显著,由此我们推断追赶生长导致的机体胰岛素抵抗在致神经系统退行性变中发挥了重要作用。而在抗衰老的研究中,通过热量限制达到抗衰老效应已被证明是目前最为可靠的方法[23]。1935年McCay等研究发现啮齿类动物从幼年开始或成年期以后每天摄入正常饮食能量的30%~50%可使寿命延长10%~20%,近年来许多科学家也通过研究表明CR能延缓衰老并预防衰老相关疾病的发生。CR对神经系统的抗衰老效应包括提高机体认知和记忆能力,减缓神经退行性疾病的发生发展[24-26]。因此,结合本课题的研究结果,我们推测追赶生长是机体处于饮食平衡状态时,由于营养摄入水平的大幅提高打破了CR形成的脑保护机制,从而对中枢神经系统产生不利影响。
中枢神经系统退行性疾病的发生与脑衰老密切相关[27]。脑衰老过程是对神经保护机制和神经再生机制的挑战,最终发生的是“健康脑衰老”还是“非健康脑衰老”取决于基因和环境因素的共同参与和控制。随着全球人口老龄化进程的加快,如何防治衰老所致的神经系统退行性疾病是备受关注的问题。本研究着眼于广泛存在于当今社会的不同能量饮食问题,发现在追赶生长饮食模式下机体除可发生代谢综合征相关疾病,还可引起脑衰老样病变,这一神经-内分泌动物模型为进一步探讨如何预防和延缓脑衰老的发生和发展提供了新思路。

