黄精降低活性氧水平促进衰老内皮祖细胞功能的研究
秦 臻,韦正新,宰青青,许键炜,2
(贵州医科大学基础医学院1. 药理学教研室、2. 组织工程与干细胞实验中心,贵州 贵阳 550025)
内皮祖细胞(endothelial progenitor cells,EPCs)是一类可替代修复损伤血管内皮,促进血管网络重建的内皮细胞前体细胞,利用体外扩增的EPCs治疗缺血性心血管疾病具有较好的应用前景[1-2]。然而,EPCs在体外传代培养中常因老化而难以维持增殖,如何干预EPCs的衰老,提高EPCs的数量和质量,是临床治疗缺血性心血管疾病急需解决的一个难点。前期研究表明,黄精可通过提高端粒酶活性来保护衰老大鼠骨髓EPCs的功能[3],在此基础上,本文将进一步探讨黄精在老年大鼠骨髓EPCs体外传代培养衰老进程中,对细胞功能及活性氧(reactive oxygen species,ROS)水平的影响。
1 材料与方法
1.1材料
1.1.1实验动物 健康SPF级20月龄SD大鼠20只,体质量(520~580) g;3月龄SD大鼠40只,体质量(220~260) g,♀♂各半。全部动物由北京维通利华实验动物技术有限公司提供,合格证号:11400700111130。动物饲养环境:温度(22~25) ℃,湿度50%~60%,光照12 h,采用标准鼠饲料和灭菌饮用水喂养。本动物实验方案获得贵州医科大学动物伦理委员会批准。
1.1.2药物与试剂 黄精(批号:20150525)购自贵州百灵药业;M199培养液(批号:NAA1326)购自Hyclone公司;胎牛血清(批号:A15112-0279)购自PAA公司;大鼠淋巴细胞分离液(批号:TBD 2013LR)购自天津灏洋生物科技有限公司;血管内皮生长因子(vascular endothelial growth factor,VEGF,批号:011210)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF,批号:081308)购自PeproTech公司;Dil标记的乙酰化低密度脂蛋白(Dil labeled acetyl low density lipoprotein,Dil-ac-LDL,批号:YB-0013)购自广州奕源生物科技有限公司;FITC标记的荆豆凝集素1(FITC-labeled Ulex europarus agglutinin-1,FITC-UEA-1,批号:055M4077V)购自Sigma公司;β-半乳糖苷酶染色试剂盒购自Biovision公司;体外成血管试剂盒购自Millipore公司;ROS检测试剂盒购自碧云天公司。
1.1.3仪器 TS100倒置显微镜(日本Nikon公司);IX71荧光显微镜(日本Olympus公司);流式细胞仪(美国BD公司);多功能酶标仪(美国Thermo Fisher公司);CO2培养箱(美国Thermo Forma公司)。
1.2方法
1.2.1黄精含药血清的制备 黄精产自贵州,经贵阳市药检所鉴定为道地药材,按《中国药典》(2005)制备黄精水煎液,水浴浓缩备用。将3月龄SD大鼠随机分为对照组、黄精高、中、低剂量组,每组10只。灌胃药量按人与动物体表面积换算,即低剂量组为临床等效剂量2 g·kg-1,中剂量为5倍临床等效剂量即10 g·kg-1,高剂量为10倍临床等效剂量即20 g·kg-1,对照组灌服生理盐水。每天灌胃2次,连续3 d,d 4早上1次性灌服全天剂量后采血,离心取上清,过滤除菌。
1.2.2大鼠骨髓EPCs的培养鉴定及细胞分组 将20月龄健康SD大鼠麻醉处死后,无菌取出双侧胫骨、股骨,采用密度梯度离心法分离骨髓单个核细胞,PBS洗涤2次,用M199全培养基(含体积分数为0.2的胎牛血清,10 mg·L-1的VEGF和bFGF)重悬后,接种于24孔板中,每隔3 d换液1次,收集培养第2代的细胞,与Dil-ac-LDL和FITC-UEA-1共同孵育,采用双染色法鉴定EPCs。将培养第2代的细胞同步化24 h后,随机分为4组:对照组加入空白血清,黄精各剂量组加入黄精高、中、低剂量含药血清,使各组血清的体积分数为0.1,每隔3 d换液1次,继续培养至第4、6、8代,分别检测以下指标。
1.2.3细胞衰老程度检测 按β-半乳糖苷酶染色试剂盒操作说明,PBS洗涤细胞1次,加入1 mL固定液,室温固定15 min;PBS洗涤细胞3次,每次3 min,加入1 mL预热的染色工作液,37 ℃无CO2条件下孵育,直到细胞呈现蓝色,用封口膜封住孔板防止液体蒸发,除去染色工作液,加入2 mL PBS缓冲液洗涤,荧光显微镜下随机选取5个视野(×200),每个视野至少100个细胞,胞质染色者为衰老细胞,计算衰老细胞占观察细胞总数的百分比。
1.2.4细胞增殖功能检测 将等量EPCs接种在96孔培养板中,贴壁24 h后,每孔加5 g·L-1的MTT 15 μL,继续培养4 h,吸弃上清液,再加入DMSO,于微量震荡器充分震荡10 min后,置酶标仪,于波长570 nm处测吸光值。
1.2.5细胞迁移功能检测 消化收集贴壁细胞,将等量EPCs加入Transwell小室的上室,下室加入含50 mg·L-1VEGF的M199培养液,培养24 h,擦去上室中的细胞,多聚甲醛固定,吉姆萨染色,镜下随机选取5个视野(×200),计数迁移至下层的细胞,取其平均数。
1.2.6细胞成血管功能检测[4]EPCs成血管功能与增殖、黏附及迁移功能密切相关,按体外血管生成试剂盒操作说明,将ECMatfixTM胶液和ECM 10×稀释液置于4 ℃冰箱过夜冻融,每900 μL ECMatfixTM胶液加入ECM 10×稀释液100 μL,将混匀液加入96孔板,每孔50 μL,孵育1 h凝固成胶;将各处理组细胞以5×103个/孔接种于胶上;37 ℃培养24 h后,镜下随机选取5个视野(×200),计数长度为宽度的4倍以上的细胞,取其平均数。
1.2.7细胞ROS水平的检测 按ROS检测试剂盒操作说明,胰酶消化收集各组细胞,计数后,每管加入1 ∶1 000用无血清培养液稀释的2′,7′-二氯荧光黄双乙酸盐(DCFH),使每管终体积为100 μL,37 ℃孵育20 min,PBS洗涤2次,上流式细胞仪检测。

2 结果
2.1大鼠EPCs的分离培养及鉴定刚分离的大鼠骨髓单个核细胞呈圆形,传代培养至第2代时细胞呈典型的铺路石样,贴壁细胞经FITC-UEA-1和Dil-ac-LDL处理后,荧光显微镜下同时结合FITC-UEA-1和摄取Dil-ac-LDL的细胞为正在分化的EPCs(Fig 1)。

Fig 1 Identification of EPCs(×200)
A: Adherent cells with Dil-ac-LDL are red; B: Cells binding FITC-UEA-1 are green; C: Double positive cells are differentiating EPCs
2.2黄精对EPCs衰老程度的影响β-半乳糖苷酶染色阳性细胞即为衰老细胞,Fig 2结果显示,随细胞传代次数增多,细胞染色阳性率明显上升(P<0.01),经黄精各剂量干预后,细胞在传代培养中染色阳性率明显下降(P<0.05)。
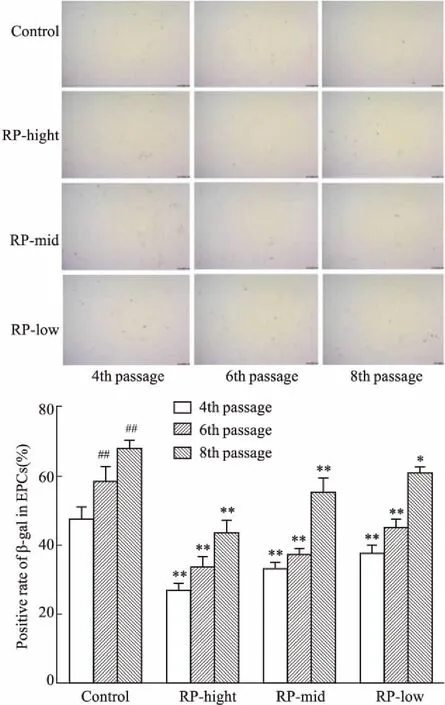
Fig 2 Effect of RP on positive rate of β-gal in
*P<0.05,**P<0.01vscontrol;##P<0.01vs4th passage in control group
2.3黄精对EPCs增殖功能的影响如Fig 3所示,随细胞传代次数的增多,细胞增殖功能明显降低(P<0.01),经黄精各剂量干预后,细胞增殖功能明显增强(P<0.01)。
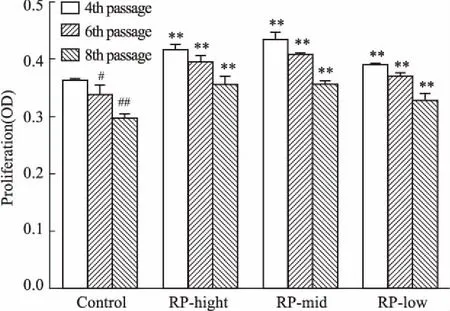
Fig 3 Effect of RP on proliferation in
**P<0.01vscontrol;#P<0.05,##P<0.01vs4th passage in control group
2.4黄精对EPCs迁移功能的影响如Fig 4所示,随细胞传代次数的增多,迁移细胞数量明显降低(P<0.01),经黄精各剂量干预后,迁移细胞数量明显上升(P<0.01)。
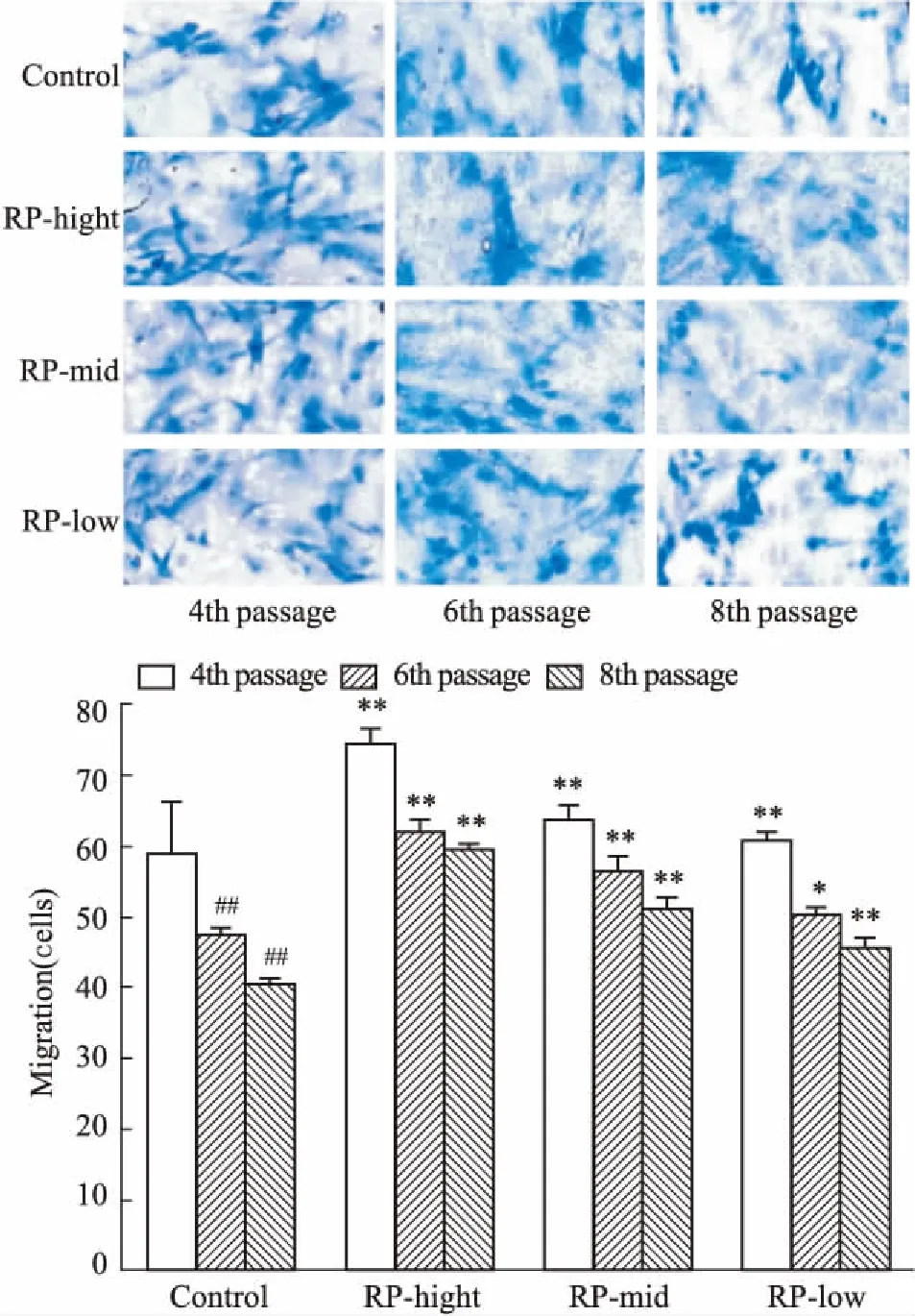
Fig 4 Effect of RP on migration in
*P<0.05,**P<0.01vscontrol;##P<0.01vs4th passage in control group
2.5黄精对EPCs成血管功能的影响如Fig 5所示,随细胞传代次数的增多,成小管细胞数量明显降低(P<0.01),经黄精高、中剂量干预后,成小管细胞数量明显增多(P<0.01),黄精低剂量仅能增强第4代的细胞成血管功能,对第6、8代细胞成血管功能无明显影响。
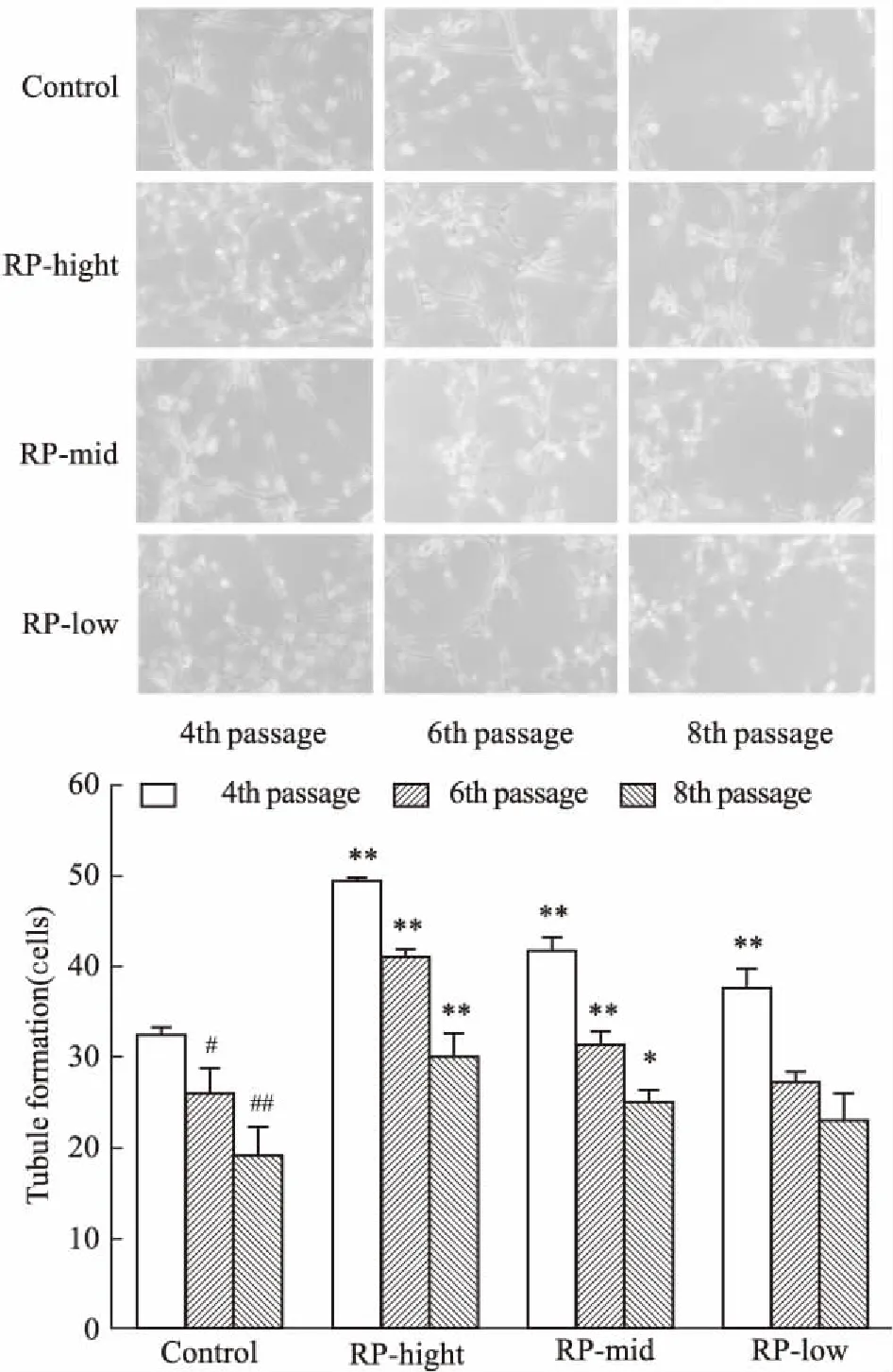
Fig 5 Effect of RP on tubule formation in
**P<0.01vscontrol;#P<0.05,##P<0.01vs4th passage in control group
2.6黄精对细胞ROS水平的影响流式细胞仪检测到的DCFH荧光强度可反映细胞ROS的水平,且呈正相关。Fig 6结果表明,随细胞传代次数增多,其ROS水平迅速上升(P<0.01),经黄精各剂量干预后,细胞ROS水平明显降低(P<0.01)。
3 讨论
EPCs是一类具有巨大增殖潜力的内皮细胞前体细胞,在血管损伤、缺血缺氧等条件下,EPCs不仅可向损伤血管迁移募集,参与受损内皮的修复及血管网络的构建,还能分泌多种细胞因子,促进血管的修复重建。因此,由EPCs介导的缺血性心血管疾病的治疗已成为目前再生医学研究的热点[1-2,5]。

Fig 6 Effect of RP on level of ROS in
**P<0.01vscontrol;##P<0.01vs4th passage in control group
然而,EPCs会随机体衰老出现老化迹象,这主要由年龄、遗传、端粒酶等决定[3, 6]。同时,EPCs在体外培养过程中也会出现复制时间延长,甚至停滞等老化迹象,这可能是因为细胞在短期内不断复制,又无体内环境的保护,多种外界局部因素对细胞的各种有害刺激逐渐积累所致。本研究也表明,取自老年大鼠骨髓的EPCs在体外传代培养过程中迅速衰老,并伴有细胞功能的明显衰退。
衰老自由基学说认为,衰老过程是机体组织细胞不断产生自由基积累的结果。活性氧类是细胞氧化系统产生的含有ROS功能基团的化合物,也是体内最重要的自由基。正常情况下,细胞内ROS的产生和清除处于平衡,但在细胞衰老进程或刺激因子存在时,其胞内清除ROS的调节机制失衡,积累增多的ROS又会损害细胞功能,加速细胞衰老[7-8]。可见,ROS的异常增多是加速EPCs衰老的一个关键因素。本研究也表明,EPCs在体外传代培养老化进程中伴有ROS异常迅速增多,而增多的ROS又可继续加重EPCs老化,并损伤EPCs功能。
黄精是疗效确切的抗衰老中药,现代药理学研究已表明,黄精及其主要成分黄精多糖可增强机体抗氧化功能,有效清除自由基,减轻炎症损伤反应;可有效提高EPCs的端粒酶活性,延缓在体EPCs的衰老[3, 9-10]。本研究进一步表明,黄精可有效干预老年大鼠EPCs的体外传代培养老化进程,其机制可能是通过降低细胞ROS水平,减轻细胞氧化损伤来保护衰老进程中EPCs功能。由于线粒体是ROS产生的主要场所,也是ROS作用最敏感的部位,线粒体功能损伤是ROS异常增多最主要的原因之一,与细胞衰老关系密切,黄精是否可以通过维护线粒体功能来达到抗EPCs衰老的机制,尚待后续研究。

