岩藻黄素对H2O2诱导BNL CL.2细胞氧化损伤保护作用研究❋
齐 佳, 崔艳君, 王广策, 唐 娜, 成 敏, 孙恒一, 綦慧敏❋❋, 刘顺梅❋❋
(1. 潍坊医学院,山东 潍坊 261053; 2. 中国科学院海洋研究所,山东 青岛 266071)
肝脏疾病的发生与氧化应激具有密切的相关性。ROS(活性氧)是细胞正常代谢活动的产物,主要在线粒体中产生。肝脏细胞内含有丰富的线粒体,代谢活动活跃,更易产生ROS。持续和过量的ROS能引起细胞损伤,会导致肝细胞凋亡[1]及肝纤维化、肝硬化和终末期肝细胞癌的发生。氧化应激也会导致其它疾病及癌症的发生。
岩藻黄素,英文名为fucoxanthin(FUCO),是存在于褐藻和硅藻等藻类中的色素成分,具有抗癌[2-3]、减肥和降血糖[4-5]等多种生物活性。已有研究表明,类胡萝卜素能够作为外源性抗氧化剂重构细胞的氧化应激水平,中和过量的ROS,使细胞和组织免于过量ROS的损伤[6]。作为类胡萝卜素家族的一员,FUCO已被发现具有较强的抗氧化能力。它能清除1, 1-二苯基-2-苦基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)和超氧自由基,对单态氧具有淬灭活性[7]。FUCO还能减轻H2O2引起的猴肾成纤维细胞的DNA的损伤,抑制细胞凋亡,提高细胞的存活率[8]。
H2O2是一种强氧化剂,是ROS的重要成员之一,易穿透细胞膜,导致DNA损伤和蛋白质的破坏,常被用来建立氧化损伤细胞模型。鉴于肝病发生与氧化应激的密切关系及FUCO具有较强的抗氧化活性,本文利用H2O2诱导小鼠BNL CL.2肝细胞建立氧化损伤细胞模型探讨FUCO对细胞的保护作用,以期为FUCO药用活性研究及肝病治疗新药物的研发提供理论依据。
1 材料
1.1 仪器与试剂
仪器:多功能酶标仪(Molecular devices,SpectraMax M5美国);CO2细胞培养箱(Thermo,311,美国);离心机(Thermo,Labofuge300,美国);超声波细胞破碎仪(宁波新芝,JY92-ⅡN)。
试剂:岩藻黄素(Sigma);微量还原型谷胱甘肽(GSH)检测试剂盒(南京建成生物工程研究所);MTT检测试剂盒、乳酸脱氢酶(LDH)检测试剂盒、活性氧(ROS)检测试剂盒及BCA蛋白浓度测定试剂盒(碧云天生物技术研究所);DMEM高糖培养基(索莱宝);胎牛血清(四季青)。
1.2 细胞株
小鼠胚胎肝细胞BNL CL.2:上海酶研生物科技有限公司。
2 方法
2.1 细胞培养
BNL CL.2细胞用含10%胎牛血清和1%青霉素和链霉素的DMEM高糖培养基于37 ℃、5% CO2细胞培养箱中培养。
2.2 BNL CL.2细胞氧化损伤模型的建立[9]
以H2O2诱导建立BNL CL.2细胞氧化损伤模型。实验设空白对照组和H2O2处理组,H2O2组设100、200、400、 600、 800、1 000、 1 200和1 600 μmol/L共8个浓度。每组设3个平行孔。
浓度为1×105个/mL的细胞悬液按100 μL/孔接种于96孔细胞培养板中培养。24 h后,空白对照组换为无血清培养液,H2O2组分别换为含不同浓度H2O2的无血清培养液,各组继续放置于细胞培养箱中培养24 h后, PBS清洗细胞,按照MTT试剂盒说明书检测各组的细胞活力,根据细胞活力筛选建立氧化损伤模型的最适H2O2浓度。
2.3 细胞活力测定
实验设空白对照组(Con)、阳性对照组(VE:维生素E,50 μmol/L VE+ 1 000 μmol/L H2O2)、H2O2模型组(Mod,1 000 μmol/L H2O2)和FUCO组。FUCO组设1、5、10、20 μmol/L 4个浓度,分别用 F1(1 μmol/L FUCO+1 000 μmol/L H2O2)、F5(5 μmol/L FUCO+1 000 μmol/L H2O2)、F10(10 μmol/L FUCO+1 000 μmol/L H2O2)和F20(20 μmol/L FUCO+ 1 000 μmol/L H2O2)表示。每组3个平行孔。
1×105个/mL细胞悬液每孔100 μL接种于96孔细胞培养板中培养24 h后,空白对照组和H2O2模型组换为无血清培养液,VE组换为含50 μmol/L VE的无血清培养液,FUCO组换为含不同浓度FUCO的无血清培养液。上述各组在培养2 h后,除空白对照组外,其余组全部加入终浓度为1 000 μmol/L的H2O2置于细胞培养箱中继续培养24 h。24 h后用MTT法测量各组细胞的活力。
2.4 细胞乳酸脱氢酶释放量测定
实验分组:设空白对照组(Con)、最大酶活性组(Max)、阳性对照组(VE)、H2O2模型组(Mod)和FUCO组(F1、F5、F10、F20)。VE组、Mod组及F1、F5、F10、F20组药物浓度同2.3。每组设3个平行孔。
浓度为1×105个/mL的细胞悬液按照200 μL/孔 接种于48孔细胞培养板中培养。24 h后,弃掉培养液,PBS清洗一次。Con、Max和Mod组换为无血清培养液,VE组换为含50 μmol/L VE的无血清培养液,F1、F5、F10及F20组换为含相应浓度FUCO的无血清培养液。药物与细胞预孵育2 h后,除Con和Max组外,其余组全部加入终浓度为1 000 μmol/L 的H2O2。继续培养24 h后,Max组加入10 μL LDH释放试剂后继续于培养箱中培养。1 h后,分别取各孔的细胞培养液于离心管中,400g离心5 min,各取120 μL上清加入96孔培养板中,增设只加药物的空白背景孔。各孔分别加入60 μL LDH工作液,混匀后于25 ℃避光烘箱孵育30 min。酶标仪490 nm处测定各组吸光度,计算乳酸脱氢酶释放率。计算公式为:LDH释放率(%)=(处理样品吸光度-样品对照孔吸光度)/(细胞最大酶活性的吸光度-样品对照孔吸光度)×100%。
2.5 细胞内还原型谷胱甘肽含量测定
实验分组及各组细胞处理方法同2.3。细胞悬液接种在6孔细胞培养板中培养,重复3次。
细胞处理结束后,胰酶消化细胞制成细胞悬液,PBS清洗细胞,用超声波细胞破碎仪破碎细胞后取一定量细胞悬液用BCA法测定蛋白浓度。取匀浆上清液100 μL,加入试剂一100 μL混匀后于3 500 g/min离心10 min,取上清液待测。根据试剂盒说明书,按照表1进行反应体系的操作。将反应物混匀后,静置5 min,在酶标仪405 nm波长下测量各组吸光度,计算GSH含量。计算公式:GSH含量=[(测定孔-空白孔)/(标准孔-空白孔)]×标准管浓度(20 μmol/L)×2÷蛋白浓度。
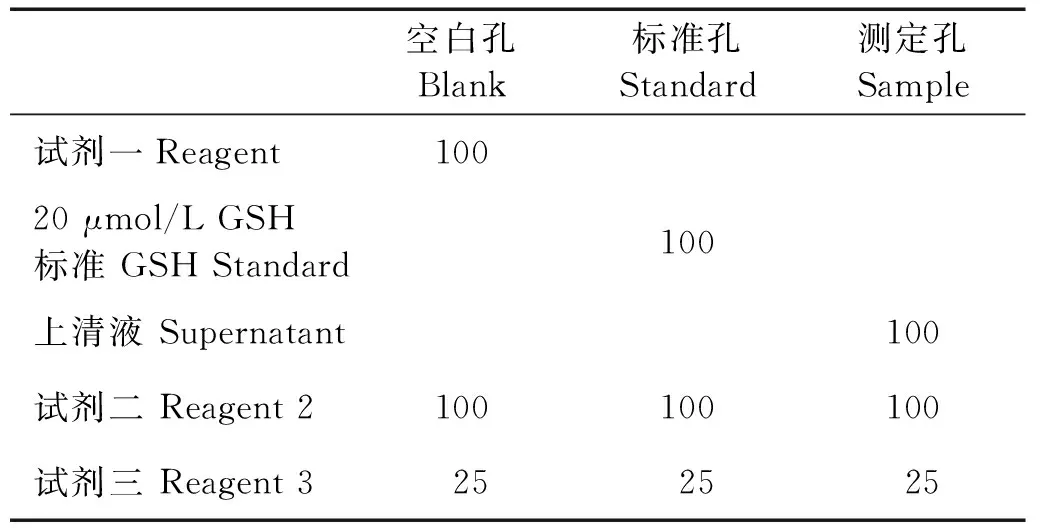
表1 GSH检测反应体系Table 1 The reaction system for GSH test /μL
2.6 细胞内活性氧含量测定
实验分组同2.3,每组3个平行孔。
1×106个/mL的细胞悬液接种于48孔细胞培养板中,每孔200 μL。24 h后,Con和Mod组换为无血清培养液,VE组及F1、F5、F10和F20组分别换为含相应药物及浓度的无血清培养液。细胞于培养箱中继续培养24 h后,除Con外,其余各组均加入终浓度为1 000 μmol/L的H2O2处理30 min。DCFH-DA(2′,7′-二氯荧光黄双乙酸盐)用无血清培养液稀释使其终浓度为10 μmol/L。细胞经H2O2处理后先去除各孔内的培养液,再加入适当体积上述DCFH-DA培养液,放于培养箱内孵育20 min后用PBS清洗3次,5 min/次,充分去除未进入细胞内的DCFH-DA。使用荧光酶标仪在488 nm激发波长,525 nm发射波长下测量各孔吸光度。
2.7 统计学方法

3 结果与讨论
3.1 BNL CL.2细胞氧化损伤模型的建立
不同浓度H2O2处理BNL CL.2细胞24 h后,各组细胞活力见图1。空白对照组细胞活力设为100%。与对照组相比,100、200、400、 600、 800、1 000、 1 200、1 600 μmol/L H2O2组细胞活力分别下降至(88.90±8.54)%、 (85.67±10.90)%、(83.67±12.64)%、(79.75±13.61)%、(75.60±14.90)%、(65.76±18.19)%、(64.67±15.59)%和(58.21±12.81)%。细胞活力随着H2O2浓度的增加而下降,且逐渐出现细胞触角消失、形态变圆、细胞结构不清等现象。

图1 建立氧化损伤细胞模型H2O2作用浓度筛选 (n=3 )Fig.1 Screening of H2O2 concentration for the establishment of oxidatively damaged cell model (n=3 )
由于H2O2浓度过大,会导致细胞大量凋亡甚至死亡,因此,我们选择细胞存活率在(65.76±18.19)%之间的1 000 μmol/L H2O2作用24 h来建立氧化损伤模型进行后续研究。该作用浓度与liu等[9]用来诱导BNL CL.2氧化损伤所用的H2O2浓度相同。
3.2 FUCO提高H2O2诱导氧化损伤细胞的活力
实验结果见图2。Con组细胞活力设为100%,Mod组的细胞活力下降至(65.76±18.19)% (vs Con,P< 0.01)。而药物与细胞共培养2 h后经H2O2处理24 h,VE组细胞活力上升至(88.47±10.61)% (vs Mod,P<0.05)。F1、F5及F10组细胞活力均比Mod组增加,但三者与Mod组相比无明显差异(P> 0.05),F20组的细胞活力明显高于Mod组(P< 0.05),为(91.54±10.45)%。

(*: 与空白对照组相比, P<0.05;#: 与模型组相比, P<0.01. *: P<0.05, vs Con;#: P<0.01, vs Mod. Con: 空白对照组Control group;Mod:1 000 μmol/L H2O2 模型组1 000 μmol/L H2O2 Modle group;F1:1 μmol/L FUCO+1 000 μmol/L H2O2;F5:5 μmol/L FUCO+1 000 μmol/L H2O2; F10:10 μmol/L FUCO+1 000 μmol/L H2O2;F20:20 μmol/L FUCO+1 000 μmol/L H2O2; VE: 50 μmol/L VE+ 1 000 μmol/L H2O2。)
H2O2可诱发细胞损伤和凋亡,可使细胞活力下降。本实验研究发现,1~20 μmol/L的FUCO与细胞预孵育2 h可减轻H2O2对细胞造成的氧化损伤,FUCO组的细胞活力均高于H2O2处理组。这与Heo等[8]的实验结果相似。Heo等用H2O2处理猴肾成纤维细胞,发现5~200 μmol/L的FUCO均可显著提高H2O2损伤细胞的活力。
3.3 FUCO降低H2O2诱导氧化损伤细胞的乳酸脱氢酶释放量
将最大酶活性组LDH释放率设为100%,各组细胞的LDH释放率见图3。Con组LDH释放率为(25.94±5.01)%,Mod组增至(66.66±5.19)%,比Con组明显提高(P< 0.05)。但药物与细胞预孵育2 h后再经H2O2处理,VE组和4个FUCO组的LDH释放率均比Mod组明显降低(P< 0.05),其中5 μmol/L FUCO组释放率最低,为(28.48±5.86)%, 对细胞的保护作用优于50 μmol/L 的VE(35.27%±4.96%)。
LDH是活细胞浆内酶,当细胞损伤、细胞膜通透性发生改变时,胞内的LDH会透过细胞膜释放到细胞外,LDH检测可作为评价细胞膜破坏程度的重要指标[10]。过量ROS可引起细胞膜脂质、蛋白质等生物分子的破坏,细胞内的LDH就会释放出来。本研究发现1~20 μmol/L的FUCO能显著降低模型细胞LDH的释放水平(P<0.05),表明FUCO可以抵御H2O2对细胞膜的破环作用,保护细胞膜的完整性,减轻H2O2引起的细胞毒性。

(*: 与空白对照组相比, P<0.05;#: 与模型组相比, P<0.01. *: P<0.05, vs Con;#: P<0.01, vs Mod. Con: 空白对照组Control group;Mod:1 000 μmol/L H2O2 模型组1 000 μmol/L H2O2Modle group; F1:1 μmol/L FUCO+1 000 μmol/L H2O2;F5:5 μmol/L FUCO+1 000 μmol/L H2O2;F10:10 μmol/L FUCO+1 000 μmol/L H2O2;F20:20 μmol/L FUCO+1 000 μmol/L H2O2; VE:50 μmol/L VE+1 000 μmol/L H2O2。)
3.4 FUCO提高H2O2诱导氧化损伤细胞的还原型谷胱甘肽含量
图4所示为各组细胞内还原型谷胱甘肽的含量。Con组细胞的GSH设为100%。从图中可以看出,与Con组相比, Mod组细胞内的GSH含量明显降低(P<0.05),下降至(72.55±5.00)%。VE和1~20 μmol/L的FUCO均可使细胞内的GSH含量显著增加(P< 0.01),且FUCO的作用呈现剂量-效应关系,20 μmol/L组GSH含量最高。
GSH是机体最重要的内源性抗氧化剂之一。H2O2刺激细胞后,细胞内的GSH可被H2O2氧化生成 氧化型谷胱甘肽GSSG,从而减少了脂质过氧化物的形成,可使细胞和机体抵御氧化应激的发生和发展。本实验发现1~20 μmol/L的FUCO可使H2O2诱导损伤的细胞内GSH含量显著增加。Ha等[11]的小鼠实验也发现FUCO能通过诱导小鼠体内超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)等抗氧化酶的高表达减轻高脂饲料引起的氧化应激。上述结果表明FUCO有可能通过促进细胞和机体的抗氧化酶表达发挥其抗氧化作用。

(*: 与空白对照组相比, P<0.05;#: 与模型组相比, P<0.01. *: P<0.05, vs Con;#: P<0.01, vs Mod. Con: 空白对照组Control group;Mod:1 000 μmol/L H2O2 模型组1 000 μmol/L H2O2 Modle group;F1:1 μmol/L FUCO+1 000 μmol/L H2O2;F5:5 μmol/L FUCO+1 000 μmol/L H2O2;F10:10 μmol/L FUCO+1 000 μmol/L H2O2;F20:20 μmol/L FUCO+1 000 μmol/L H2O2; VE:50 μmol/L VE+ 1 000 μmol/L H2O2。)
3.5 FUCO降低H2O2诱导氧化损伤细胞的活性氧
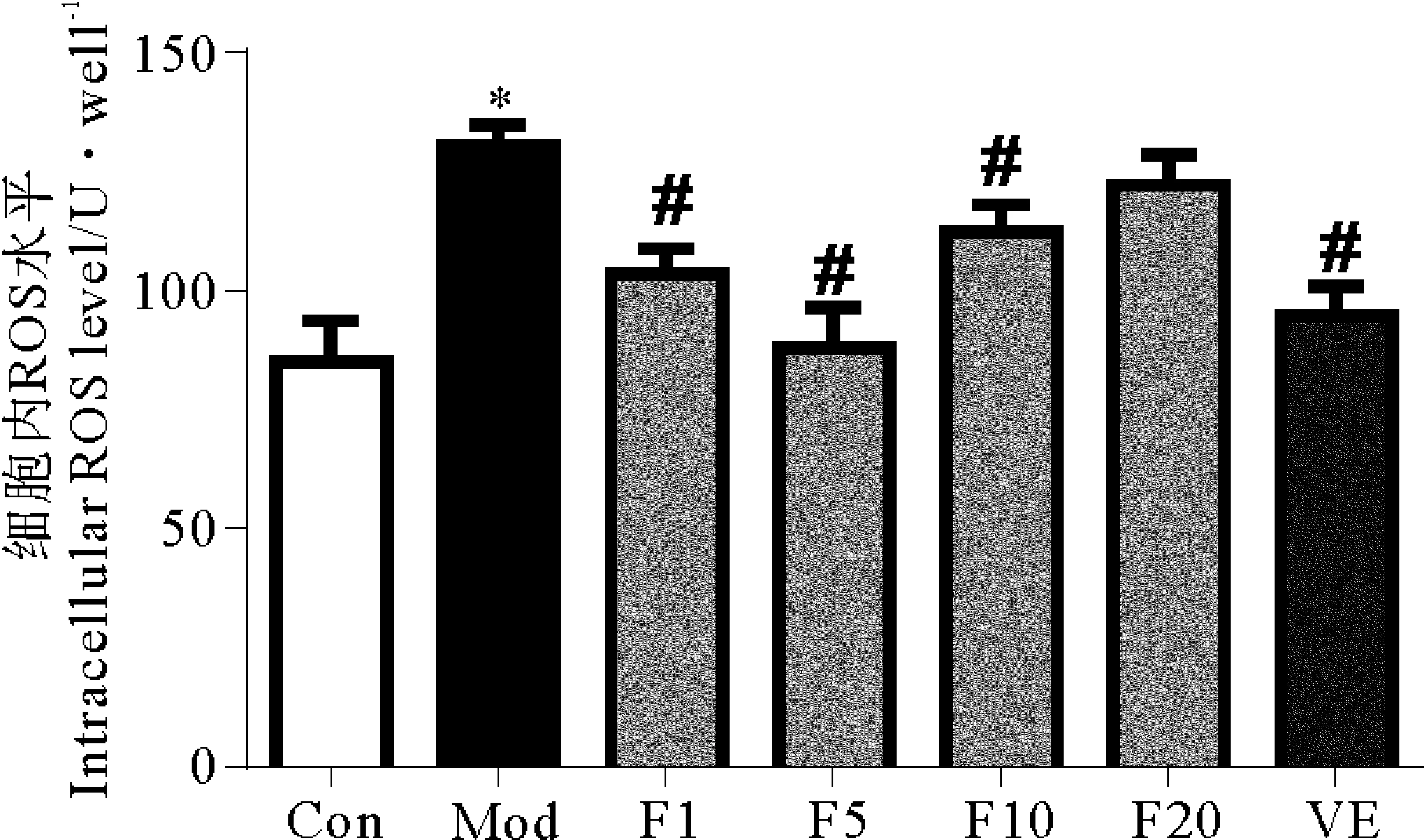
DCFH-DA是检测细胞内ROS常用的探针,是一种非荧光性化合物,在细胞内可被ROS催化产生能发荧光的DCF,从而可反映细胞内 ROS 的含量[12]。本实验用此方法检测细胞内ROS的结果如图5所示。Con组细胞内ROS为84.95±8.78,Mod组的ROS与对照组相比明显增高(P< 0.05),为130.44 ±4.22。药物与细胞预孵育24 h再经H2O2处理30 min,50 μmol/L VE与1、5及10 μmol/L的FUCO 均可显著抑制H2O2引发的细胞内ROS升高(vs Mod,P< 0.05),20 μmol/L的FUCO虽然没能明显降低ROS含量(P> 0.05),但也表现出了良好的清除ROS活性,20 μmol/L FUCO组细胞的ROS含量低于H2O2模型组。
LDH检测结果发现1~20 μmol/L FUCO可显著降低细胞LDH的释放,但20 μmol/L FUCO对LDH的抑制作用较1、5及10 μmol/L FUCO稍弱。这个结果可能与20 μmol/L FUCO对ROS的清除能力低于1~10 μmol/L FUCO有关。20 μmol/L FUCO对ROS的清除能力差,细胞内存在的ROS就多,对细胞膜的破坏能力强,因此细胞内LDH的释放就会增多。
尽管20 μmol/L FUCO对ROS的清除能力较差,但20 μmol/L FUCO组细胞内的GSH含量却较1、5、10 μmol/L FUCO组要高。细胞内的高GSH含量可能与20 μmol/L FUCO组细胞的活力最高有一定关系。
综合考虑上述实验结果,FUCO有可能通过多种复杂的调控机制保护细胞免于H2O2造成的氧化损伤,而不是通过单一或简单的方式应对氧化应激,具体作用机制还有待进一步的研究和探讨。
(*: 与空白对照组相比, P<0.05;#: 与模型组相比, P<0.05。*: P<0.05, vs Con;#: P<0.05, vs Mod. Con: 空白对照组Control group;Mod:1 000 μmol/L H2O2 模型组1 000 μmol/L H2O2 Modle group;F1:1 μmol/L FUCO+1 000 μmol/L H2O2;F5:5 μmol/L FUCO+1 000 μmol/L H2O2;F10:10 μmol/L FUCO+1 000 μmol/L H2O2;F20:20 μmol/L FUCO+1 000 μmol/L H2O2;VE:50 μmol/L VE+1 000 μmol/L H2O2。)
4 结语
本研究发现1~20 μmol/L 的FUCO能够清除H2O2诱发的胞内ROS,提高细胞GSH含量,降低细胞LDH释放率,提高细胞活力,具有良好的抗氧化作用。
抗氧化剂发挥抗氧化的作用主要通过2种方式:一是通过直接清除活性氧类物质发挥作用,二是通过诱导抗氧化酶的表达间接发挥作用。综合考虑本文及他人的研究结果,推测FUCO主要是通过直接清除ROS和诱导抗氧化酶的表达2种方式,通过多条调控路径来实现其抗氧化作用。

