外源多胺对红椿S-腺苷甲硫氨酸脱羧酶基因表达的调节作用
杨硕知 ,刘 球 ,,吴际友 ,李志辉 ,程 勇
(1.湖南省林业科学院,湖南 长沙 410004;2.中南林业科技大学,湖南 长沙 410004)
多胺是普遍存在于高等动物和植物体内的一类化合物。植物在进行多胺合成和分解代谢的过程中有许多的关键酶, S-腺苷甲硫氨酸脱羧 酶(S-adenosylmethionine decarboxylase,即SAMDC)就是其中一种,研究其基因的克隆、定位和表达,可一定程度上从分子水平解释多胺对高等植物生长发育和抗逆的调控规律[1]。到目前为止,SAMDC已经在一些植物中进行了提纯、分析,甚至遗传转化,发现这些转基因植物的多胺代谢能力有明显增强,抗旱等性能明显提升[2]。早在1962年,Tabor[3]就发现了SAMDC基因,并开始对其开展深入研究。到目前为止,科学家们已从动植物中克隆了约180个SAMDC基因,其中从植物中克隆出40多个[4]。科学家们还发现,几乎每个植物品种都包含不止一个SAMDC基因,比如,水稻和拟南芥[5]中有4个,番茄[6]中有3个,羊草[7]中有2个,且各个基因在植物不同器官中的表达特性各不相同。通过对比还发现,已知植物SAMDC基因的核苷酸序列同源性比较高,因此可推导出氨基酸序列的相似度也比较高[4]。
SAMDC基因表达具有组织器官特异性,调节着不同器官组织的代谢过程。有研究人员发现,在百脉草中SAMDC基因在根、茎、叶中表达的RNA水平不同,在茎中较低,在幼叶和根中较高,而成熟叶中不表达[8]。刘志勇等[9]发现,番茄SISAMDC1基因组序列全长为3 648 bp,有3个内含子,均位于5′-UTR,与其他植物SAMDC基因的同源性较高,但与动物、细菌等来源的SAMDC基因同源性较低。张梅等[10]发现,杜梨PbSAMDC基因全长1 683 bp,有358个氨基酸,该基因与MdSAMDC1的同源性高达96%,跟甜橙、葡萄中SAMDC基因的同源性也较高。从辣椒中克隆出SAMDC基因,然后将其转入拟南芥体内发现,在干旱胁迫下转基因拟南芥中的亚精胺(Spermidine,即Spd)和外源精胺(Spermine,即Spm)含量比野生拟南芥要高,说明转入的SAMDC基因提高了辣椒体内多胺的合成,有助于提高拟南芥抗旱能力[11]。李昌澎[12]以小麦品种‘晋麦47’为试验材料,扩增了SAMDC基因,采用BSMV-VIGS技术进行沉默,然后进行干旱胁迫和复水处理,结果发现,SAMDC基因的沉默降低了小麦‘晋麦47’抵御干旱胁迫的能力。
红椿Toona ciliata是楝科香椿属落叶大乔木,国家Ⅱ级保护濒危种,是湖南林业优先重点发展的珍贵用材树种之一。湖南地区的6ü9月最容易出现季节性持续干旱,然而红椿生长旺盛期也是6ü9月,如遇季节干旱,红椿的生长将遭受很大的影响[13]。本研究以红椿总RNA为模板,采用PT-PCR法克隆红椿S-腺苷甲硫氨酸脱羧酶基因TcSAMDC,并研究其在干旱胁迫及外源多胺修复处理下的表达情况,旨在了解多胺抗旱分子机制,探索红椿幼苗遭受季节性干旱胁迫后的有效修复措施,以防发生大面积苗木损毁,进而保证造林成活率。
1 材料与方法
1.1 试验材料
本研究以2年生红椿家系幼苗为试验对象。
1.2 试验方法
1.2.1 红椿TcSAMDC基因克隆
选取多种植物SAMDC基因表达的氨基酸序列进行分析比对,以期发现其保守区域,然后根据保守区域碱基序列设计引物。利用取得的引物,通过总RNA提取,反转录cDNA并使用PCR扩充获得目的基因片段。使用T载体克隆目的基因,PCR扩充后进行阳性菌落培养。将所获得的DNA序列测序,结果在NCBI数据库进行比对。
1.2.2 红椿TcSAMDC基因在外源多胺抗干旱胁迫条件下表达
根据已经测序出的红椿SAMDC基因序列,运用primer5设计荧光定量PCR引物,从而监测外源多胺在修复不同程度干旱胁迫时该基因的表达情况。
1.2.2.1 试验地概况
试验地位于湖南省林产品质量检验检测中心苗圃内,其地理坐标为东经112°59′、北纬28°05′,年平均气温16.8 ℃,平均日照时数1 496~1 850 h,年降水量1 400~1 900 mm,无霜期264 d,属中亚热带季风湿润气候区,光照充足,雨量丰沛;海拔为110 m,土壤为砂岩发育的红壤,土层厚达60 cm以上;土壤肥力中等,pH值为6.2[14]。
1.2.2.2 试验材料
本研究以2年生红椿家系幼苗为试验对象展开试验布置。2012年3月,在桃源县白家育苗圃进行田间播种育苗,并进行日常管护。2014年3月,选择长势均匀、健康无病虫害的红椿幼苗完成入盆,每盆一株,盆钵口径25 cm,深20 cm,每盆装土5 kg(黄心土∶泥炭土= 2∶1),配统一盆垫,正常浇水管护。2014年6ü7月,针对管护好的红椿盆栽幼苗布置干旱胁迫和外源多胺修复调节试验[14]。
1.2.2.3 试验设计与处理
本试验为双因素(干旱胁迫处理×多胺修复处理)试验,采用完全随机设计,植株干旱胁迫梯度有3种(轻度干旱、中度干旱和重度干旱),喷施多胺修复处理有3种(外源腐胺,即Putrescine简称 Put、外源亚精胺Spd和外源精胺Spm),先对参试植株进行持续干旱胁迫,然后再对其进行多胺修复处理并采样分析。5株每重复,重复3次,总共150株。
干旱胁迫处理:1)对照处理(CK),即每天浇水至饱和状态(土壤相对含水率45%~50%);2)轻度干旱胁迫,即持续干旱7 d(土壤相对含水率30%~38%);3)中度干旱胁迫,即持续干旱14 d(土壤相对含水率25%~30%);4)重度干旱胁迫,即持续干旱21 d(土壤相对含水率20%~25%)。于每天傍晚18:00采用美国便携式土壤含水率测定仪FIELD SCOUT TDR 200的200 mm探针进行盆栽土壤含水率测定,并采取叶片样品回实验室进行指标测定[14]。
外源多胺修复调节处理:分别在轻度、中度和重度干旱结束日起,每天傍晚18:00对轻度干旱胁迫对象喷施浓度为1 mmol·L-1的外源Put、外源Spd和外源Spm水溶液,贴近植株叶片正反面进行雾状喷施,喷施量以叶片正反面水珠凝结滴落为限,连续喷施3 d。
2014年6月10日正式开始试验,于2014年7月上旬试验结束。试验在人工遮雨棚中进行,保证正常的光照和空气条件,防止雨水入侵,保持棚内外温度一致。选择第三轮成熟叶片进行采样,将摘取的叶片放进避光的冰盒,迅速将其带回实验室进行下一步操作。
1.2.2.4 数据分析
基因表达数据采用SPSS19.0软件进行统计分析,用EXCEL2003进行制图。
2 结果与分析
2.1 引物设计结果
选取10种植物SAMDC氨基酸序列进行分析,发现存在两个高度保守区域,据此设计引物(见表1)。

表1 引物设计结果Table 1 Results of prime design
2.2 红椿TcSAMDC基因克隆结果
2.2.1 RNA提取
图1为红椿叶片RNA样品图。电泳槽用3%的双蒸水(灭菌DEPC处理水配制)处理0.5 h;配制1%变性琼脂糖凝胶,0.2 g琼脂糖,20 mL无菌1hTAE处理水,加热至琼脂糖溶解,冷至60 ℃,加入 0.5 μL EB(10 mg/mL),混匀后倒胶;取2 μL提取的RNA,按1∶5的比例与loading buffer premix混匀,120 V恒压电泳,溴酚蓝前沿迁移至凝胶总长2/3处停止电泳;凝胶成像系统下观察。图1为红椿叶片RNA样品图。为保证RNA的纯度以及浓度,后续克隆实验选择对照2号样品作为模板。

图1 TcSAMDC RNA提取结果Fig.1 RNA extraction results of TcSAMDC gene
2.2.2 cDNA扩增
图2为PCR扩增样品。电泳条件同2.2.1凝胶成像系统下观察。
图2 TcSAMDC基因PCR扩增图Fig.2 PCR amplification results of TcSAMDC gene
2.2.3 基因克隆
配制1%的琼脂糖凝胶,上样检测,将PCR产物中含有目的大小片段回收,产物与T载体连接后热激法转化DH5α感受态。
用无菌牙签挑取单克隆菌落,装入0.2 mL已灭菌的EP管中,用10 μL无菌水稀释菌落,取2 μL菌液进行PCR,按克隆目的片段的反应程序进行菌落PCR。扩增程序为:94 ℃预变性3 min,94 ℃变性 15 s,56 ℃退火 30 s,72 ℃延伸50 s共31个循环,72 ℃延伸7 min。电泳条件同2.2.1。红椿TcSAMDC基因克隆结果见图3。
2.3 红椿TcSAMDC基因测序及序列比对
测序得到一条532碱基对DNA。将测序得到的结果在NCBI数据库上比对,未找到相同的序列,结果如图4所示。
从比对结果可知,所得产物碱基片与芸香科甜橙以及克莱门柚的SAMDC基因相似度达79%,因此所得产物确实为红椿SAMDC基因,命名为TcSADMC。
图3 TcSAMDC基因克隆Fig.3 Clone of TcSAMDC gene

图4 TcSAMDC序列BLAST比对结果Fig.4 Comparison results of TcSAMDC sequence by BLAST
2.4 外源多胺对干旱胁迫下红椿叶片TcSAMDC基因表达的影响
2.4.1 引物设计结果
根据已经测序出的红椿TcSAMDC基因序列,运用primer5软件设计荧光定量PCR引物合成(见表2)。
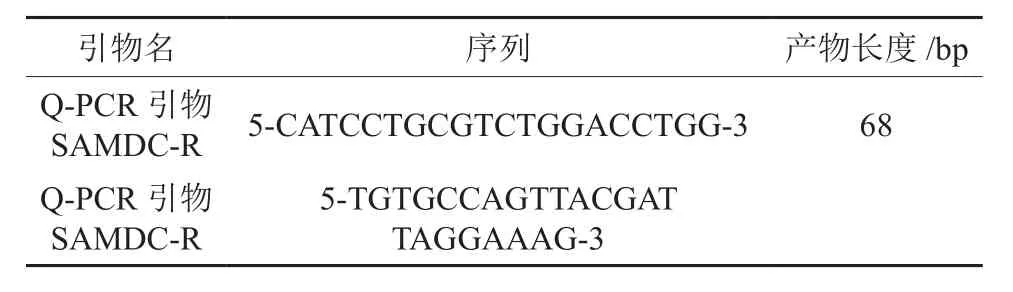
表2 荧光定量PCR引物合成Table 2 Prime synthesis of fluorogenic quantitative PCR
2.4.2 荧光定量PCR实验结果
由图5可以看出,各样品基因均有不同程度的表达量。

图5 红椿RNA电泳图Fig.5 RNA electrophoresis figure of T.ciliata
2.4.3 不同外源多胺对干旱胁迫下红椿叶片
TcSAMDC基因表达的影响
2.4.3.1 外源Put对干旱胁迫下红椿叶片TcSAMDC基因表达的影响
在对照、轻度干旱胁迫(或中度干旱胁迫,或重度干旱胁迫)和外源Put修复调节处理之间,红椿幼苗TcSAMDC基因相对表达量均呈现极显著差异(F=130.477,P<0.01;F=10 334.096,P<0.01;F=3 225.829,P<0.01)。如图6、表3所示,轻度干旱胁迫下,红椿幼苗TcSAMDC基因相对表达量比对照显著降低,降低幅度为13.90%,喷施外源Put处理后,相对表达量继续下降,幅度为胁迫状态下的15.25%;中度干旱胁迫下,红椿幼苗TcSAMDC基因相对表达量比对照显著升高,升高幅度为对照的3.67倍,在喷施外源Put处理后,相对表达量继续以更迅猛的速度升高,升高幅度为胁迫状态下的1.55倍,为对照状态的10.91倍;重度干旱胁迫下,红椿幼苗TcSAMDCC基因相对表达量比对照显著升高,升高幅度为对照的7.88倍,在喷施外源Put处理后,相对表达量有所下降,下降幅度为胁迫状态的51.15%,但仍是对照状态的3.34倍。
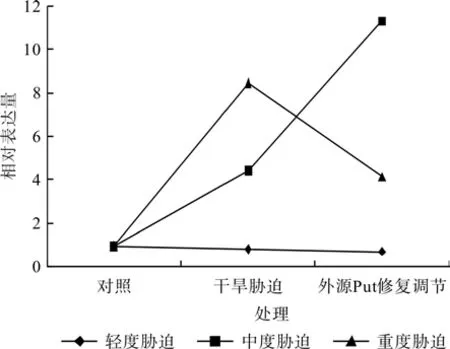
图6 外源Put对干旱胁迫下红椿叶片TcSAMDC基因表达的修复调节Fig.6 Repair and regulation of exogenous Put on leaf relative expression of TcSAMDC gene of T.ciliata seedlings under drought stress
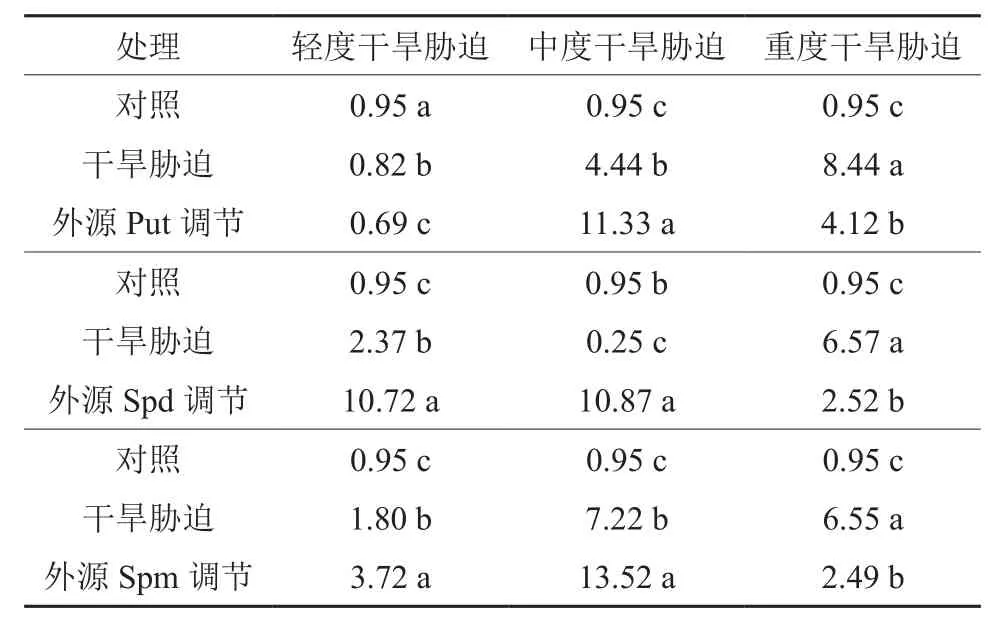
表3 干旱胁迫及外源多胺调节处理下的红椿TcSAMDC基因相对表达量活性†Table 3 Relative expression of TcSAMDC gene of T.ciliata seedlings under drought stress and exogenous polyamines adjustment and treatment
2.4.3.2 外源Spd对干旱胁迫下红椿叶片TcSAMDC基因表达的影响
在对照、轻度干旱胁迫(或中度干旱胁迫,或重度干旱胁迫)和外源Spd修复调节处理之间,红椿幼苗TcSAMDC基因相对表达量均呈现极显著差异(F=12 289.828,P<0.01;F=1 927.361,P< 0.01;F=2 961.419,P<0.01)。如图7、表3所示,轻度干旱胁迫下,红椿幼苗TcSAMDC基因相对表达量比对照显著升高,升高幅度为对照的1.5倍,喷施外源Spd处理后,相对表达量继续以更迅猛的速度升高,升高幅度为胁迫状态下的3.51倍,为对照状态的10.27倍;中度干旱胁迫下,红椿幼苗TcSAMDC基因相对表达量比对照显著下降,降低幅度为对照的73.55%,喷施外源Spd处理后,相对表达量飞速升高,升高幅度为胁迫状态的42.22倍,为对照状态的10.43倍;重度干旱胁迫下,红椿幼苗TcSAMDC基因相对表达量比对照显著升高,升高幅度为对照的5.91倍,然而喷施外源Spd处理后,相对表达量却迅速下降,下降幅度为胁迫状态的61.68%,仍是对照状态的1.65倍。
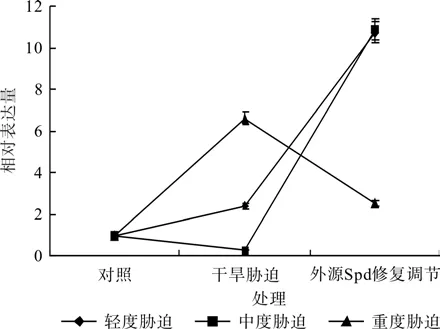
图7 外源Spd对干旱胁迫下红椿叶片TcSAMDC基因表达的修复调节Fig.7 Repair and regulation of exogenous Spd on leaf relative expression of TcSAMDC gene of T.ciliata seedlings under drought stress
2.4.3.3 外源Spm对干旱胁迫下红椿叶片TcSAMDC基因表达的影响
在对照、轻度干旱胁迫(或中度干旱胁迫,或重度干旱胁迫)和外源Spm修复调节处理之间,红椿幼苗SAMDC基因相对表达量均呈现极显著差异(F=2 510.552,P< 0.01;F=1 620.226,P<0.01;F=2 134.233,P<0.01)。如图8、表3所示,轻度干旱胁迫下,红椿幼苗TcSAMDC基因相对表达量比对照显著升高,升高幅度为对照的89.11%,喷施外源Spm处理后,相对表达量继续升高,升高幅度为胁迫状态下的1.07倍,为对照状态的2.91倍;中度干旱胁迫下,红椿幼苗TcSAMDC基因相对表达量比对照显著升高,升高幅度为对照的6.6倍,喷施外源Spm处理后,相对表达量继续升高,升高幅度为胁迫状态下的87.23%,升高幅度为对照的13.23倍;重度干旱胁迫下,红椿幼苗TcSAMDC基因相对表达量比对照显著升高,升高幅度为对照的5.89倍,喷施外源Spm处理后,相对表达量极速下降,下降幅度为胁迫状态的61.93%,但仍为对照状态的1.62倍。
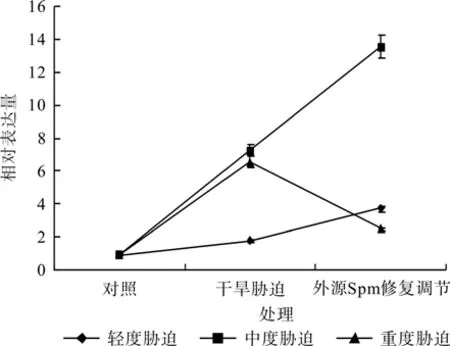
图8 外源Spm对干旱胁迫下红椿叶片TcSAMDC基因表达的修复调节Fig.8 Repair and regulation of exogenous Spm on leaf relative expression of TcSAMDC gene of T.ciliata seedlings under drought stress
2.5 外源多胺对干旱胁迫下红椿叶片SAMDC基因表达的修复调节效果比较
SAMDC是亚精胺(spd)和精胺(spm)的合成关键酶之一,它在多胺的合成过程中起催化脱羧反应,经过一系列的反应后,腐胺(Put)与脱羧的S-腺苷甲硫氨酸(SAM)提供的氨丙基合成亚精胺(spd)和精胺(spm)。SAMDC基因表达量高,则说明促进植物启动多胺合成关键酶基因SAMDC以抵抗胁迫的力度越大,因此,SAMDC基因相对表达量变化值越大,外源多胺所起到的修复调节作用越明显。
3种外源多胺在不同的干旱胁迫程度下对红椿叶片的TcSAMDC基因相对表达量修复调节效果不同(见表4),轻度干旱胁迫下,其修复调节效果呈现极显著差异(F=7 835.689,P<0.01);中度干旱胁迫下,其修复调节效果呈现极显著差异(F=154.212,P<0.01);重度干旱胁迫下,其修复调节效果差异不显著。从图9中可看出,轻度胁迫下,3种外源多胺试剂的修复调节效果大不相同,其中外源Put起到的是负向调节作用,而外源Spm和外源Spd则起到了显著的正向调节作用,其调节效果大小顺序为Spd>Spm;中度干旱胁迫下,3种外源多胺试剂均起到了显著的正向修复调节作用,其调节效果大小顺序为Spd>Put>Spm,以Spd效果最好, Put、Spm二者效果差别不显著;重度干旱胁迫下,3种外源多胺试剂均起到负向的调节作用,三者的负向作用差异不显著。综上分析可知,外源Spd和外源Spm对轻度干旱胁迫下红椿叶片SAMDC基因表达有很好的促进作用,进而促进内源Spd和内源Spm的有效合成,以修复干旱损伤,而外源Put则相反;外源Put、外源Spd和外源Spm三者均能非常有效地修复调节中度干旱胁迫下红椿叶片TcSAMDC基因表达,均能大力地促进内源Spd和内源Spm的有效合成,以修复干旱损伤,且以外源Spd效果最佳;然而,到重度干旱胁迫程度,可能因为植株体内细胞膜受损程度较大,以至于外源Put、外源Spd和外源Spm三者均不仅不能有效地促进红椿叶片TcSAMDC基因表达,反而对TcSAMDC基因的表达起到了明显的相近程度的抑制作用。

表4 外源多胺在不同程度干旱胁迫下的调节作用†Table 4 Regulating effect of exogenous polyamines on T.ciliata seedlings under drought stress in different degrees

图9 外源多胺修复对干旱胁迫下红椿幼苗叶片TcSAMDC基因相对表达量变化值的影响Fig.9 Repair and regulation effect of exogenous polyamines on variation value of leaf relative expression of TcSAMDC gene of T.ciliata under drought stress
3 讨论和结论
3.1 讨 论
植物多胺及其合成与代谢途径在很长一段时间以来一直是研究的热点。对该途径中关键酶基因的克隆、定位和表达,可从分子水平上解释多胺对高等植物生长发育和抗逆的调控规律[1]。常见植物多胺亚精胺和精胺是由腐胺与脱羧的S-腺苷甲硫氨酸(SAM)提供的氨丙基合成[15]。SAMDC是上述步骤中的限速酶,因此其受到了许多研究者的关注。
蔡秋华等[16]成功克隆了斑茅SAMDC基因并进行了原核表达实验。张高阳等[17]成功克隆了红麻SAMDC基因。曾庆飞等[18]克隆了高羊茅SAMDC基因并成功构建了原核表达载体。王凡龙等[19]对棉花的SAMDC基因家族的3个基因进行克隆和测序,并对其在不同胁迫条件下的表达方式进行了研究。王广龙等[20]克隆了胡萝卜DcSAMDC基因,并报道其能够在38 ℃高温、4℃低温、干旱胁迫以及高盐胁迫等条件下迅速响应。刘金仙等[21]对甘蔗ScSAMDC基因进行了克隆,且聚二乙醇或氯化钠等胁迫可以促进其表达,水杨酸或过氧化氢等胁迫对其表达具有抑制作用。文乐等[22]研究了甘蔗Sc-SAMDC3基因的克隆与表达,并进行了生物学信息及其表达特性分析,发现甘蔗Sc-SAMDC3基因表达量随着胁迫状态的持续呈现上调趋势,与本实验研究结论相似。本研究中,外源Spm和外源Spd对轻度干旱胁迫下红椿TcSAMDC基因表达有很好的促进作用,进而促进内源Spm和内源Spd的有效合成,以修复干旱损伤,而外源Put则相反;外源Put、外源Spm和外源Spd三者均能非常有效地修复调节红椿中度干旱胁迫下红椿TcSAMDC基因表达,均能大力地促进中度胁迫下植株内源Spm和内源Spd的有效合成,以修复干旱损伤;然而,到重度干旱胁迫程度,可能因为植株体内细胞膜受损程度较大,以致于外源Put、外源Spm和外源Spd三者均不仅不能有效地促进红椿TcSAMDC基因表达,反而对TcSAMDC基因的表达起到了明显的相近程度的抑制作用;说明用外源多胺刺激红椿TcSAMDC基因的表达对植株的抗旱是有一定程度效果的。刘玉等[23]研究发现,转入SmSAMDC基因可使烟草生理指标抗旱特征更加显著,通过表达SmSAMDC基因,可提高转基因烟草抗旱能力。王广龙等[20]对SAMDC基因进行了克隆和表达响应分析,发现模拟干旱200 g·L-1PEG 1 h后,DcSAMDC基因相对表达量相比对照提高了1.46倍。
本研究仅对2年生红椿盆栽苗进行了干旱胁迫修复试验,结论具有一定的局限性。在下一步研究中,可以考虑在本文研究基础上,对不同年龄段的实生苗进行抗干旱试验,同时增加喷施外源多胺的种类与浓度梯度,以期能够更好地解决生产栽培中的实际问题[24-26]。
3.2 结 论
1)本实验得到了红椿TcSAMDC基因的部分序列。将测序得到的结果在NCBI数据库上使用BLAST比对,未找到相同的序列。从比对结果可知,与所得产物碱基片段最相似的基因是芸香科植物的SAMDC基因,因此所得产物确实为红椿TcSAMDC基因片段。
2)本实验结果表明,在红椿叶片人为施加外源多胺能够在很大程度上影响植株的抗旱能力,并且不同种类的外源多胺在不同程度的干旱胁迫下对红椿叶片的抗旱性表现出不同的调节作用。
荧光定量PCR结果显示其本质原因是外源多胺的存在影响了TcSAMDC基因表达与内源多胺的合成,并且其促进或抑制程度与红椿叶片表现出来的抗旱能力具有一致性。其中,外源Spd和Spm在轻度、中度干旱胁迫下均表现出促进作用,且前者作用程度均高于后者;而外源Put则在轻度、中度干旱胁迫时表现出先抑制后促进的情况;重度干旱胁迫程度时,上述3种外源多胺对红椿叶片抗旱能力均起到了明显的抑制作用,且抑制程度相近,可能原因是植株体内细胞膜受损程度较大,导致基因正常表达过程受到阻碍或者被破坏。整体而言,外源多胺对红椿中度干旱胁迫修复效果较为显著;3种外源多胺中,以外源Spd对各胁迫程度的修复效果更为理想。

