同位素稀释液相色谱串联质谱法测定饲料中T-2和HT-2毒素含量
■蔡小明
(福建省产品质量检验研究院国家加工食品质量监督检验中心,福建福州350002)
T-2、HT-2毒素是由多种镰刀菌产生的一类霉菌毒素,广泛分布于自然界,主要存在于大麦、小麦、燕麦、玉米等谷物及其饲料制品,是一类常见的污染田间作物和库存谷物的毒素,也是目前报道的A类单端孢霉烯族毒素中毒性最强的真菌毒素,动物长期服用后易导致严重疾病甚至死亡[1-3]。欧盟在2006年就要求对T-2、HT-2毒素危害信息的收集、研究及检测方法开发,并建议对T-2、HT-2毒素的污染情况进行监控。2017年8月欧盟食品安全局(ESFA)发布了T-2毒素与HT-2毒素的膳食暴露风险,最大暴露量介于 0.12~0.16 μg/kg体重每天与2.37~2.58 μg/kg体重每天[4]。
目前,T-2、HT-2毒素检测方法研究主要针对的是食品类产品,而对饲料方面的研究较少。T-2、HT-2毒素测定方法主要有酶联法、液相法、气质法及液质法[5-8],酶联法检测容易产生假阳性,液相法及气质法检测需要对样品进行衍生,步骤繁琐且衍生剂毒性较大,相比之下液相色谱串联质谱法具有更简便、灵敏度更高的优势被广泛用于T-2、HT-2毒素检测。
本研究旨在采用同位素稀释液相色谱串联质谱法,建立饲料中T-2、HT-2毒素的检测方法,为饲料中T-2、HT-2毒素的监管和企业的自检提供技术支撑。
1 试验部分
1.1 主要仪器和试剂
Agilent 6490高效液相色谱仪配串联四极杆质谱仪(美国Agilent公司);Milli-Q超纯水纯化系统(美国Millipore公司);BT 224 S分析天平(德国赛多利斯公司);DS-8510 DTH超声波振荡器(上海生析超声仪器有限公司);XH-B旋涡混均器(江苏康健医疗用品有限公司);0.2 μm聚四氟乙烯(PTFE)滤膜(美国ASC)。
T-2、HT-2毒素及其内标,购于奥地利Romer公司;免疫亲和柱(T-2/HT-2 Star™ R美国Romer);试验用水为Milli-Q超纯水;其余试剂均为色谱纯。
1.2 色谱与质谱条件
色谱柱:HSS T-3(1.7 μm,2.1 mm Í100 mm);流动相:10 mmol/l乙酸铵(含0.1%甲酸)-乙腈梯度;流速0.3 ml/min;柱温:40 ℃;进样量2 μl。
流动相梯度洗脱程序见表1。

表1 液相色谱梯度洗脱程序(%)
离子源:电喷雾离子源(ESI);扫描方式:正离子模式(SEI+),多反应监测(MRM);脱溶剂气温度:200℃;脱溶剂气流速15 L/min;鞘气温度300℃;鞘气流速 12 L/min;毛细管电压:3.5 KV;T-2和HT-2毒素及其内标的母离子、子离子及碰撞能量等质谱分析参数见表2。

表2 T-2、HT-2毒素质谱测定条件
1.3 标准溶液的配制
1.3.1 混合储备液的配制
准确移取T-2、HT-2毒素液体标准品(浓度均为 100 μg/ml)1.0 ml乙腈定容至 100 ml,配制成浓度为1.00 μg/ml的标准储备液,保存于4℃冰箱中。
1.3.2 基质匹配标准工作曲线的配制
分别吸取一定量的混标标准储备液并加入内标,添加样品空白提取液,氮气吹干后,用流动相稀释成浓度为1.0~200 ng/ml的混合标准系列工作液,临用新配。
1.4 样品前处理
称取5.00 g(精确至0.01 g)均匀样品,置于50 ml聚丙烯离心管中,加入20 μl内标和20.0 ml 80%乙腈,振摇混匀,置于超声波振荡器中提取30 min,于4℃12 000 r/min离心5 min,将上清液转移至另一离心管中。
移取4.0 ml上清液,用40 ml PBS缓冲液稀释后,过免疫亲和柱,控制流速1~2 ml/min,用10 ml PBS缓冲液淋洗小柱,真空抽干,用5.0 ml甲醇以1~2 ml/min流速洗脱并收集,置于40℃水浴中氮吹近干,再用20%乙腈水溶液定容到1.0 ml,混匀,用0.2 μm聚四氟乙烯(PTFE)滤膜过滤后检测。
2 结果与讨论
2.1 仪器条件优化
根据目标物的结构,采用正离子模式,T-2毒素母离子(m/z)为489.3,HT-2毒素母离子(m/z)为447.1,优化相关质谱参数选择T-2毒素的定量/定性离子(m/z)对为:387.1/245.2,HT-2毒素的定量/定性离子(m/z)对为:345/284.9。试验表明,流动相中加入甲酸可以增强目标物的离子化效率,而加入乙酸铵可以改善目标物的峰形,最终确定以乙腈-10 mmol/l乙酸铵(含0.1%甲酸)作为流动相,总离子流图如图1。
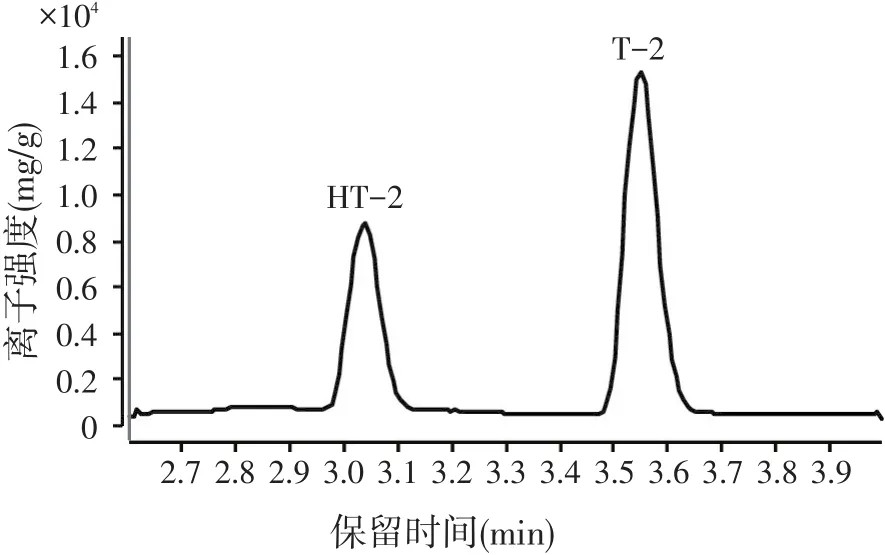
图1 T-2、HT-2毒素的总离子流图
2.2 提取溶剂的选择
采用加标回收方式对比了不同乙腈水比例溶液(体积比100∶0、90∶10、80∶20、70∶30、50∶50)对T-2、HT-2毒素回收率的影响,平行试验三次。结果表明:随着提取液中水含量的升高,T-2、HT-2毒素的回收率也随之增大,当提取溶剂中水含量达到20%(乙腈水80∶20)时,T-2、HT-2毒素回收率在81.1%~95%之间,当水的含量超过20%时,回收率基本不变,且提取液中明显浑浊。因此,选择乙腈水体积比80∶20作为提取溶剂。
2.3 线性范围和检测限
在1.0~200.0 ng/ml范围内配制六个不同浓度的标准溶液进行试验,以浓度为横坐标,峰面积与各自内标峰面积比值为纵坐标,绘制工作曲线,见表3,T-2、HT-2毒素线性关系较好(R2>0.999)。以3倍信噪比计算检出限(LOD)、10倍信噪比计算定量限(LOQ),T-2、HT-2毒素的检出限均为1.0 μg/kg,定量限均为3.0 μg/kg,满足痕量分析要求。

表3 线性方程、线性参数及线性范围
2.4 精密度与准确度
以阴性饲料样品作为基质,进行10、50、200 μg/kg三水平加标回收试验,每种水平平行试验6次(n=6),结果见表4,T-2、HT-2毒素平均回收率在81.5%~105.8%之间,相对标准偏差(RSD)在1.1%~2.8%之间,满足方法学要求。

表4 T-2、HT-2毒素回收率与精密度(n=6)
2.5 实际样品检测
随机购买市售16份不同类型饲料测定其T-2、HT-2毒素含量,有四份样品饲料检出T-2含量在21~218 μg/kg,其中一份样品同时检出HT-2毒素含量为42 μg/kg,说明所建立方法适用于饲料中T-2、HT-2毒素的检测。
3 结语
本文建立了饲料中T-2毒素和HT-2毒素含量的同位素稀释液相色谱质谱的测定方法,该方法操作简单、准确、检测限低、重现性好,适用于饲料中T-2、HT-2毒素的检测。

