黄曲霉毒素B1在乳畜中的转化
■吴坤坦 齐德生
(华中农业大学动物营养与饲料科学系,湖北武汉430070)
黄曲霉毒素主要是黄曲霉和寄生曲霉产生的一类高致癌致畸性的次级代谢产物,包括黄曲霉毒素B1、B2、G1、G2。其中黄曲霉毒素B1(Aflatoxin B1,AFB1)毒性和致癌性极强,其次是黄曲霉毒素M1(Aflatoxin M1,AFM1)。哺乳动物摄入的AFB1主要在肝脏由多种细胞色素氧化酶如CYP1A2作用形AFBO后发生进一步代谢,或者羟化其末端呋喃上C-10生成AFM1并进入乳汁中。AFB1在乳腺组织和瘤胃中也可代谢产生AFM1,因此减少AFM1向乳汁的转移,保障奶产品的食品安全越来越受到人们的关注。
1 AFB1在肝脏的代谢
1.1 AFB1在肝脏中的代谢过程
AFB1因其在未被代谢活化之前不具有致癌性而被称为前致癌物,经过代谢激活后形成环氧化物才具有致癌性(蒿艳蓉等,2009)。
动物主要是在肠道吸收AFB1,而肝脏对AFB1进行代谢转化,摄入后约有50%~60%的AFB1在十二指肠被吸收,未被吸收的AFB1通过粪便排出体外。AFB1进入机体后经体内多种P450家族(如CYP1A2、CYP3A4、CYP2A6等)代谢转化为多种代谢产物(齐琪,2012)。CYP1A2作为肝脏中公认代谢AFB1的优势酶,可将AFB1氧化为AFM1、AFQ1和AFB1-endo-8,9-环氧化物,而CYP3A4氧化AFB1为AFQ1和AFBO,其中AFM1、AFP1、AFB1-endo-8,9-环氧化物可直接经尿液排出体外(蒿艳蓉等,2009)。但近年来有报道发现,CYP2A13也可以高效代谢活化AFB1,但CYP2A13在人呼吸道器官中特异性高表达,而CYP1A2几乎不在该组织中发挥作用,因此CYP2A13可能与呼吸组织代谢AFB1有关(陆慧媛,2012)。AFM1在动物体内生成后,部分可与葡萄糖醛酸结合经胆汁进入小肠并经粪便排出体外(Stubblefield等,1983),由于羟基可使其水溶性提高,因此AFM1可通过尿液、胆汁和乳汁迅速排泄(Egmond,1983)。一部分AFBO可与谷胱甘肽(Glutathione,GSH)在机体Ⅱ相转移酶如谷胱甘肽转移酶(GSTs)作用下结合,形成AFB1-硫醇尿酸(AFB1-mercaptutic acid,AFB1-NAC)并经尿排出体外(Swenson等,1977);另一部分AFBO与DNA结合形成AFB1-N7-鸟嘌呤加合物(aflatoxin-N7-guanine,AFB1-N7-GUA)。通过DNA修复过程可快速将大部分AFB1-N7-GUA加合物清除后通过尿液排出体外(蒿艳蓉等,2009);还有一部分与血清白蛋白结合后主要以AFB1-赖氨酸复合物的形式残留于血液中;此外,还有约五分之一的AFBO开环后毒性降低,以AFB1-甲酰氨基嘧啶复合物经尿液排出体外。其转化过程可归纳如图1所示。
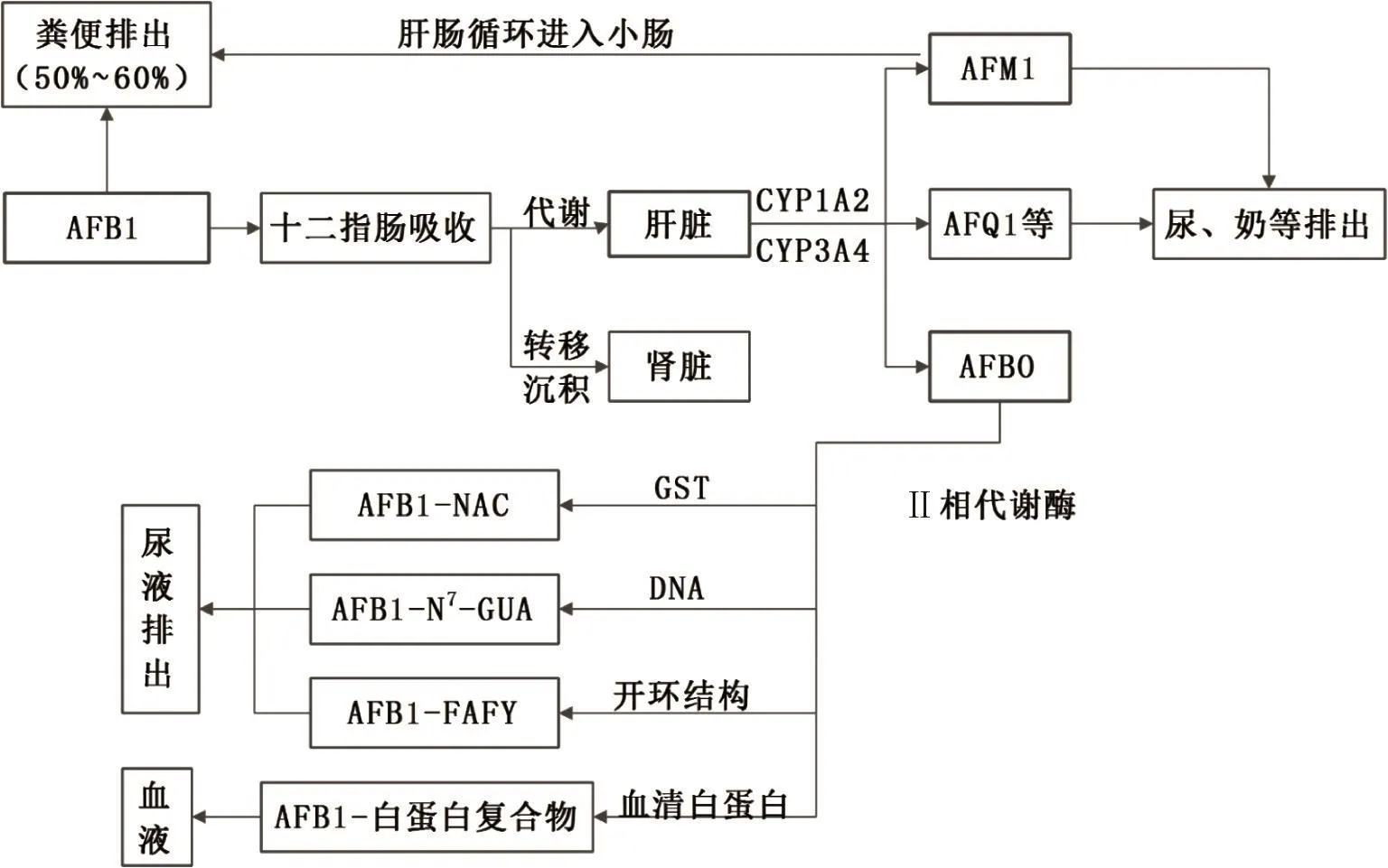
图1 AFB1在体内转化的过程
1.2 AFB1在体内的转运
AFB1摄入后主要在肝肾处积累且肝脏中的毒素浓度低于肾脏。Shreeve等(1979)试验发现AFM1都出现在牛的肾脏,且肾脏中AFM1的浓度显著高于肝脏,说明AFM1主要残留于肾脏中。Stubblefield等给奶牛口服黄曲霉毒素后,几乎在牛的所有组织样本中都发现了两种黄曲霉毒素;肝脏中AFB1浓度比AFM1高,而肾脏AFB1水平比AFM1低,说明不同组织内主要残留的毒素不相同。
AFB1的主要排泄途径是粪便。有报道指出粪便排泄出含量最高的黄曲霉毒素是AFB1,同时也检出了AFM1(Allcroft等,1968)。有学者给泌乳山羊口服放射元素标记的AFB1后检出约为摄入量50%的AFB1(黄帅等,2015)。纯品AFB1向乳中转化效率高于饲料AFB1,且添加高剂量AFB1组转化效率低于低剂量组,这可能是高浓度毒素还未完全吸收便排出体外的缘由(姜雅慧等,2010)。
2 饲料中的AFB1转化为乳中AFM1的过程
在肝脏中AFB1末端呋喃上C-10被羟化生成AFM1后约数小时便可排泄到乳中,而经过几天便可完全清除。AFM1也可由曲霉菌直接产生,但比例较低(王蕾,2008)。研究表明AFM1转移至乳中的比例约为摄入AFB1为0.1%~6%,高产奶牛可高达6.2%(Coffey等,2009)。Britzi等(2013)建立了AFM1转化率与产奶量之间的回归方程:转化率=0.515 4e0.0521×产奶量(R2=0.622 4),不同泌乳阶段之间AFM1的转化率也存在着巨大差异,结果反映AFM1的转化率随着产奶量的增加而提高。相关性统计说明原奶中AFM1与饲料中AFG1和AFG2之间无明显相关性而与饲料中AFB1之间存在正相关关系(徐华坤,2013)。
有许多外界和动物的因素变化会影响到AFM1进入乳中的含量,如AFB1摄入量、物种差异、乳腺细胞健康情况、饲料中青贮料的比例等(黄帅等,2015),泌乳阶段的不同也能导致AFM1的转化率出现较大差异,两者呈现正相关关系。产奶量是影响AFM1转化效率的主要因素而体细胞数与AFM1的转化率并不相关(Masoero等,2007)。实际生产情况可能更为复杂,因为随着奶牛个体和健康的差异和生产水平的不同,奶牛和AFB1接触时间的不同,转化率可能会差异很大,大多数试验表明AFM1在乳汁中的转移率平均值为1.7%(Coffey等,2009)。由此看来,奶牛日粮中AFB1浓度即使低于20 μg/kg,也有可能导致牛奶中AFM1残留超过0.4 μg/kg,因此可以推测,假设日粮中摄入AFB1水平基本不变,牛奶中AFM1残留却有可能在某一时期超标。如果按照1.7%的转化率计算,那么当日粮AFB1含量大于30 μg/kg时,牛奶中AFM1的含量就会超过0.5 μg/kg;当日粮中AFB1含量大于3 μg/kg时,牛奶中AFM1的含量就会超过0.05 μg/kg(纪少丽等,2012),并且当牛奶浓缩加工后情况变得更为严重。
AFM1主要是通过尿液排泄的,AFB1也可经此途径排出体外。Galtier(2010)研究AFB1经消化吸收和肝胆循环后平均约2%出现在尿液中,而Helferich等(1986)研究发现口服放射元素标记的AFB1后,尿液检测到放射性物质总量占摄入量不足三分之一,这说明AFB1不是通过尿液排出体外。Fernandez等(2015)让24头在泌乳期的山羊每日采食含2.5 mg/(kg·d)黄曲霉毒素的日粮三周后检测尿液,发现尿液中含量最高的黄曲霉毒素是AFM1。
3 AFB1对乳腺上皮细胞的影响
乳畜摄入的AFB1在体内被转化为AFM1并随着乳汁排出,这一过程通常被认为是排毒过程,因为AFM1的毒性大约只是AFB1的10%,但AFM1进入乳制品后持续危害着人类的健康(陈丹,2016)。乳腺上皮细胞间形成的紧密连接(又称为血乳屏障)是阻止某些物质由血液进入乳腺组织的天然屏障,具有不可渗透的特性。同某些治疗药物一样,霉菌毒素需要特定的转运蛋白进行转运,并且转运效率受到血液pH值变化影响很大。正常机体内血液pH值高于牛奶pH值,但有些疾病(主要是乳房炎)或者药物会导致两者pH值接近甚至颠倒,造成转运效率提高,AFB1转化率高于平常(施琼等,2012)。BME-UV1具有乳腺上皮细胞的功能和生化标志物,并能够合成α-乳清蛋白和α-酪蛋白,因此常作为牛乳腺上皮代谢模型来研究AFB1的代谢和细胞毒性,在BME-UV1细胞中添加2~16 μmol/l AFB1培养24 h后细胞活力便出现差异性(Caruso等,2009);而Caruso等(2008)用2~8 μmol/l处理后,检测出AFM1的转化率约为0.01%~0.1%;Kamataki等(1992)与Kitamura等(1992)也用MCF-7细胞检测AFB1的细胞毒性。
环境中的有毒物质可能也是某种转运蛋白的配体。有的物质自身便可以增加转运蛋白的表达,有的则是在其它物质的干预下提高转运效率。ABCG2基因在奶牛、小鼠和人的乳腺组织中均有表达(Jonker等,2005),其蛋白在药物与毒素转运中起到重要作用。在乳腺组织中,AFB1是在ABCG2蛋白协助下转运到乳汁中(Van Hawarden等,2006),使其在乳汁中的浓度被大大提高,AFM1作为AFB1的代谢产物也有可能是由转运蛋白ABCG2蛋白转运的(Sarkadi等,2004)。陈丹(2016)对ABCG2基因进行过表达后,乳腺细胞中AFM1的含量显著升高;而基因抑制后毒素含量下降,说明AFM1在乳腺细胞的转运中ABCG2基因发挥了重要作用。二噁英类物质(如PCB-126)污染牧草并被乳畜长期摄入可增强ABCG2蛋白向牛奶中的转运外源性物质的潜力,导致AFM1在乳制品中含量大幅增加(Manzini等,2017)。STAT5A基因在乳腺上皮细胞的生长和增殖中起着非常重要的作用,并影响上皮细胞的间隙连接,AFB1处理细胞可能诱导了DNA损伤,引起STAT5A基因表达下调了约80%(Forouharmehr等,2013)。因此,通过研究AFB1对乳腺细胞的影响和机理,进而探索降低AFM1进入乳汁的措施和影响转化的因素,为降低有害物质污染奶及奶制品的水平,保障乳制品安全提供基础数据和理论依据。未来可应用在研究其它毒物与药物穿越血乳屏障的机制机理。
4 AFB1在瘤胃中的代谢
4.1 AFB1在瘤胃中的代谢研究
有许多学者研究了AFB1在瘤胃中的代谢。有学者发现黄曲霉毒素在山羊中的代谢率比阉牛高两倍以上(Upadhaya等,2009),瘤胃壁可以快速吸收AFB1在肝脏代谢,直到120 min后AFB1才主要由肠道吸收(Moschini等,2010)。还有学者注意到瘤胃微生物与黄曲霉毒素之间的相互作用。Fedele等(2010)报道了在体外发酵瘤胃液中添加1 mg/kg的AFB1仅1 h后代谢率达到90%并检测到AFM1;Auerbach等(1998)用14C标记AFB1后在瘤胃内容物中只发现了黄曲霉毒素醇的产生,认为检测到的AFM1是肝脏产生后通过瘤胃-肝脏通路循环返回至瘤胃中的。也有报道发现AFB1在瘤胃中没有发生明显降解(Westlake等,1989)。有学者研究体外静态培养的瘤胃微生物对毒素的代谢,在培养物中添加不同浓度的AFB1后降低了氨态氮浓度和甲烷产量,同时总挥发性脂肪酸和乙酸、丙酸等产量也逐渐下降(P<0.05),并抑制了纤维素酶活(姜雅慧等,2010),这可能是AFB1扰乱了瘤胃微生物的繁殖和功能的缘故。试验发现挥发性脂肪酸在10 μg/ml毒素时浓度较低,推测在该水平下与纤维分解相关的微生物的活性受到抑制(齐琪,2012)。
4.2 降解AFB1的微生物
目前已报道的去除黄曲霉毒素的菌株基本上是通过菌体细胞壁的吸附作用来发挥作用,而目前得到的、降解AFB1的微生物在体外的最佳条件下降解效果较好,但缺乏进一步的动物试验验证。雷元培等(2011)分离出的枯草芽孢杆菌,能够产生降解AFB1和AFM1胞外酶,其菌体培养物对AFB1和AFM1的分解率可达到81%和63%,且此细菌抗逆性及抗菌性均较好。李超波等(2012)报道了一株施氏假单胞菌能够降解黄曲霉毒素B1,但降解效率较低,72 h后分解率才能达到82.91%。Farzaneh等(2012)报道的菌株UTBSP1能在24 h内降解85.66%的AFB1。张志敏等(2014)从秦川牛瘤胃中分离到芽孢杆菌WZ-2,在体外发酵培养72 h可使AFB1分解率达到79%,他同时还指出长期接触霉菌毒素的反刍动物瘤胃内容物中可能存在能降解霉菌毒素的细菌。崔玉琦(2014)从非洲象粪便中分离的芽孢杆菌E-1-1-1产生的胞外酶的五个组分蛋白对AFM1有不同程度的降解,而组合后最优条件下分解率达到了94.3%,可能降解黄曲霉毒素的活性蛋白是一种复合蛋白的缘故。
4.3 微生物降解AFB1研究现状
黄曲霉毒素的脱毒按类型可分为物理脱毒法、化学脱毒法和生物脱毒法,生物脱毒法又分为吸附脱毒和降解脱毒两方面。吸附脱毒由于吸附过程是可逆的,外界变化后可能将吸附的毒素重新释放出来,造成使用时效果不稳定;而降解脱毒直接将毒素降解为低毒或无毒物质更加安全彻底。直接将微生物用于降解黄曲霉毒素的报道不多,目前较为有效的办法是利用微生物的胞外代谢产物来分解黄曲霉毒素(崔玉琦,2014),李超波等(2012)指出,虽然真菌能够降解黄曲霉毒素,但消耗时间长且不完全,因而影响实际应用。国内报道关于AFB1降解菌主要有嗜麦芽窄食单胞菌、施假单胞菌、枯草芽孢杆菌、乳酸菌和醋酸菌等,其中酵母和乳酸菌这些微生物主要是通过细胞壁吸附毒素(朱新贵等,2001)。有许多研究发现能降解黄曲霉毒素的微生物有细菌,霉菌,酵母菌等,但考虑到代谢副产物如色素以及菌株生长条件差异大,其实际使用效果有待提高。例如有学者在40头生长育肥牛日粮中添加AFB1分解酶,仅有平均日增重提高11%(崔捷,2013),并且缺乏相关代谢酶添加剂应用饲料中降解黄曲霉毒素的报道。因此今后利用分子生物学、基因拼接技术和DNA重组技术等手段,对解毒酶提取液进行分离纯化获得单一活性蛋白,同时克隆有效成分蛋白基因并在载体中进行高效表达,这是饲料安全新的研究趋势(计成等,2010)。
5 牛奶中AFM1的控制措施
奶牛摄入AFB1及其代谢产物后不仅危害健康进而引起代谢疾病,还会降低生产性能和免疫力,最后进入牛奶中威胁乳制品的食品安全。我国《GB 13078—2017》中对饲料中AFB1的标准是不高于20 μg/kg,而《GB 2761—2017》规定乳和乳制品中AFM1的不高于0.5 μg/kg;FDA和欧盟《EU NO.165/2010》中要求中AFM1的含量不高于0.05 μg/kg,而对婴幼儿的奶粉不高于0.025 μg/kg。因此采取有效措施控制牛奶中AFM1十分重要。根据控制阶段的不同可划分为预防黄曲霉毒素的产生、脱去饲料中的毒素或者去除毒素的毒性和消除牛奶中的AFM1等几个环节。
5.1 预防黄曲霉毒素的产生
重视饲料原料质量和安全,减少日粮中摄入黄曲霉毒素水平是控制牛奶中AFM1最为经济有效的措施。可通过培育抗曲霉菌的作物、科学计划安排种植与收获和适当运输与仓储措施来降低饲料中霉菌毒素的水平,从源头控制牛奶中的毒素水平(Bryden,2001)。通过对原料控制可以有效减少奶牛对黄曲霉毒素的摄入,但这些还不足以保障乳制品的食品安全,因此需要采取其他措施来进一步减少AFM1的残留风险。
5.2 物理、化学与生物解毒法
对于已经存在于饲料中黄曲霉毒素可采用多种方法脱去或者降低毒性,有物理解毒法、化学解毒法和生物解毒法。物理解毒法包括高温失活、射线处理以及微生物细胞壁脱毒法等;化学解毒法是通过酸碱溶液等化学物质进行处理,但是存在饲料营养物质损失较大、污染环境和成本高等问题。生物脱毒法是通过添加微生物或者相关酶对毒素进行降解,有许多学者在体外分离到降解效果较好的枯草芽孢杆菌等,但缺乏进一步体内试验验证,并且存在成本和使用效果不佳等问题。目前使用较广的解毒方法是矿物质吸附法,它的原理是利用膨润土、硅铝酸盐及活性炭等吸附性强的物质吸附霉菌毒素,从而显著降低霉菌毒素被机体吸收代谢的浓度(施琼等,2012)。
5.3 消除牛奶中的AFM1
研究发现,经过4周的存储,pH值为4.6的酸奶中AFM1并没有显著减少;然而pH值为4.0的酸奶经过4周存储后,2种污染浓度酸奶中的AFM1均发生了明显减少。因此,低pH值可能会降低AFM1的含量(Govaris等,2002)。有研究发现,高温处理能够清除32%以上的AFM1(Purchase,1967),使用酸奶中不同菌株的乳酸菌可以降低AFM1水平(Elsanhoty等,2014)。
6 小结
目前我国对于奶制品的安全采取了一些措施,但婴幼儿奶粉食品安全事件仍然时有发生,这反映了目前针对乳制品的安全控制措施仍不完善,因此牛奶中的安全问题持续受到人们的广泛关注。AFM1残留超标作为目前危害乳制品安全的主要问题,控制其污染水平,确保国民健康安全已经迫在眉睫。解决这些问题首先应以预防为主,给乳畜饲喂优质的日粮,从源头上减少黄曲霉毒素的摄入;其次辅以一些解毒剂和脱毒剂,减少黄曲霉毒素的吸收和代谢;还可以在瘤胃和消化道定植有益的微生物降解毒素,并且研究黄曲霉毒素对乳腺上皮细胞的影响和机理,对减少毒素穿越血乳屏障以及增加动物对毒素的代谢率,维持乳畜健康都有着重要意义。

