高原地区藏族人群慢性鼻窦炎炎症模式与微生物定植相关性研究*
边片 巴罗 次仁德吉 米玛 杨芳丽 巴顿
(1.西藏日喀则市人民医院综合内科,西藏 日喀则 857000;2.西藏自治区人民医院耳鼻咽喉科,西藏 拉萨 850000)
慢性鼻窦炎严重影响人类健康生活,其发病率呈不断增长趋势,在西方国家发病率高达20%以上[1]。我国各地方慢性鼻窦炎的患病率和发病率都较高并有逐年增加趋势,但目前尚无权威性流行病学统计数据。目前慢性鼻窦炎伴息肉(CRSwNP)研究较为广泛且存在区域及种族间显著差异;最典型特征免疫效应性T细胞上目前慢性鼻窦炎中已知的有Th1/Th2/Th17等细胞,在欧美人群中慢性鼻窦炎中慢性鼻窦炎不伴息肉 (CRSsNP)中以Th1/Th17占优势,而CRSwNP中以表现Th2占优势并且与哮喘发病存在显著相关[2-3]。相反在相似临床特征的亚洲人种鼻息肉中相对缺乏嗜酸性粒细胞浸润及相关因子的表达,主要以中性粒细胞浸润并相关因子表达为主,并且以Th1/Th17极化特征;其哮喘发病率较低且与金葡菌超抗原无显著相关性[4-5]。近年来国内不同地区慢性鼻窦炎研究发现其免疫表型及机制尚存在较大差异,表明慢性鼻窦炎异质性很强[6-8]。西藏高原地区门诊病人中慢性鼻窦炎居耳鼻咽喉科疾病谱首位,藏族人群大部分居住于平均海拔4000米以上的寒冷空气稀薄地带、日照长湿度低等环境相对恶劣,加之医疗条件相对较落后及诊疗观念较为传统[9]。造成人群中慢性鼻窦炎从病因、发病机制特点上与其它地方可能存在较大地域差异,为此我们对该人群中CRS进行深入研究,以有助于发现更有效的治疗靶点。
1 对象和方法
1.1 对象选择 分别收集2016年3月~2017年10月在日喀则市人民医院和西藏自治区人民医院耳鼻喉科就诊的105例患者(女性46名,男性59名),年龄16~60岁;其中慢性鼻窦炎35例(CRSsNP 35例),慢性鼻窦性伴鼻息肉40例(CRSwNP 40例),鼻中隔偏曲30例(对照组)。术前所有患者停用各种剂型类固醇激素和抗生素至少3周以上。排除和纳入标准按EP3OS指南[1]。标本收集;CRSwNP患者样本取自息肉组织,CRSsNP患者钩突及筛窦黏膜,对照组织样本取自中隔偏曲行鼻中隔成型术患者的部分中鼻甲粘膜组织。将组织样本于术中采集后迅速置于液氮中冷冻并转送实验中心储存于-80°C 冰箱标本库免疫检测备用,另将较小块用于免疫组化分析的组织于4%福尔马林固定并继石蜡包裹。对所有筛选进入研究的受试者均术前对症状进行VAS分级评分及咽式子鼻腔分泌物送微生物细菌培养等。
1.2 研究方法
1.2.1 免疫荧光检测炎症因子 将105例标本先行称重,每0.1g 标本加入1.0ml 0.9%NaCl溶液,匀浆前加入混合蛋白酶抑制剂(Complete Roche; Mannheim, Germany)。组织匀浆(Braun 匀浆器1500rpm转速5分钟)。匀浆液在4°C下离心(3000rpm转速,15分钟),收集上清液分装EP管-80°保存待免疫物质检测分析。采用Luminex 100分析仪(Luminex 100 System, Ausin, Tesas USA),试剂盒为Fluorokine MAP Multiplex Kits (R&D Systems, Minneapolis,MN,USA),测定 IL-1β、IL-2sRα、IL-5、IL-6、IL-8、IL-17和 IFN-γ等, 使用Unicap100分析仪检测ECP、MPO 和总IgE水平,操作步骤严格依从试剂盒说明。
1.2.2 免疫组化 主要用于评估B细胞(CD20)、单核巨噬细胞系统(CD68)、浆细胞(CD138)、肥大细胞(肥大细胞类胰蛋白酶)、T细胞(CD4)及中性粒细胞(MPO)等。石蜡切片37℃风干24小时,常规脱蜡至水;蒸馏水洗3次;进一步分别与1%浓度的鼠坑人单克隆抗体;CD20 (clone L26; Dako)、CD68 (clone EBM11;Dako)、CD138 (clone MI15; Dako)、MPO (clone 2C7; Serotec, Oxford, UK)、肥大细胞类胰蛋白酶(clone AA1;Dako)以及1%人抗CD4抗体(AF-379-NA, R&D)在30°C下培养45分钟后用三羟甲基氨基甲烷缓冲盐水冲洗10分钟,并且进一步与EnVision (DaKo Cytomation, California, USA)。再次在30°C下培养45分钟,所有操作使用免疫组化全自动染色机(Autostainer,DaKo,USA)完成,最终苏木精复染。染色后的切片被酸化水用两步法冲洗,然后用100%的乙醇通过三步法脱水并且用Permount TM 爬片设备(Bioss, Beijing, China)爬片,中性树胶封固。
1.2.3 微生物鉴定 术前无菌操作下利用咽式子于双侧鼻腔中鼻道取出分泌物送微生物细菌培养,按照严格无菌原则将分泌物分别在羊血琼脂 (DiMed, St.Paul,Minn USA), 伊红美蓝琼脂(Baltimore Biological Laboratories, Cockeysville,Md. USA) 和巧克力琼脂(BioMerieux, Marcy l'Etoile, France)等培养基上培养。所有培养基根据菌种需要在25-37℃室温及有氧或无氧条件下培养,根据细菌学方法分别在24小时,48小时及72小时不同时间段上观察细菌生长情况,若超过72小时无细菌生长视为无培养菌。培养满3天后通过浊度分析法将明确生长或怀疑生长的菌落分别置于3种不同Vitek系统细菌菌谱鉴定卡(bioMérieux, 中国上海),主要由;GP卡辨认所有革兰氏阳性球菌,GN卡辨认所有革兰氏阴性杆菌和YST卡辨认芽孢真菌类等,按照使用说明培养鉴定[7]。光学扫描器根据测量光线强弱来决定细菌菌种。数据资料将ID 32E 系统分析。
1.3 统计学分析 数据资料应用统计分析软件包SPSS18.0进行统计学分析。定量资料采用非参数检验(秩和检验Kruskal-Wallis和Mann-Whitney 双尾U检验),检验水准α=0.05;基线变化分析采用方差分析或Fisher确切概率法及卡方检验等。
2 结果
2.1 三组一般资料及临床特点比较 根据EPOS指南对纳入的各组进行临床症状评分,两组鼻窦炎与对照组相比有较显著差异。主要表现在;总症状评分明显偏高,以鼻阻,流涕,头疼及失嗅为主要症状。其中鼻息肉中以鼻阻、失嗅、鼻痒症状和哮喘发病率有显著升高,而单纯鼻窦炎中以头痛及流涕较为明显。影像学上鼻息肉积分最高鼻窦炎为其次各组间有统计学差异。见表1。
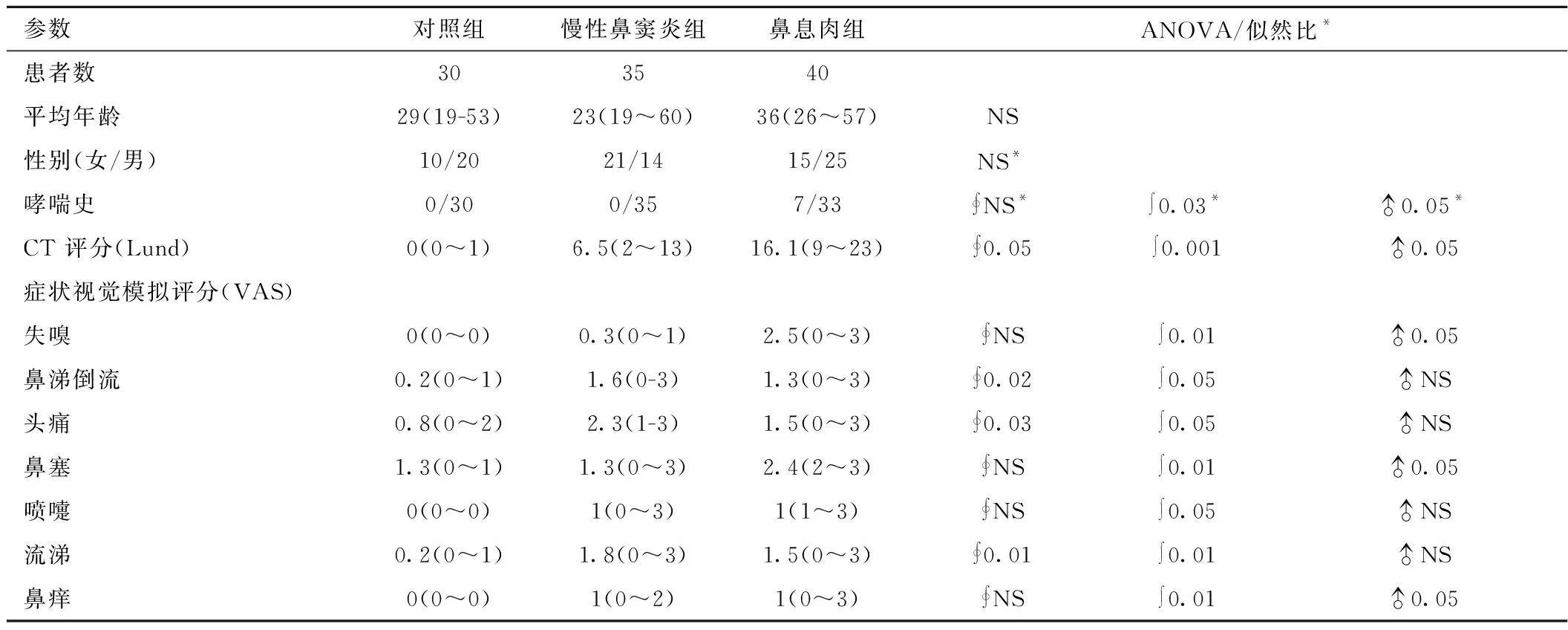
表1 三组一般资料及临床症状比较 Table 1 Patient characteristics and symptom scores
2.2 藏族人群不同临床表型慢性鼻窦炎中免疫细胞因子指标比较 CRSsNP中IFN-γ、IL-17及L-8, IL-2sRa、IL-1β及MPO表达水平显著高于对照组(P<0.05),其中部分指标比CRSwNP中呈增高趋势。CRSwNP患者息肉组织中IL-5、ECP、IL-6及总IgE水平显著高于CRSsNP和对照组。见表2。
2.3 CRS中各种炎症细胞计数比较 各标记物免疫组化在两组鼻窦炎均有不同程度的表达,其中CD4、CD20及CD138细胞计数两组鼻窦炎中的表达均高于对照组(P<0.05),而两组鼻窦炎间无显著差异。Trytase(肥大细胞)和HE(嗜酸性细胞)细胞计数在鼻息肉组中显著高于其他两组(P<0.05);而MPO及CD68表达阳性细胞计数在单纯鼻窦炎中显著高于其他组(P<0.05),见表3。

表2 三组中主要炎症介质表达差异的比较Table 2 The concentrations of inflammatory mediators
注:数据由中位数和可信区间表达,P值由非参数U检验。P≤0.05为有统计学意义 ( NS;没有显著性差异. ;对照vs 鼻窦炎.;对照vs 鼻息肉. §;鼻窦炎 vs 鼻息肉)

表3 免疫组化表达阳性细胞数比较Table 3 IHC staining positive cells count
注:标记物代表细胞:CD4(T细胞), CD20(淋巴细胞), CD138(浆细胞),Trytase(肥大细胞),MPO(中性粒细胞),CD68 (单核巨噬细胞),HE(嗜酸性粒细胞)。标注:NS;无显著差异 ;对照vs鼻窦炎;对照vs 鼻息肉. §;鼻窦炎 vs 鼻息肉
2.4 不同鼻窦炎及对照中鼻腔微生物培养结果 在伴有鼻息肉鼻窦炎中革兰氏阳性菌培养率增高且与对照组比较差异有统计学意义(P≤0.05),其中金黄色葡萄球菌与其它组有明显差异(均P≤0.05);反之在不伴有息肉鼻窦炎中革兰氏阳性菌培养较为明显但差异无统计学意义。见表4。
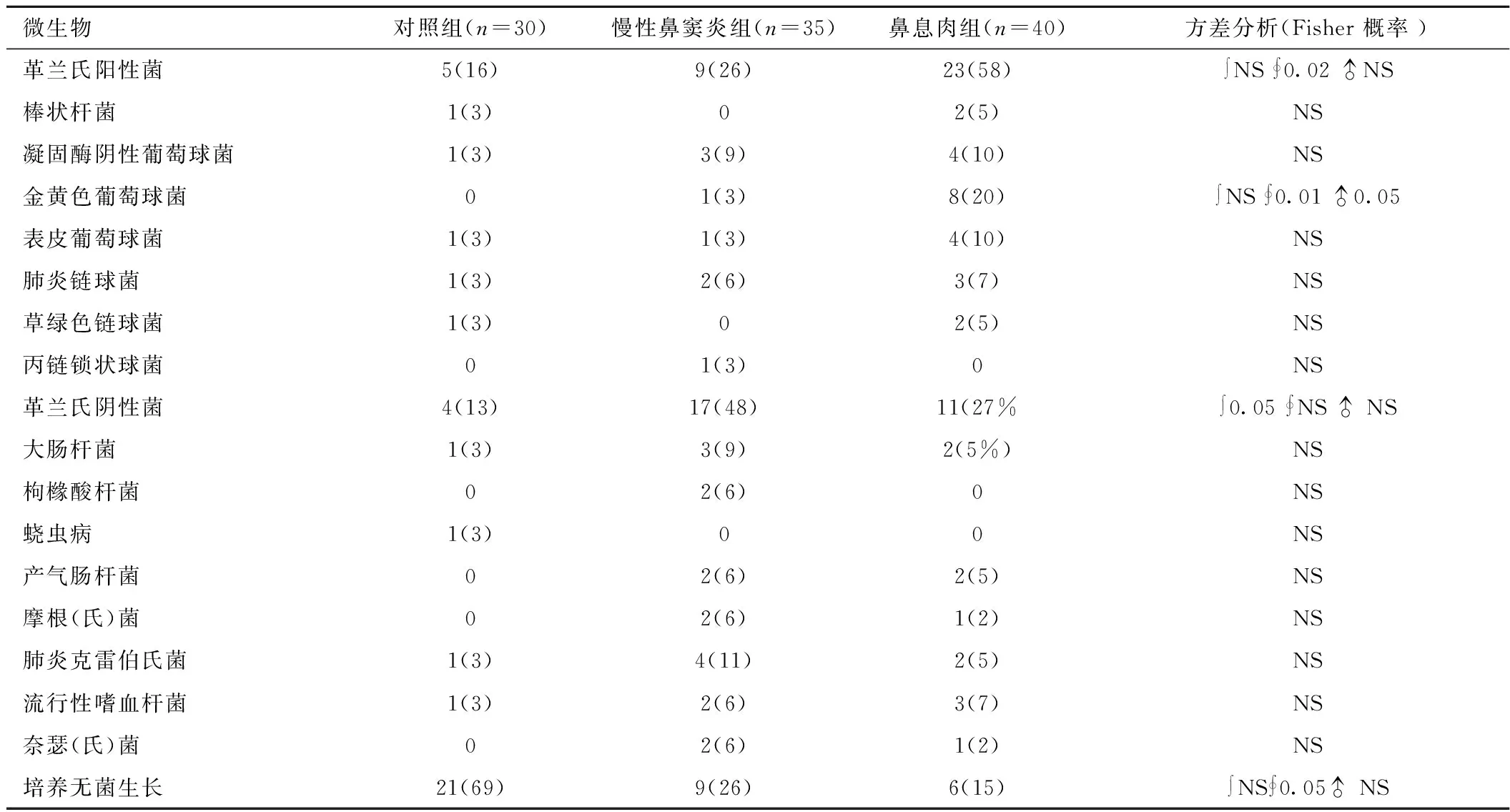
表4 不同鼻窦炎及对照中鼻腔微生物分类比较[n(×10-2)]Table 4 Microbial species isolated from the nasal passages of control and CRS

3 讨论
目前由于对慢性鼻窦炎炎症免疫机制的复杂性及调控因素全面深入认识的缺乏,造成不同种族、区域表现不同免疫表型及炎症模式特征的报道[10-11]。为此,根据现在尚存免疫表型机制多样性特点将CRS表型进行深入广泛研究势在必行[12],只有表型机制的深入研究可能解决慢性鼻窦炎治疗上比较单一干预手段及突破开展基础研究的瓶颈[13]。尽管绝大多数白种人群慢性鼻窦炎中CRSwNP显示Th2免疫表型嗜酸性炎症模式特征[2,5];亚洲人群CRSwNP中主要以Th1或Th17倾向中性粒细胞炎症特征,并且哮喘发病率明显低于西方人群[4,6-7]。但不论种族、区域不同大部分其CRSsNP均表现为Th1免疫表型中性粒细胞炎症趋势之特征。高原藏族人群大部分常年居住高寒空气稀薄恶劣环境地带,加之医疗条件较落后及诊疗观念较为传统。由于地域限制造成的潜在隔离性决定了慢性鼻窦炎病因学上与其它地域可能存在较大差异, 由此可能导致免疫机制上存在特殊的一面[9]。为此我们开展藏族人群慢性鼻窦炎临床特征及基础免疫微生物研究发现;其中CRSwNP比CRSsNP具有更强炎症浸润现象,进一步免疫指标检测提示CRSwNP中Th2相关因子IL-5、ECP和IgE升高,同时还伴随IL-6显著升高。组织学上以浸润嗜酸性粒细胞和肥大细胞更为显著;而在 CRSsNP中具有Th1相关因子IFN-γ与Th17相关IL-17升高趋势,组织学有较强MPO+(中性粒细胞)和CD68+ (巨噬细胞)浸润表达。同样两组CRS中均有较强CD4+(T淋巴细胞), CD138+(浆细胞)和CD20+(B淋巴细胞)等各种炎症细胞浸润表达,表明二者均有较强炎性反应特征。从两组鼻窦炎免疫炎症特征能够初步反应其炎症趋势性特征,即反映伴有息肉的鼻窦炎多类似于变态反应改变为占优势;而不伴鼻息肉鼻窦炎表现出鼻鼻窦黏膜局部细菌感染导致。另外CD68+特异性巨噬细胞浸润与TGF-b1增高组织重塑更能说明单纯鼻窦炎中细菌感染所发生的免疫连锁反应,也符合国内外众多文献报道[14-15]。另外,上述结果中CRSsNP免疫炎症特征与众多亚洲及西方人群CRS免疫炎症趋势相符合[16],而CRSwNP免疫反应呈现出Th2倾向嗜酸性炎症反应特征类似白种人免疫反应趋势,偏离亚洲人群鼻息肉免疫表性特征。而在泰国人群鼻息肉中同样Th17倾向中性粒细胞炎症模式型居多,但发现随着时间的推移其向Th2倾向嗜酸性炎症模式的转化趋势[17],而我们的结果首先不排除样本偏小及实验误差所致的偏差,再者理论上也存在该趋势的可能,因此有待于更深入验证研究。
基于上述结论我们进一步结合术前进行微生物培养的结果发现藏族CRSwNP中更多G+细菌生长,相对在CRSsNP中G-细菌较为显著,预示着最近文献报道不同的微生物组可能与某些类型的免疫反应相关[18]。我们初步推断可疑高原特殊环境对鼻腔微生物谱系有影响并与平原地区有所不同,由此高原地区慢性鼻窦炎免疫炎症模式有其独特一面值得深入研究。至于导致CRSwNP免疫表型上存在太大差异,本研究中出现与亚洲人群不同分歧性结果,可能归因于高原特殊环境下慢性鼻窦炎鼻腔微生物定植存在某种缺氧性微环境下致病菌群结构改变导致鼻黏膜炎症模式的改变。该结论也许可能根本从高原特殊环境或遗传基因等各方面所导致值得深入研究,现有种种证据表明可能因不同致病菌感染或相对恶劣环境及抗生素使用不规范等众多综合因素结果所致[19-20]。 总之,慢性鼻窦炎免疫表型及炎症模式在全球范围,不论地域、种族都表现类似特点。而在慢性鼻窦炎伴鼻息肉中根据种族、地域,甚至相同地域不同群体中其免疫及炎症机制略有差异。通过本研究可能归功于外来微生物影响当地CRS中的免疫表型,或许因遗传、环境等因素导致其CRS中特有免疫表现形式。故有待于进一步从免疫分子机制遗传表观学等方面值得更深入细致研究。
4 结论与启示
本研究不仅揭示了高原地区藏族人群慢性鼻鼻窦炎免疫表型特点,其中慢性鼻窦炎伴有鼻息肉具有Th2倾向嗜酸性炎症模式特征并与革兰氏阳性菌定植相关,呈现出类似白种人免疫反应趋势,偏离亚洲人群鼻息肉免疫表性特征。反之,慢性鼻窦炎不伴鼻息肉中以Th1或Th17优势中性粒细胞炎症趋势特征;并且与革兰氏阴性菌存在某种相关性。藏族人群中出现与不同亚洲人群鼻息肉中表现Th2倾向免疫炎症反应特征,可能因高原特殊环境导致鼻腔微生物谱系的特殊改变,值得深入研究。

