百里醌对大鼠肠缺血再灌注损伤的保护作用
吉祖进 张志云 雷新益 杨勇 蒋学军 庹磊
(国药东风总医院,湖北 十堰 442008)
肠缺血再灌注损伤(intestinal ischemia reperfusion,IIRI)是临床上比较常见的病理生理过程,可由急性肠系膜缺血、严重感染、创伤性休克和外科手术引起,它进一步导致全身炎症反应综合征( systemic inflammatory response syndrome,SIRS)和多器官功能障碍(multiple organ dysfunction syndrome,MODS)的发生[1-2]。肠缺血后,虽然恢复血流灌注和复氧过程至关重要,矛盾的是,再灌注过程同时也会造成额外的细胞损伤,其病理机制可能与氧化应激、炎症因子释放和细胞凋亡等多种因素相关[3-4]。黑种夏草是原产于地中海和中东地区常用的生物药材,一直被广泛用于支气管哮喘、糖尿病、高血压等疾病的治疗[5]。百里醌( thymoquinone)是黑种夏草种子提取物中的主要活性成分。研究显示,在多种器官的IIRI过程中, 百里醌发挥了抗氧化、抗凋亡及抗炎等作用[6-7]。本研究通过建立大鼠肠IIRI模型,观察百里醌在大鼠肠IIRI过程中的保护作用,为肠IIRI的防治提供新的手段。
1 材料与方法
1.1 实验试剂及器材 百里醌,上海哈森公司产品;无水乙醇,美国 Sigma 公司;丙二醛(MDA)、超氧化物岐化酶(SOD)检测试剂盒,南京建成生物工程研究所;原位细胞凋亡检测试剂盒,德国罗氏生物技术公司; RNA 提取试剂盒及逆转录试剂盒,美国GeneCopoeia 公司;ECL试剂盒:皮尔斯生物科技公司;Bax、Bcl-2及Caspase-3抗体购自圣克鲁斯生物技术公司。百里醌用无水乙醇溶剂并配制成1 mol /L 的贮存液,-20 ℃冰箱保存。
1.2 实验动物和分组 45只健康雄性Wistar大鼠, 体重250~300g,随机分为3组,每组15只。实验前,所有大鼠饲养在恒温房间,自由进食和水。所有大鼠腹腔注射2%戊巴比妥钠(50mg/kg)进行麻醉,取腹正中切口,分离并暴露肠系膜上动脉(superior mesenteric artery,SMA)。假手术对照组(A组)仅游离SMA,不给予任何干预措施,观察3 h。 缺血再灌注组(B组)使用无损伤动脉夹夹闭SMA 1 h后,取下动脉夹再灌注2h。缺血再灌注+百里醌组(C组):在B组基础上,再灌注同时腹腔注射百里醌(50 mg /kg )。术毕,快速脱颈椎法处死所有大鼠,采集距大鼠小肠回盲部10 cm以上的肠组织作为标本。
1.3 HE 染色 小肠组织冲洗干净后置于4%的甲醛溶液中固定,常规石蜡包埋,4μm厚切片、脱蜡和水化,观察小肠组织的形态学改变。
1.4 MDA和SOD测定 冷冻的小肠组织匀浆、离心,然后收集上清液。MDA含量采用硫代巴比妥酸法测定,SOD活性采用黄嘌呤氧化酶法,按照说明书指示进行操作。
1.5 细胞凋亡检测 利用末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)法检测细胞凋亡,细胞核染成棕黄色者为阳性细胞,计算细胞总数和阳性细胞数。凋亡指数(AI)= 阳性细胞数/细胞总数×100%。
1.6 逆转录聚合酶链反应(RT-PCR) 冻存的小肠组织样本,加入Trizol试剂提取总RNA。取1μg 总RNA逆转录成cDNA,采用PCR基因扩增仪进行扩增。反应方案依据试剂盒说明书操作步骤,条件为: 逆转录52℃ 15min,92℃ 40s;循环条件为: 90℃ 30s、54℃ 10s、72℃ 40s,40个循环。引物序列:caspase-3正义链5'-TGGACTGCGGTATTGAGACA-3';反义链5'-GCGCAAAGTGACTGGATGAA-3';Bax正义链5'TGAACTGGACAACAACATGGAG3';反义链5'AGCAAAGTAGAAAAGGGCAACC3';Bcl-2正义链5'-ATGCTTCAGACCTCCCTT-3';反义链 5'-CTCCACCAACTATCTCCACT-3';GAPDH正义链5'-ACAGCAACAGGGTGGTGGAC-3';反义链5'-TTTGAGGGTGCAGCGAACTT-3'。软件分析各组的循环阈值(Ct),最终数据以2-△△Ct进行分析,得出各组基因的表达量。
1.7 Western blot法检测各组小肠组织中caspase-3、Bax和Bcl-2 蛋白表达水平 取冻存小肠组织约100mg,放入预冷的1000μl细胞裂解液中匀浆,离心并吸取上清液。取等量匀浆蛋白,经10%的SDS-PAGE进行凝胶电泳,将其转移到硝酸纤维素膜上,5% 脱脂奶粉封闭。1∶500稀释抗Bax抗体,1:1000稀释抗Bcl-2和caspase-3抗体,与硝酸纤维素膜4℃孵育过夜。漂洗两次, TBST缓冲后,1∶ 500 HRP 标记的山羊抗小鼠IgG 后,采用增强化学发光法(ECL) 测定光密度值。

2 结果
2.1 肠缺血再灌注模型的建立 使用无损伤动脉夹夹闭肠系膜上动脉。模型制备成功的标准:肠系膜上动脉远端动脉搏动消失,渐变苍白,恢复灌注前小肠段发黑,水肿明显,见图1。
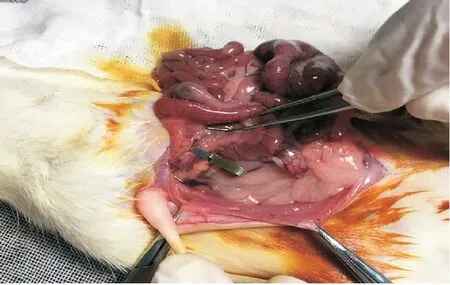
图 1 动脉夹夹闭肠系膜上动脉Figure 1 Artery clamps occluded the superior mesenteric artery
2.2 各组大鼠小肠组织的病理学改变 A组未见明显的组织病理学改变,黏膜上皮排列整齐,形态结构完整,肠黏膜无充血,无水肿;B组可见肠绒毛排列紊乱,明显肿胀、变粗,肠黏膜坏死;C组可见形态结构的破坏损伤较B组减轻,肠黏膜部分坏死,肠绒毛未见明显水肿,见图2。
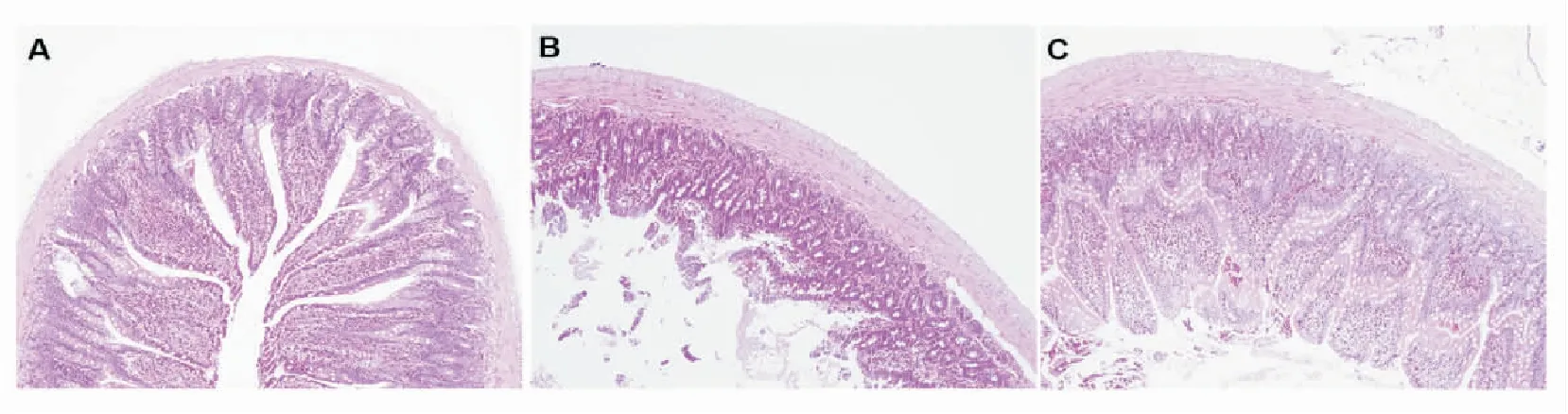
图2 小肠组织病理学改变 (HE×100)Figure 2 Histopathological changes of small intestine (HE×100)注:A.假手术对照组,B.缺血再灌注组,C.缺血再灌注+百里醌组
2.3 各组小肠组织中MDA、SOD含量的变化 B组中MDA含量较A组明显增加,百里醌治疗后MDA含量显著降低,组间比较,差异均有统计学意义(P<0.05);与A组相比,B组SOD活性明显降低,百里醌治疗后增加了小肠组织中SOD的活性,组间差异均有统计学意义(P<0.05),见表1。
Table1ChangesofthecontentsofMDAandSODinthesmallintestine

组别nMDA(nmol/mg)SOD(U/mg)A组152.83±0.36135.37±3.34B组159.23±0.78 ①76.45±1.39 ①C组154.97±0.45 ①②95.13±1.64 ①②
注:与A组比较,①P<0.05;与B组比较,②P<0.05
2.4 各组肠黏膜上皮细胞凋亡情况 A组可见散在较少的肠黏膜上皮细胞凋亡;B组中凋亡细胞明显增加,与A组相比,差异有统计学意义(P<0.05);C组细胞凋亡较B组明显减少,差异有统计学意义(P<0.05),见表2。

表2 肠黏膜上皮细胞凋亡指数Table 2 Apoptosis index of intestinal mucosal epithelial
注:与A组比较,①P<0.05;与B组比较,②P<0.05
2.5 各组小肠组织中caspase-3、Bax和Bcl-2 mRNA的表达水平 Bax、caspase-3在B组中的mRNA表达水平,与A组比较显著增加;与B组比较,百里醌治疗(C组)后其mRNA表达水平降低,组间差异有统计学意义(P<0.05)。与A组比较,B组中Bcl-2在mRNA表达水平明显减低;C组中mRNA表达水平较B组明显增加,组间差异均有统计学意义(P<0.05),见图3。
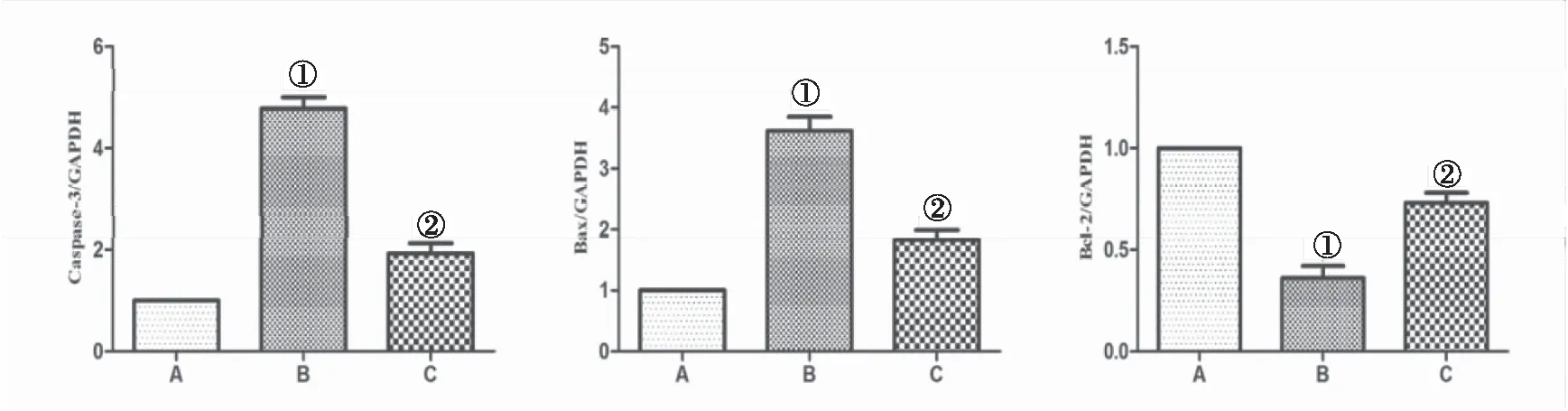
图3 小肠组织中caspase-3、Bax和Bcl-2 mRNA的表达水平Figure 3 The mRNA expression levels of caspase-3, Bax and Bcl-2 in the small intestine tissues注:A.假手术对照组,B.缺血再灌注组,C.缺血再灌注+百里醌组;与A组比较,①P<0.05;与B组比较,②P<0.05
2.6 各组小肠组织中caspase-3、Bax和Bcl-2 蛋白表达水平 与A组比较,Bax、caspase-3在B组中的表达水平增加;百里醌治疗(C组)后其表达水平降低,组间差异均有统计学意义(P<0.05)。Bcl-2在B组中的表达水平,与A组比较显著降低;与B组比较,百里醌治疗(C组)后其表达水平增加, 组间差异均有统计学意义(P<0.05),见图4。
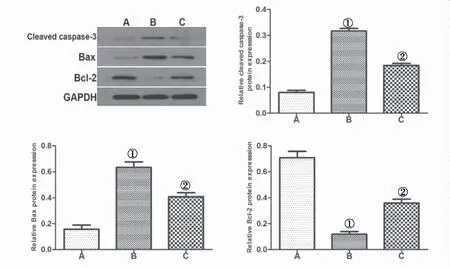
图4 小肠组织中caspase-3、Bax和Bcl-2蛋白表达水平Figure 4 The protein expression levels of caspase-3, Bax and Bcl-2 in the small intestine tissues注:A.假手术对照组,B.缺血再灌注组,C.缺血再灌住+百里醌组,与A组比较,①P<0.05;与B组比较,②P<0.05
3 讨论
百里醌是从黑种夏草种子中提取的具有生物活性成分单体,具有广泛的药理作用,研究发现百里醌具有多种生物学作用。Galaly等[8]报道,百里醌激活内皮细胞分泌生长因子,促使平滑肌细胞大量增殖,从而在肝细胞的损伤中发挥抗凋亡及抗炎作用。Shao等[9]研究发现,百里醌可通过降低氧化应激水平,对大鼠脑细胞损伤的功能产生保护作用。本实验采用HE染色观察百里醌对IIRI大鼠小肠组织学变化的影响。结果显示,IIRI组出现明显的病理学变化,比如肠绒毛排列紊乱、肠黏膜坏死等表现;经百里醌治疗后,小肠IIRI引起的组织学损伤得到明显好转及改善。
氧化应激是机体内活性氧自由基(ROS)大量积累的结果,ROS也是器官IIRI发展的重要因素, 大量ROS的产生可打破氧化和抗氧化之间的平衡,引起组织损伤[10]。当小肠血供中断引起缺血时,机体内ROS清除能力明显降低,再灌注损伤时则进一步诱发产生大量ROS, 过量的ROS可以氧化细胞膜蛋白、脂质和DNA,导致一系列细胞功能障碍或死亡[11-12]。正常情况下,MDA是脂质过氧化分解产生的最终产物,通常用于评估氧化应激下细胞损伤的程度。SOD水平是细胞生长、分化过程中的重要组成部分, 其抗氧化能力可改善IIRI的损伤[13]。Cobourne-Duval 等[14]发现,百里醌可明显减少ROS的生成,从而抑制大鼠中枢神经系统中的氧化应激水平,在减慢或防止小胶质细胞源性神经退行性疾病发生发展中,可作为一种有效的治疗剂。Al-Majed等[15]通过百里醌腹腔注射的方法,发现其可有效地减少急性腹主动脉缺血再灌注大鼠模型中氧化应激的病理损伤。本实验研究表明,经百里醌治疗后,可使IIRI小肠组织中的MDA含量降低,SOD活性升高,从而减轻了肠IIRI过程中氧化应激造成的损伤。
细胞凋亡是一种基于遗传学机制的细胞死亡模式,通过诱导一系列形态和生化的改变导致细胞死亡的过程,在维持机体的动态平衡中发挥重要的作用[16]。IIRI时,由于能量的消耗,活性代谢产物的大量生成,激活线粒体信号转导通路,引起大量细胞凋亡,使机体发生损伤[17]。Kojima等[18]认为在肠IIRI过程中,氧化应激水平的升高可进一步诱导黏膜上皮细胞发生异常凋亡。 Caspase-3是细胞凋亡过程中的关键效应酶,也是多种凋亡刺激信号最终的汇聚点[19]。Bcl-2是一组家族蛋白,其中包含促凋亡因子(如Bax)和抗凋亡因子(如Bcl-2),它们是近年来发现的一对关系密切的凋亡基因,其变化是细胞凋亡损伤中另一个重要的因素[20]。本实验IIRI组中, Bax、caspase-3表达明显高于对照假手术组,Bcl-2表达低于对照假手术组, 其凋亡指数(AI)显著升高;百里醌治疗后,Bax,caspase-3的表达明显降低,Bcl-2表达明显增多,提示百里醌在小肠IIRI过程中具有抑制凋亡的作用。
4 结论
本实验结果显示,百里醌可减轻实验大鼠的氧化应激水平,发挥抗凋亡作用, 从而在肠IIRI过程中发挥保护作用。这些发现为我们更好地理解百里醌在临床治疗中的作用提供了依据,无疑将为未来IIRI治疗提供新的思路。

