乌蕨醇提取物对1型糖尿病大鼠的降血糖作用及其机制初探
陈 明,王 恒,赵鸿宾,余跃生,段 萍,范 芳
1黔南民族医学高等专科学校;2黔南州药品检验所,都匀558000; 3遵义医科大学生物化学与分子生物学教研室,遵义 563000
糖尿病(diabetes mellitus,DM)是由于胰岛素分泌不足及胰岛素抵抗而引起,以慢性高血糖为特征,常伴有全身代谢紊乱的一种多病因的代谢疾病。其中1型糖尿病是由于胰岛β细胞受到细胞介导的自身免疫性破坏,导致胰岛素分泌绝对不足引起的代谢紊乱[1]。乌蕨(Stenolomechusanum(L)Ching,SLC)系鳞始蕨科乌蕨属植物,为多年生草本,其味微苦,性寒,具有清热解毒、利湿、止血的功效,广泛分布于我国许多省份和地区,民间长期用其治疗外伤感染[2]。现代研究表明SLC含有黄酮、酚类、挥发油、甾体和多糖等成分,其提取物或单体化合物具有较强的抗菌、抗氧化、抗炎、保肝、止血、解毒等作用[3,4]。课题组在前期研究了SLC对2型糖尿病小鼠的降血糖作用[5],本研究旨在进一步观察SLC提取物对链脲佐菌素(streptozotocin,STZ)致1型糖尿病模型大鼠空腹血糖的影响,并初步探讨其机制。
1 实验材料
1.1 动物
健康清洁级7~8周龄SD大鼠,雄性,体重180~220 g,由贵州医科大学实验动物中心提供。动物合格证号SCXK(黔)[2012-0001]。饲养于室温18~22 ℃、相对湿度60%~65%、光照周期每天12 h的环境中。适应性喂养3天。
1.2 药品与试剂
SLC原植物采摘于贵州省都匀市马鞍山林区,经黔南民族医学高等专科学校中药教研室魏学军教授鉴定为鳞始蕨科SLC属植物。链脲佐菌素,批号:20150625;胰岛素(insulin,INS),批号:20150722,均购于北京索莱宝科技有限公司(代购于Sigam公司,美国)。葡萄糖激酶(glucokinase,GCK)、醛糖还原酶(aldose Reductase,AR)、血糖测试盒(批号:201705),武汉基因美生物科技有限公司。柠檬酸、柠檬酸三钠(20150452),天津市津宏化工有限公司。
1.3 仪器和设备
AG-696型血糖测试仪,天津九安医疗电子股份有限公司;Multiskan MS型酶标仪, Lab-systems公司,芬兰;TDL-4ZB型台式低速离心机,湖南星科科学仪器厂;Agilent Cary 100型分光光度计,安捷伦科技有限公司,美国。
2 实验方法
2.1 SLC提取物的制备
取干燥的SLC药材(地上部分)粉碎过筛,称取1 000 g,用15倍量65%乙醇,80 ℃水浴回流提取三次,1 h/次,合并提取液,减压浓缩至无醇味,转移至分液漏斗中,加石油醚萃取5次,将母液减压蒸发除去石油醚,然后加入等体积乙酸乙酯,萃取4~6次,合并乙酸乙酯萃取液,将其减压浓缩,回收乙酸乙酯,得到乙酸乙酯萃取物,减压干燥;称取干燥的乙酸乙酯萃取物适量,加少量水溶解,加适量吐温80,配制成相应浓度,供实验使用。
2.2 STZ缓冲液的配制及诱导糖尿病大鼠模型的制备[6]
2.2.1 STZ缓冲液的配制
将STZ冰浴、避光溶解于0.1 mol/L的柠檬酸三钠-柠檬酸缓冲液中(pH4.5),制成浓度为10 mg/mL的STZ液。
2.2.2 1型糖尿病大鼠模型的制备
健康雄性SD大鼠60只,随机分为两组,空白对照组10只,模型复制组50只;常规饲料喂养,自由饮食摄水,禁食不禁水过夜(约16 h)。正常组按6 mL/kg剂量腹腔注射柠檬酸三钠-柠檬酸缓冲液。模型复制组大鼠按60 mg/kg剂量腹腔注射STZ,注射72 h后,将全部大鼠禁食过夜,尾静脉采血,测定空腹血糖(fasting Blood glucose,FBG)值。FBG值高于16.7 mmol/L,且出现“三多一少”症状者为模型复制成功。模型复制组有34只大鼠符合1型糖尿病模型标准。
2.3 分组及给药
空白对照组(CG)10只。将34只模型复制成功的大鼠随机分为1型糖尿病模型组(IG)12只,用生理盐水灌胃;SLC低剂量组(LG)11只(30 mg/kg)及SLC高剂量组(HG)11只(60 mg/kg)用相应剂量SLC醇提取物灌胃。以上各组灌胃体积为20 mL/kg,每天灌胃1次,连续28天。
2.4 血清制备及相关指标分析
各组大鼠灌胃28天后,尾静脉采血测血糖;股动脉取血,离心(3 000 rpm)10 min 取血清,根据待测生化指标分析需要分装,置-20 ℃冰箱保存备用。测定各组血清中INS、GCK及AR含量,计算降血糖率(Glucose lowering rate,GLR)=(模型组血糖均值-受试药物组血糖均值)/模型组血糖均值×100%[7]。
2.5 大鼠胰腺病理形态学观察
取血后处死大鼠,立即取胰岛组织,以中性福尔马林固定,常规石蜡包埋,切片,进行HE染色,光学显微镜下观察拍照。
2.6 统计学处理

3 结果与分析
3.1 SLC提取物对大鼠体重的影响
造模前各组大鼠体重无明显差异(P>0.05)。灌胃28天后,1型糖尿病模型组大鼠体重呈现负增长,空白对照组及SLC提取物高剂量组大鼠体重显著上升(P<0.05);与1型糖尿病模型组相比,SLC提取物高、低剂量组大鼠体重增加(P<0.05)(见表1)。

表1 SLC醇提取物对大鼠体重的影响 (n=44,± s)Table 1 Effects of SLC alcohol extract on body weight in rats (n=44,± s)
注:与同组灌胃前比较,*P<0.05,与1型糖尿病模型组比较﹟P<0.05
Note:*P<0.05,compared with the same group before gavage,#P<0.05,compared with the type 1 diabetes model group.
3.2 SLC提取物对大鼠空腹血糖及降糖率的影响
模型复制后空白对照组FBG低于16.7 mmol/L,其余各组血糖均高于16.7 mmol/L,且大鼠出现三多一少症状,表明模型复制成功。灌胃前,空白对照组大鼠FBG均低于其他各组(P<0.05),其他各组间FBG差异无统计学意义(P>0.05)。灌胃28天后,与空白对照组相比,其余各大鼠FBG显著上升(P<0.05)。与1型糖尿病模型组相比,SLC提取物高、低剂量组FBG显著下降(P<0.05);但SLC提取物高、低剂量组间差异无统计学意义(P>0.05)(见表2)。

表2 SLC提取物对大鼠FBG及GLR的影响Table 2 Effects of SLC alcohol extract on FBG and GLR in rats
注:灌胃前,与空白对照组比较,*P<0.05;灌胃后与1型糖尿病模型组比较,﹟P<0.05。
Note:*P<0.05,before treatment,compared with the control group,;#P<0.05,after treatment,compared with type 1diabetes model group.
3.3 SLC提取物对大鼠胰岛素的影响
灌胃28天后,与空白对照组相比,各组大鼠血清INS水平均下降(P<0.05);与1型糖尿病模型组比较,SLC高、低剂量组INS水平显著增加(P<0.05),SLC高、低剂量组间差异无统计学意义(P>0.05)(见表3)。

表3 SLC提取物对大鼠INS水平的影响Table 3 Effects of SLC alcohol extract on INS in rats
注:*P<0.05,与空白对照组比较;﹟P<0.05,与1型糖尿病模型组比较。
Note:*P<0.05,compared with the control group;#P<0.05,compared with the type 1diabetes model group.
3.4 SLC提取物对大鼠血清GCK、AR的影响
与空白对照组比较,各组大鼠血清GCK含量显著下降(P<0.05),与1型糖尿病模型组比较,SLC高、低剂量组GCK均出现了显著增加(P<0.05);与1型糖尿病模型组比较,SLC高、低剂量组AR含量显著降低(P<0.05)(见表4)。

表4 SLC提取物对大鼠GCK、AR的影响Table 4 Effects of SLC alcohol extract onGCK、AR in rats
注:*P<0.05,与空白对照组比较;﹟P<0.05,与1型糖尿病模型组比较。
Note:*P<0.05,compared with the control group;#P<0.05,compared with the type I diabetes model group.
3.5 SLC提取物对大鼠胰岛形态学的影响
HE染色结果显示,正常对照组胰岛分布正常,细胞形态规整、分布规则,胰岛形态及外分泌腺无明显病理改变(Fig.1A)。1糖尿病模型组胰岛萎缩,胰岛数目明显减少,胰岛部分细胞空泡变性,胰岛内可见炎性细胞浸润(Fig.1B)。SLC提取物高剂量组较1糖尿病模型组,胰岛萎缩不同程度减轻,炎性细胞浸润程度减轻,胰岛数目增加(Fig.1D)。
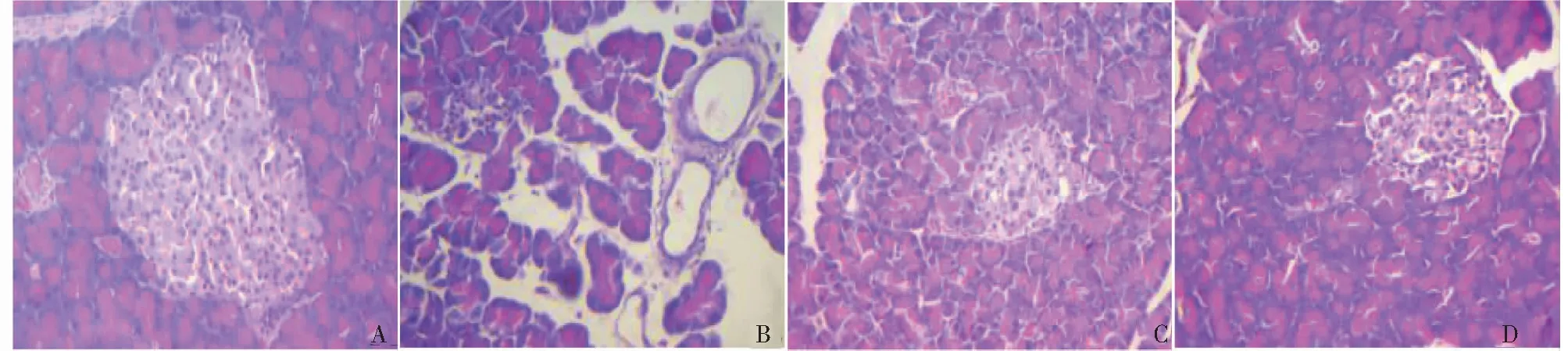
图1 SLC提取物对大鼠胰岛形态学的影响Fig.1 Effects of SLC alcohol extract on islet morphology in rats注:A.空白对照组 B.模型组;C.低剂量组;D.高剂量组。Note:A.Control group B.type I diabetes model group;C.Low dose group;D.High dose group.
4 结论
本研究采用链脲佐菌素腹腔注射诱导法复制1型糖尿病动物模型,造模后大鼠FBG值高于16.7 mmol/L,且出现“三多一少”症状者为模型复制成功。
GCK是己糖激酶同工酶的一种,存在于胰腺和肝脏中,是糖代谢的重要调节因子。研究发现在糖尿病个体中普遍存在GCK 活性的降低[8],同时发现GCK对糖代谢有显著调节作用,GCK活性微小的改变即可导致糖代谢的显著变化,因此认为GCK是具有前景的糖尿病治疗药物新靶点。AR是多元醇通路中重要的限速酶,持续高血糖刺激下,细胞内多元醇代谢通路被激活,葡萄糖在AR的催化下还原为渗透性强的山梨醇,后者在山梨醇脱氢酶(SDH)作用下转化成果糖。肾组织AR活性的增强,机体抗氧化能力低下与糖尿病肾损伤的发生、发展关系密切[9],GCK是INS分泌的葡萄糖感受器,可影响INS的分泌,具有协同INS调控糖代谢的能力[10]。
本研究用SLC醇提取物对1型糖尿病模型大鼠进行降血糖实验。结果显示,与模型组比较,SLC提取物低剂量组在给药28天后大鼠体重无明显变化,高剂量组给药28天后体重显著增加;SLC提取物可显著降低1型糖尿病大鼠FBG水平,同时显著升高1型糖尿病大鼠的血清INS浓度。SLC提取物高剂量组、低剂量组的GLR分别达到45.90%、40.30%。提示SLC提取物能有效缓解糖尿病大鼠消瘦的状况,对大鼠糖尿病的症状有一定缓解作用。为进一步了解SLC提取物缓解大鼠糖尿病症状的可能机制,本研究观察了SLC提取物对糖尿病大鼠胰岛形态学及血清GCK、AR含量的影响。结果显示,在灌胃28天后不同剂量SLC提取物对大鼠受损的胰岛结构均有修复作用,主要体现为:胰岛及外分泌腺萎缩程度减轻,炎性细胞浸润程度减轻,胰岛数目增加。其中,高剂量组修复作用优于低剂量组。血清学检测结果显示,SLC提取物能够显著增高糖尿病大鼠血清GCK含量、显著降低AR。
综上所述,SLC提取物对STZ所致1型糖尿病大鼠有降血糖作用,可降低1型糖尿病大鼠FBG,增加体重,修复受损的胰岛结构。其降糖作用可能与升高糖尿病大鼠血清GCK含量和降低AR含量,改善模型组大鼠胰岛损伤,促进胰岛β细胞分泌INS有关。SLC对糖尿病大鼠的降血糖作用及具体机制有待进一步研究。

