荭草花有效组分在人肠道菌群中体外代谢特征分析
陈 浩,王昌权,夏 涛,李月婷,王永林,黄 勇,李勇军,郑 林*
1贵州医科大学贵州省药物制剂重点实验室/ 药用植物功效与利用国家重点实验室; 2贵州医科大学民族药与中药开发应用教育部工程研究中心;3 贵州医科大学药学院,贵阳 550004
荭草花为蓼科荭草PolygonumorientaleL.的花序,又名水荭花、狗尾巴花等,在贵州分布广泛。具有行气活血、消积、止痛的功效,用于胸痛、胸闷、气短、中风偏瘫、风湿疼痛等疾病的治疗[1]。课题组前期研究对荭草各部位药理筛选实验中发现,荭草花比其“全草”有更为明显的抗心肌缺血作用,为荭草的主要药用有效部位,并从有效组分中分离并鉴定了13个代表成分(没食子酸、原儿茶酸、儿茶素、表儿茶素、槲皮素-3-O-( 2″-O-α-L-鼠李糖基)-β-D-葡萄糖醛酸苷、山柰酚-3-O-( 2″-O-α-L-鼠李糖基)-β-D-葡萄糖醛酸苷、山柰素-3-O-β-D-葡萄糖苷、槲皮苷、山柰素-3-O-α-L-鼠李糖苷、N-p-香豆酰酪胺、N-trans-对羟基苯乙基阿魏酰胺、槲皮素、山柰酚)[2,3]。研究表明,其吸收进入体内后,绝对生物利用度较低[4],但其抗心肌缺血疗效确切,原因可能为荭草花在体内发挥药效的形式除了原型成分外,其在体内的代谢产物也可能为活性成分,而肠道菌群的代谢作用不容忽视,但有关荭草花有效组分在肠道菌群中的代谢研究尚未见报道。人肠道菌群种类繁多,不同种类的菌群产生不同的代谢酶,从而能对有效组分中的不同成分进行特定转化,且肠道菌群影响着许多中药有效成分的代谢转化与机体的吸收利用。而中药的有效成分经肠道菌群特定的转化酶作用下,才能转化成具有药理或毒理的有效成分[5-7]。本实验采用离体人肠道菌群,揭示离体人肠道菌群对荭草花有效成分的影响,以期为探索荭草花有效组分在体内的作用机制提供参考。
1 仪器与材料
1.1 仪器
1290 Infinity型超高压效液相色谱(美国Agilent公司),micrOTOF-QⅡ型电喷雾-四级杆-飞行时间质谱仪(德国布鲁克公司),CDH6000BⅡ型电热恒温培养箱(天津市泰斯特仪器有限公司),SW-CJ-2FD型超净工作台(苏州苏洁净化设备有限公司),YXQ-LS-18SI型手提式压力蒸汽灭菌器(上海博迅实业有限公司),Allegra 64R型低温高速离心机(美国Beckman Coulter 公司),MTN-2800 D型氮吹浓缩装置(天津奥特塞恩斯仪器有限公司)。
1.2 实验材料
荭草花药材购自贵州贵阳鹿冲关贵州省药用植物园种植基地,经贵州医科大学药学院生药学教研室龙庆德副教授鉴定为蓼科植物荭草PolygonumorientaleL.的花序;荭草花有效组分(自制),山柰酚、槲皮素、原儿茶酸、槲皮苷对照品(四川维克奇生物科技有限公司),没食子酸对照品(中药固体制剂制造技术国家工程研究中心) ,山柰素-3-O-β-D-葡萄糖苷对照品、山柰素-3-O-α-L-鼠李糖苷对照品、儿茶素对照品实验室自制(采用1NMR、13MR、MS、UV、IR波普进行结构鉴定,用UPLC-PDA在多个检测波长下测定,其峰面积归一化均大于98),厌氧产气袋,厌氧培养罐(日本三菱瓦斯化学株式会社),蛋白胨(上海博微生物科技有限公司),营养琼脂培养基、小牛浸膏(杭州微生物试剂有限公司),L-半胱氨酸(上海蓝季科技发展有限公司),L-抗坏血酸(北京索莱宝科技有限公司),乙腈为色谱纯(德国Merck公司),甲酸为色谱纯,水为纯净水,其他试剂均为分析纯。
2 实验方法
2.1 荭草花有效组分的制备
称取荭草花药材6 kg,加10倍量水煎煮3次,滤液合并浓缩,加入乙醇使含醇量达65%,静置过夜,回收乙醇,残留物用0.5倍量水饱和正丁醇萃取4次,回收正丁醇,残留物用乙醇溶解,上聚酰胺柱,用80%乙醇洗脱,收集流出液和洗脱液,回收乙醇,残留物水浴挥干。
2.2 色谱条件
Agilent Eclipse Plus C18RRHD色谱柱(2.1 mm×100 mm,1.8 μm),柱温45 ℃,进样体积为1 μL,流动相0.1%甲酸水(A)-0.1%甲酸乙腈(B)进行梯度洗脱(0~4.0 min,5%~45% A;4.0~10.0 min,45%~95% A;10.0~15.0 min,95%~100% A;20.0~21.0 min,95%~0%A ;21.0~22.0 min,0%~5% A)。
2.3 质谱条件
电喷雾离子源,扫描方式为负离子扫描(ESI-:m/z50~1 000),毛细管电压3.5 kV(ESI-),离子源温度 200 ℃,雾化气N2,压力1.2 bar,N2温度180 ℃,干燥气温度 200 ℃,气体体积流量 6 L/min,准确质量测定采用甲酸钠校正标准液,校正模式选用 Enhanced Quadratic.数据分析采用 Data Analysis软件, Metabolite Predict(micrOTOF 2.3)软件,Metabolite Detect(micrOTOF 2.3)软件、质量亏损过滤(MDF)。
2.4 实验方法
2.4.1 厌氧培养液的配制[8]
37.5 mL A液(0.78% K2HPO4),37.5 mL B液(0.47% KH2PO4,1.18% NaCl,1.2% (NH4)2SO4,0.12% CaCl2,0.25% MgSO4·H2O),C 液50 mL 8%Na2CO3。0.5 gL-半胱氨酸,2 mL 25%L-抗坏血酸,1 g牛肉膏,1 g蛋白胨,1 g营养琼脂,加蒸馏水至1 L,盐酸调pH7.5~8.0。
2.4.2 供试品制备
取荭草花提取物0.12 g,加入50%甲醇水6 mL,充分溶解,备用。
2.4.3 人离体培养肠道菌群对荭草花有效组分的代谢[9]
取健康成人新鲜粪便,按1 g粪便 4 mL 0.9%生理盐水混合均匀超声10 min,6 000 rpm离心5 min,取上清液即为人肠菌培养液。将0.5 mL人肠菌培养液加入6 mL厌氧培养液中(已灭菌),混匀,迅速置于厌氧培养罐中,加入1个厌氧产气袋后盖上培养罐盖,置于37 ℃恒温培养箱中培养24 h,使肠菌培养液中的肠道菌充分成长。实验分为3组,实验组、空白对照A组、空白对照B组。实验组:将离体肠道菌液与荭草花提取物溶液60 μL,混合均匀,立即置于于厌氧培养罐中,加入1个厌氧产气袋后迅速盖上培养罐盖,置于37 ℃恒温培养箱,分别培养4、12、36、72 h (n=3)后,放入-20 ℃保存,备用。空白对照A组,空白离体肠道菌液(不加红草花提取物);空白对照B组, 将厌氧培养液和荭草花提取物混合,将上述样品按照实验组方法进行厌氧培养。所用器具均经高压蒸汽121 ℃灭菌20 min。
2.4.4 样品处理方案
将“2.4.3”项下的生物样品,分别转入50 mL离心管中,分别向其中加入1倍体积乙酸乙酯进行萃取,涡悬震摇3 min,提取3次,合并3次萃取液,于37 ℃下N2吹干。残渣加200 μL 50%甲醇水进行溶解,15 000 rpm离心5 min,上清液UPLC-Q-TOF/MS进样分析。
3 实验结果
3.1 UPLC-Q-TOF/MS分析结果
在“2.4.4”项下,获得准分子离子峰高分辨质量数和准分子离子峰MS2质谱碎片信息,结合Metabolite Predict(micrOTOF 2.3),Metabolite Detect(micrOTOF 2.3)软件对荭草花有效组分的代谢产物进行预测分析,得到荭草花有效组分在人肠道菌群中代谢产物图谱,包括在含药培养基,空白肠菌液,含药肠菌液的图谱以及由质谱软件计算形成的差异图谱(见图1)。

图1 荭草花有效组分在人肠道菌群中的代谢产物ESI-总离子流图及4、12、36、72 h含药肠菌液与空白肠菌液、含药培养基差异Fig.1 Base peak chromatograms of Polygonum orientale L. flower extract metabolites in man intestinal flora sample in negative mode and different chromatograms are 4, 12, 36 h, and 72h respectively注:A.含药培养基;B.空白肠菌液;C.含药肠菌液; D、E、F、G分别是4、12、36、72 h含药肠菌液。Note:A.Drug-containing medium;B.Blank intestinal fluid;C.Medicinal enteric liquid;D、E、F、G are 4 h,12 h,36 h,72 h drug-containing intestinal bacteria respectively.
3.2 荭草花有效组分在培养基中的原型产物鉴定分析
化合物Y1tR为9.3 min时,负模式下出现准分子离子峰[M-H]-m/z431.099 C21H19O10(err-1.4 ppm),与山柰素-3-O-α-L-鼠李糖苷对照品一致,故推测tR为9.3 min的化合物Y1为山柰素-3-O-α-L-鼠李糖苷。
化合物Y2tR为11.8 min时,负模式下出现准分子离子峰[M-H]-m/z312.122 8 C18H18NO4(err 4.1 ppm),参照相关文献[2]并结合质谱数据,推测tR为11.8 min时的化合物Y2为N-tans-对羟基苯乙基阿魏酰胺。
化合物Y3tR为12.9min时,负模式下出现准分子离子峰[M-H]-m/z301.036 7 C15H9O7(err-4.3 ppm),与槲皮素标准品相同,故推测tR为12.9min的化合物Y3为槲皮素。
化合物Y4tR为5.7 min时,MS质谱出现准分子离子峰为[M-H]-m/z607.132 5 C27H27O16(err-3.4 ppm)。据参考文献[10],故推测tR为5.7 min的化合物Y4为山柰酚-3-O-( 2″-O-α-L-鼠李糖基)-β-D-葡萄糖醛酸苷。
化合物Y5tR为6.8 min时,负模式下出现准分子离子峰[M-H]-m/z447.092 7 C21H19O11(err 1.3 ppm),与山柰素-3-O-β-D-葡萄糖苷标准品相同,故推测tR为5.6 min的化合物5为山柰素-3-O-β-D-葡萄糖苷。
化合物Y6tR为5.2 min时,MS质谱出现准分子离子峰[M-H]-m/z623.127 C27H27O17(err-2.6 ppm)。进一步作MS2质谱分析,从中可见[M-H]-m/z623.126 6 C27H27O17(err-1.9 ppm),碎片离子峰[M-H-C6H10O4-C6H8O6]-m/z301.036 6 C15H9O7。根据以上离子碎片信息和参照相关文献[10],推测tR为5.2 min的化合物Y6为槲皮素-3-O-( 2″-O-α-L-鼠李糖基)-β-D-葡萄糖醛酸苷。
化合物Y7tR为6.9 min时,负模式下,出现准分子离子峰[M-H]-m/z447.093 5 C21H19O11(err-0.4 ppm),与标准品槲皮苷一致,推测tR为6.9 min的化合物Y7为槲皮苷。
3.3 有效组分在人肠道菌群中代谢产物鉴定分析
3.3.1 氢化代谢产物的鉴定
在tR为4.4 min时,负模式下出现准分子离子峰[M-H]-m/z291.087 5 C15H15O6,显示碎片离子峰[M-H]-m/z136.038 5C7H7O3,故推测tR为4.4 min的化合物M1为儿茶素的氢化代谢产物。在tR为7.6 min时,负模式下出现准分子离子峰[M-H]-m/z284.129 1 C17H18NO3,进一步作MS2质谱分析,出现准分子离子峰[M-H]-m/z284.128 1 C17H18NO3,碎片离子峰[M-H-C7H6O]-m/z178.087 4 C10H12NO2。由离子碎片信息可见,准分子离子峰[M-H]-m/z284丢失106 Da形成离子碎片峰[M-H-C7H6O]-m/z178,为化合物N-p-香豆酰酪胺丢失122 Da(-C7H6O)、氢化碎片离子。参照相关文献[3]并结合质谱数据推测tR为7.6 min的化合物M3为N-p-香豆酰酪胺的氢化代谢产物。在tR为8.3 min时,负模式下出现准分子离子峰[M- H]-m/z314.140 4 C18H20NO4,进一步作MS2质谱分析,出现准分子离子峰[M-H]-m/z314.139 2 C18H20NO4,碎片离子峰[M-H-C7H6O]-m/z180.066 3 C9H10NO3。由离子碎片信息可见,准分子离子峰[M-H]-m/z314丢失134 Da形成离子碎片峰[M-H-C9H10O]-m/z180,为N-tans-对羟基苯乙基阿魏酰胺丢失134 Da (-C8H8O-CH2) 、氢化碎片离子。故推测tR为8.3 min的化合物M4为化合物M7(N-tans-对羟基苯乙基阿魏酰胺)的氢化代谢产物。
3.3.2 氢化、羟基化代谢产物鉴定
在tR为6.0 min时,负模式下出现准分子离子峰[M-H]-m/z300.123 8 C17H18NO4,进一步作MS2质谱分析,出现准分子离子峰[M-H]-m/z300.1 25 3 C17H18NO4,碎片离子峰[M-H]-m/z178.086 6 C10H12NO2。由离子碎片信息可见,准分子离子峰[M-H]-m/z300丢失122 Da(-C7H6O2)形成离子碎片峰[M-H-C7H6O2]-m/z178,与化合物M3离子碎片峰一致。准分子离子峰[M-H]-m/z300较化合物M3增加16 Da(+OH), 故推测tR为6.0 min的化合物M2为N-p-香豆酰酪胺的氢化、羟基化代谢产物。在tR为6.3 min时,负模式下, 出现准分子离子峰[M-H]-m/z330.133 7 C18H20NO5,较化合物M4增加16 Da (+OH), 且其亲水性增加,保留时间变短,推测tR为6.3 min的化合物M13为N-tans-对羟基苯乙基阿魏酰胺的氢化、羟基化代谢产物。在tR为3.9 min时,负模式下,分别出现准分子离子峰[M-H]-m/z303.050 2 C15H11O7(err 2.6 ppm),较山柰酚增加18 Da (+OH+2H) ,且其亲水性增加,保留时间变短,故推测tR为3.9 min的化合物M14为山柰酚羟的基化、氢化代谢产物。
3.3.3 甲基化代谢产物鉴定
在tR为3.6 min时,负模式下,出现准分子离子峰[M-H]-m/z183.029 8 C8H7O5,较没食子酸增加14 Da (+CH2), 且亲脂性较为增大,故推测tR为3.6 min的化合物M11为没食子酸甲基化代谢产物。
3.3.4 甲基化、羟基化代谢产物鉴定
在tR为9.3 min时,负模式下,出现准分子离子峰[M-H]-m/z344.150 8 C19H22NO5,较化合物M4增加30 Da (+CH2+OH)。故推测tR为9.3 min的化合物M5为N-tans-对羟基苯乙基阿魏酰胺的甲基化、羟基化代谢产物。
3.3.5 C2-C2双键还原、O-C2键开环裂解代谢产物鉴定
在tR为6.2 min时,负模式下,出现准分子离子峰[M-H]-m/z305.066 8 C15H13O7,较槲皮素增加4 Da (+4H),故推测tR为6.2 min的化合物M7为槲皮素C2-C2双键还原、O-C2键开环裂解代谢产物。
3.3.6 C2-C2双键还原代谢产物鉴定
在tR为7.8 min时,负模式下,出现准分子离子峰[M-H]-m/z287.056 C15H11O6,较山柰酚增加2 Da (+2H), 故推测tR为7.8 min的化合物M8为山柰酚C2-C2双键还原代谢产物。
3.3.7 羟基化代谢产物鉴定
在tR为8.0 min时,负模式下,出现准分子离子峰[M-H]-m/z317.029 7 C15H9O8,较槲皮素增加16 Da (+OH),亲水性增加,故推测tR为8.0 min的化合物M9为槲皮素羟基化代谢产物。
3.3.8 脱羧基代谢产物鉴定
在tR为1.9 min时,负模式下,出现准分子离子峰[M-H]-m/z125.025 C6H5O3,较没食子酸减少44 Da (-COOH), 且亲水性较为增大,故推测tR为1.9 min的化合物M10为没食子酸脱羧基代谢产物。
3.3.9 氢化、二羟基化代谢产物鉴定
在tR为5.0 min时,负模式下, 出现准分子离子峰[M-H]-m/z316.118 8 C17H18NO5(err-0.2 ppm),较化合物M3增加32 Da(+2OH),亲水性较为增加,保留时间变短,故推测tR为5.0 min的化合物M12为N-p-香豆酰酪胺的氢化、二羟基化代谢产物。
3.3.10 羰基化代谢产物鉴定
在tR在13.3 min时,负模式下,出现准分子离子峰[M-H]-m/z329.031 1 C16H9O8,较槲皮素增加28 Da(+CO),亲水性较为增大,故推测tR为13.3 min的化合物M6为槲皮素羰基代谢产物。
3.4 荭草花有效组分在人肠道菌群孵育液中的代谢物生物转化途径
根据以上代谢产物的鉴定结果,荭草花有效组分在人肠道菌群孵育液中的代谢物生物转化途径(见表1,图2)。
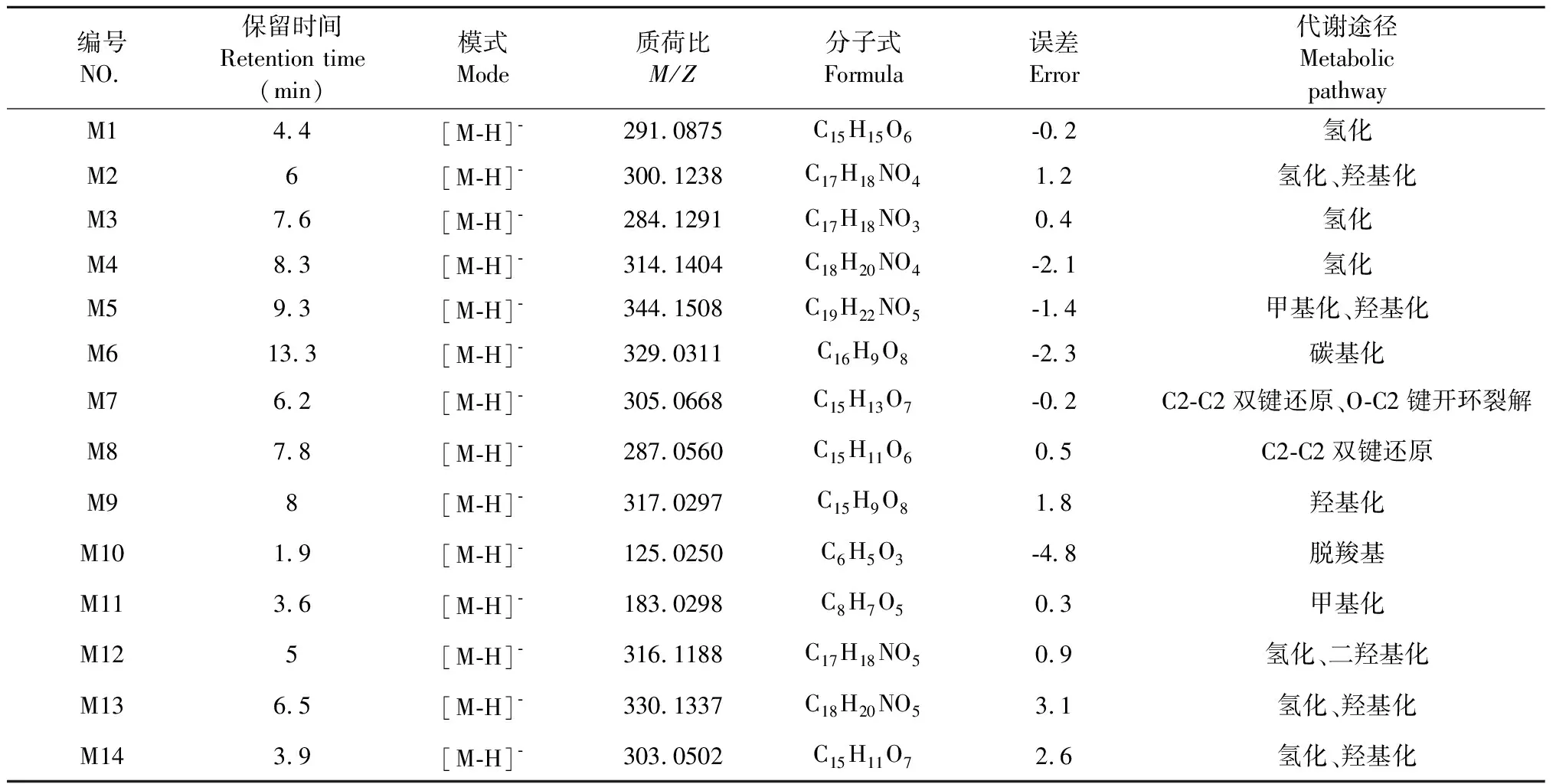
表1 荭草花有效组分在人肠道菌群孵育液中的代谢物分析Table 1 Analysis of metabolites of effective components of Polygonum orientale L. flower in human intestinal flora

图2 荭草花有效组分在人肠道菌群中可能的代谢途径Fig.2 Possible metabolic pathway of Polygonum orientale L. Flower extract in human intestinal flora
4 讨论
传统中药主要是经口服给药,而肠道是口服药物在体内代谢的重要场所,虽然某些中药在血浆中的原形成分和生物利用度不高,但却有很好的疗效,这与肠道内寄居的大量细菌对药物的生物转化作用密不可分。目前,国内对中药单一有效组分在肠道菌群中的代谢研究较多,而患者服用的药物往往是多成分的,发挥药效作用的也不仅仅是单一成分代谢物药理活性简单的叠加[5,11]。因此,研究多成分中药在肠道菌群中的代谢产物,阐明肠道菌群与中药有效成分的作用机理,将有助于开发新型中药制剂和提高中药制剂的有效利用[12]。
针对中药在肠道菌群的代谢研究,合适的检测分析方法将有效的阐明有效成分在体内的代谢转化过程,本实验采用的UPLC-Q-TOF/MS分析方法,与传统分析方法相比具有高效、高灵敏度、检测模式多样、专属性强、分析速度快、并提供丰富的数据信息和数据处理等优点[13]。
在本实验中,荭草花有效组分经离体人肠道菌群的代谢后,共检测到14个代谢产物,主要包括N-p-香豆酰酪胺、N-tans-对羟基苯乙基阿魏酰胺的氢化、氢化羟基化、甲基化羟基化代谢产物,山柰酚的双脱氧、C2-C3双键还原、脱氧氢化代谢产物,槲皮素的羟基化、O-C2键开环裂解脱氧化、C2-C3双键还原O-C2键开环裂解代谢产物,儿茶素的氢化代谢产物和没食子酸的脱羧、甲基化代谢产物。在肠菌液孵育4 h后荭草花有效组分发生了脱羟基、氢化羟基化、氢化、C2-C2双键还原、O-C2键开环裂解、甲基化代谢反应,而对比12、36、72 h除了其共有的代谢反应外,发现36 h发生了脱羧基代谢反应,72 h发生了氢化二羟基化反应。从图1中可以看出,大多数代谢产物随着时间的推移,检测到该代谢产物的量越来越少,推测其代谢产物,又进行了二次代谢。而其少部分的代谢产物如M3、M4其发生氢化代谢反应后,随着时间的推移,其代谢产物的量没有明显的变化,这可能由于M3、M4发生氢化代谢反应后其代谢产物的稳定性得到了改善,使其在肠菌液能够稳定存在。综合肠道菌群的实验结果,表明荭草花有效组分在体内吸收的过程中,可能会被肠道里的菌群代谢成小分子物质或水溶性增强的物质,从而影响荭草花有效组分的生物利用度,而其有效成分的各个成分具体是被肠道中的何种细菌作用,还需进一步研究。
荭草花因具有抗心肌缺血的作用而被关注,其有效组分中主要有槲皮素、山柰酚、没食子酸等活性物质。研究表明,槲皮素、山柰酚、没食子酸具有保护心肌的作用[14-16]。但荭草花有效组分经口服吸收后,绝对生物利用度较低,抗心肌缺血作用却显著,很可能是其有效组分经代谢转化后的代谢产物产生作用,但具体的作用物质和机制还有待研究。实验结果初步判断了其有效成分在人离体肠道菌群的代谢情况,但对全面反映荭草花有效组分在体内代谢过程具有一定的局限性,还需从血液、胆汁、尿液、粪便等角度全面反映其有效组分在体内的代谢过程。本实验结果表明,荭草花有效组分经离体人肠道菌群的作用后,发生了羟基化、双羟基化、脱氧、氢化还原等Ⅰ相代谢反应和甲基化Ⅱ相代谢反应,这为进一步研究其在体内具体作用的物质和机制提供实验基础。

