新型天麻素衍生物在辣椒碱致大鼠偏头痛模型中的疗效
谷漫峡,王平汉,陈 雏,杜俊蓉*
1四川大学华西药学院,成都 610041;2四川省中医药科学院,成都 610041
偏头痛是一种常见的由多种复杂的因素导致的慢性神经血管系统紊乱性疾病。偏头痛发作具有中重度搏动性特点,常表现为单侧发作、并伴随有恶心、呕吐、畏光、畏声等中枢神经系统炎性症状[1]。
天麻素是从天麻块茎提取的主要活性成分之一,具有抗惊厥、抗癫痫、止痛、镇静等药理学功效。已有研究证实,天麻素能明显改善偏头痛患者的发作频率和程度[2]。目前,天麻素作为一种主要的神经治疗药物已普遍应用于临床。然而由于天麻素的结构限制,不易通过血脑屏障进入脑组织,使其进入神经系统发挥作用疗效较差[3]。因此,我们合成了阿魏酸与天麻素的酯类衍生物,以提高天麻素在中枢神经系统(central nervous system,CNS)中的作用。其中阿魏酸是治疗心脑血管疾病药品的基本原料,具有抗氧化、镇痛等活性。天麻素、天麻素衍生物化学结构如图1所示。
辣椒碱是红辣椒中的一种辛辣成分,具有脂溶性。研究发现,它可通过与1型瞬时受体电位辣椒素受体(transient receptor potential vanilloid type 1 receptor,TRPV1)结合,活化外周和中枢神经末梢的三叉痛觉感受传入神经,导致外周初级神经元和中枢次级神经元的激活,促进疼痛相关信号的活化以及相关炎症因子的释放,产生中枢和外周的应答反应[4]。有研究发现,小脑延髓池内滴注辣椒碱能激活三叉神经血管系统(trigeminovascular system,TGVS)进而诱发偏头痛样症状[5,6]。
本研究采用小脑延髓池滴注辣椒碱致大鼠偏头痛模型,来探讨新型天麻素衍生物在辣椒碱所致急性偏头痛中的疗效及其作用机制。

图1 Gas、Gas-D化学结构及其气相色谱图Fig.1 Chemical structures and UPLC chromatograms of Gas and Gas-D
1 材料
1.1 实验动物
SPF级健康雄性Wistar大鼠,体重280~330 g,购自四川省成都市达硕实验动物有限公司,许可证号:SYXK(川)2014-189。常规饲养,自由饮水与摄食。饲养环境温度维持 24 ± 1 ℃ ,相对湿度 50% 左右。
1.2 试剂及仪器
辣椒碱(北京百灵威)、Gas(成都曼斯特)、Gas-D(由四川中医科学院陈雏副教授制备)(结构如图1所示)、NO测定试剂盒(南京建成)、CGRP ELISA Kit(武汉优尔生)、山羊抗pERK抗体(Santa Cruz)、兔抗c-Fos抗体(北京中杉金桥)、鸡抗CGRP抗体(Neuromics)、β-actin(Santa Cruz)、BCA蛋白浓度测定试剂盒(上海碧云天)。。
Varioskan Flash全波长酶标仪(Thermo Fisher)、Gel Pro Analyzer 6.0(Media Cybernetics,美国)、 Gel Doc XRS+凝胶成像分析系统、DS-Fi1c 正置荧光显微镜(NiKon,Japan)、冰冻切片机(LEICA RM2245,Nussloch,Germany)。
2 方法
2.1 偏头痛动物模型的建立及给药
48只大鼠随机均分为六组:空白对照组、模型组、天麻素组(Gas100、Gas50)及天麻素衍生物组(Gas-D100、Gas-D50)。预防灌胃给药 1 h,剂量10 ml/kg,空白对照组、模型组给予溶媒。
腹腔注射10%水合氯醛(300 mg/kg)麻醉大鼠,固定,5 min内小脑延髓池内注入辣椒碱溶液(100 μL, 10 nmol),空白对照组给予等量溶媒。随后将大鼠头高位30°放置30 min,再俯卧位90 min后处死[6]。
2.2 药物配制方法
辣椒碱溶液:将辣椒碱溶于10%无水乙醇、10%吐温80和0.9% NaCl溶液(1∶1∶8)的溶媒中配成5 mM的浓溶液,4 ℃保存,临用前将其用0.9% NaCl溶液稀释成0.1 mM,超声使其充分溶解。
Gas、Gas-D:溶于0.5% CMC-Na溶液中,充分混匀,使其终浓度为100 mg/kg或50 mg/kg的溶液。
2.3 标本处理
造模2 h后,腹腔注射水合氯醛深度麻醉大鼠,颈外静脉取血。采集血样后,灌流,取右侧TG、TNC,固定脱水,存于-80 ℃;取脑、TNC及左侧TG液氮速冻后存于-80 ℃。
2.4 NO、CGRP含量测定
血浆和脑组织中NO以及血浆中CGRP的测定参照试剂盒说明书进行。
2.5 c-Fos和pERK免疫组化检测
固定脱水后的TNC或TG从-80 ℃取出,冰冻切片机中连续切片。4%多聚甲醛30 min,0.01 M PBS洗片。0.03%Triton 100,37 ℃,1 h,PBS洗片。3%H2O220 min,PBS洗片,高温高压抗原修复3 min。BSA封闭1 h。兔抗c-Fos(1∶100)或山羊抗pERK(1∶100)37 ℃,1 h, 4 ℃过夜。PBS洗片。二抗37 ℃,1 h, PBS洗片。SABC 37 ℃,1 h,PBS洗片。 DAB染色1 min,水洗终止。梯度酒精脱水烘干,封片。镜下采图,各组切片选取5个相同视野[7]。
2.6 CGRP免疫荧光检测
TNC从-80 ℃取出,冰冻切片机中连续切片。4%多聚甲醛30 min,0.01M PBS洗片。0.03% Triton 100 ,37 ℃,1 h,PBS洗片。3%H2O220 min。BSA封闭1 h。鸡抗CGRP(1∶100)37 ℃,1 h。4 ℃过夜,PBS洗片。兔抗FITC IgG(1∶100)37 ℃,避光1 h。PBS洗片,抗荧光猝灭剂封片,镜下采图。
2.7 免疫印迹检测TNC中c-Fos、CGRP蛋白以及TG中pERK的表达
取液氮速冻的TG、TNC组织,用RIPA缓冲液提取总蛋白,采用BCA试剂盒测定蛋白浓度。随后采用Western Blot法检测TNC中c-Fos蛋白的表达。提取的蛋白在凝胶电泳分离后转移到PVDF膜上[10]。将膜置于5%脱脂牛奶(0.5% TBST配制)中封闭1 h。一抗(兔抗c-Fos抗体1∶500;山羊抗pERK抗体1∶200;鸡抗CGRP抗体1∶500)孵育,4 ℃过夜,而后室温孵育二抗1 h后采用电化学发光法显色,凝胶成像系统曝光。每个波段的光密度值由 Gel Pro Analyzer6.0( Media Cybernetics,美国) 测量分析。
2.8 实验数据分析
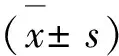
3 结果
3.1 Gas及Gas-D对NO浓度的影响
结果如表1,与空白对照组相比,模型组血浆NO浓度显著升高(P<0.01);Gas-D(100或50 mg/kg)对辣椒碱诱导产生的血浆NO有抑制作用,且呈现剂量相关性(P<0.01,P<0.05);在等剂量下,Gas-D的效果更显著(Gas-D100 与Gas100相比P<0.01;Gas-D50 与Gas50相比P<0.05),Gas50对血浆中NO有抑制的趋势,但与模型组相比不存在显著性差异(P>0.05)。
Gas-D100与Gas100均能显著降低脑组织中NO水平,且组间相比无差异。与模型组相比,Gas-D50能有效降低脑组织中NO水平(P<0.05),而Gas50无此效果(P>0.05),组间比较存在显著性(P<0.05)。

表1 各组大鼠血浆及脑组织NO浓度测定结果Table 1 Results of NO concentration of plasma and brain tissue in tars(n = s)
注:与模型组比较,*P<0.05,**P<0.01;与Gas100比较,#P<0.05,##P<0.01;与Gas50比较,△P<0.05,△△P<0.01(下同)。
Note:Compare with model,*P<0.05,**P<0.01;Compare with Gas100,#P<0.05,##P<0.01;Compare with Gas50,△P<0.05,△△P<0.01.(similarly hereinafter).
3.2 Gas及Gas-D对血浆及TNC中CGRP表达水平的影响
表2统计数据显示,与空白对照组相比,模型组血浆中CGRP水平显著升高(P<0.01)。与模型组相比,Gas-D100与Gas100治疗组血浆CGRP浓度均显著降低(P<0.05,P<0.05)。Gas-D50具有降低血浆CGRP水平的趋势,与模型组比无显著性差异,而Gas50无抑制作用(P>0.05)。此外在等剂量下,Gas-D较Gas更有效。
与空白对照组比,模型组TNC中CGRP表达水平显著增多(P<0.01)。与模型组相比,Gas-D 100、Gas100及Gas-D50组能显著抑制辣椒碱所致CGRP表达水平增多(P<0.01,P<0.01,P<0.05),Gas50有抑制CGRP表达的趋势,与模型组比无显著差异(P>0.05)。Gas-D与等剂量的Gas相比对CGRP的抑制作用更显著。图2、5分别为IHC和WB法反应的各组小鼠TNC中CGRP的表达情况。

表2 各组大鼠血浆及TNC中CGRP表达水平结果Table 2 The results of CGRP expression in plasma and TNC in rats s)

图2 各组大鼠TNC中CGRP的表达情况Fig.2 The effects of Gas and Gas-D on CGRP expressions in TNC in capsaicin-induced migraine rats.TNC samples were determined by IF.Representative specimens of CGRP in TNC in different group
3.3 Gas及Gas-D对TNC中c-Fos蛋白表达的影响
图3、5所示,分别为采用IHC和WB测定TNC组织中c-Fos蛋白表达情况。镜下阳性细胞散在分布于TNC,呈灰黑色。各组大鼠阳性细胞个数统计结果如表3所示。模型组 c-fos 阳性细胞数与空白对照组比较显著增多(P<0.01)。与模型组相比,Gas-D 100与Gas100组c-Fos蛋白表达显著降低(P<0.01,P<0.01),且Gas-D100与Gas100相比对c-Fos蛋白表达抑制作用更显著(P<0.05)。Gas50无抑制效应(P>0.05),而可显著抑制c-Fos蛋白表达(P<0.05),Gas-D50与Gas50相比有显著差异(P<0.05)。此外Gas-D对c-Fos蛋白表达的抑制呈现剂量相关性。
3.4 Gas及Gas-D对TG中pERK表达的影响
Gas及Gas-D对TG中pERK表达的影响见图4、5,其中pERK阳性表达呈深灰色。我们对各组大鼠三叉神经节下颌神经分支(V1)处pERK 阳性表达百分率进行统计[6],结果见表4。与空白对照组相比,模型组pERK 表达显著增多(P<0.01);与模型组相比,Gas-D 100、Gas100及 Gas-D50组均有


组别GroupTNC中c-Fos阳性细胞数Number of positive c-Fos neurons in TNC (IHC)空白对照 control 14±4.86∗∗模型 model 40±10.15Gas50 35±14.53Gas100 25±4.95∗∗Gas-D50 30±14.74∗,△Gas-D10021.5±3.82∗∗,#

图3 Gas及Gas-D对TNC中c-Fos蛋白表达情况(IHC)Fig.3 The effects of Gas and Gas-D on c-Fos expressions in capsaicin-induced migraine rats.Cross-sections through the TNC were stained dark brown are the activation marker Fos in neuronal nuclei.Representative specimens of immune-staining of c-Fos protein in different group
抑制作用(P<0.01,P<0.01,P<0.05)。Gas50有抑制pERK表达的趋势(P>0.05)。Gas-D100和 Gas-D50分别与等剂量的Gas相比,均存在显著性差异(P<0.05,P<0.01)。

表4 各组大鼠TG中pERK表达水平结果Table 4 The results of pERK expressions in TG in rats(n = s)

图4 Gas及Gas-D对TG中pERK表达情况Fig.4 The effects of Gas and Gas-D on the expression of pERK-IR in TG 2 h after capsaicin infusion.Representative specimens of pERK in TG in different group

图5 Gas及Gas-D对TNC中c-Fos/CGRP以及TG中pERK表达的影响(WB)Fig.5 The results of c-fos protein and CGRP expressions in TNC and pERK in TG(A).The TNC and TG were harvested for WB analysis.The ratio of c-Fos(B)/CGRP(C)/pERK(D) to β-actin was densitometrically analyzed and is expressed as the optical density relative to the model group.The data are expressed as mean ± SD (n = s).*P<0.05,** P<0.01,vs.model group.
4 讨论
目前,偏头痛的发病机制尚未被完全阐释清楚,三叉神经血管学说较为全面的解释了偏头痛的病理生理过程而被广泛接受[5,6]。该学说认为,偏头痛的发作源于三叉神经血管系统TGVS的激活,TGVS将外周痛觉信号通过TG传导至脑干内的TNC并进一步传至上级痛觉中枢,从而在大脑皮层产生痛觉[8]。目前,偏头痛动物模型主要为硝酸甘油动物模型,但是该模型仅限于偏头痛样症状,而不足以说明偏头痛的神经源性炎症机制[5,9]。研究表明,辣椒碱可强烈兴奋A-δ和C纤维初级痛觉感受神经元,激活TRPV1并与之结合,活化外周和中枢神经末梢的三叉痛觉感受传入神经,导致外周初级神经元和中枢次级神经元的激活,进而可以导致TGVS的活化[4-6]。TGVS激活后一方面导致脑膜血管扩张、血浆蛋白渗出、神经元激活、血管活性物质NO[2]、CGRP[2,7,9]等的释放,这些产物又通过强烈的扩血管作用,加剧神经源性炎症反应;另一方面导致伤害性疼痛标志物pERK[10]和疼痛相关信号c-Fos蛋白[5,6,9]表达增多,从而激活下丘脑、脑干及脊髓节段神经,引起三叉神经纤维的超敏反应,而诱发头痛发作。有研究报道,小脑延髓池注射辣椒碱可诱导大鼠产生急性偏头痛症状[4-6]。因此我们采用辣椒碱所致大鼠急性偏头痛模型。
在中枢神经系统内,c-Fos参与伤害性感受传导通路的调制,常作为神经元受刺激后激活的标志物[9]。本研究发现,辣椒碱能强烈激活c-Fos蛋白的表达,而在给予天麻素及其衍生物治疗后,c-Fos蛋白的表达被显著抑制,且呈现剂量相关性。pERK是ERK被激活的磷酸化形式,可介导伤害性刺激通路[10]。本研究发现,注射辣椒碱的大鼠TG中pERK的表达显著增多,而天麻素及其衍生物均可有效抑制 pERK的表达。由此推论,Gas、Gas-D能有效抑制TNC中c-Fos蛋白的表达从而减少TNC神经元的激活,并能抑制ERK的磷酸化水平而抑制信号传递,缓解疼痛刺激,减轻偏头痛症状。
CGRP是目前公认的作用最强的血管扩张肽[2,7]。NO为血管内皮细胞舒张因子,可促使血管平滑肌松弛,导致脑膜血管扩张而诱发头痛[2,9]。有研究报道,在偏头痛发作期,外周血中CGRP 水平增高,且偏头痛发作的强度和持续时间与血中 CGRP 水平呈正相关[7,9]。本研究结果显示,小脑延髓池注射辣椒碱后大鼠血浆和中枢中NO及CGRP的表达较空白对照组显著升高,NO与CGRP存在共表达的情况。我们推测,二者可能协同发挥扩张脑血管的作用,Gas与Gas-D可能是直接消除中枢的NO,随后产生抑制CGRP表达的效果。
综上,本项研究表明,Gas-D能有效抑制NO、CGRP的水平从而抑制血管扩张作用;Gas-D可减少TG中pERK和TNC中c-Fos蛋白的表达,从而抑制痛觉信号的传导,抑制TGVS系统的激活,产生抗偏头痛作用。

