多金属氧酸盐/PANI/ZnO复合材料的制备、表征及光催化性能
单秋杰,王 鹏,白丽明,赵春艳,司徒嘉俊
(齐齐哈尔大学化学与化学工程学院,黑龙江 齐齐哈尔 161006)
0 引言
光催化技术具有简便易行、研究成本低、不产生后续污染等优点[1-5],是一个具有巨大潜力的科研课题,受到越来越多研究人员的关注.ZnO在光催化领域的应用已有报道[6-7],因为ZnO具有化学稳定性强、氧化还原能力强、光催化活性高等优点,是一种高性能、低成本的半导体材料,因此,以ZnO做催化剂,对光催化技术的研究具有重要意义.Keggin型多金属氧酸盐(POMs),因其自身优异的性能,一直备受关注.[8-12]而以良好化学稳定性和热稳定性的聚苯胺(PANI)为载体掺杂POMs[13],能有效利用两者特性,提高光催化活性.随着我国科技水平的不断提高,科技发展带来的环境代价也凸现出来,工业污水的排放致使大量水资源污染.水是生命之源,水资源污染将会严重危及生态平衡,所以,从根本上解决水资源污染问题,保护水资源,已经成为人类最重要的任务之一.本文合成K8[Cu(H2O)NiW11O39]/PANI/ZnO复合材料,采用红外光谱(FTIR)、紫外-可见吸收光谱(UV-vis)、X射线粉末衍射(XRD)、低温N2物理吸附-脱附(BET) 、扫描电镜(SEM)和能谱(EDS)对其进行了表征.以孔雀石绿(MG)作为模拟污染物,研究复合材料光催化性能,旨在开发出应用型的高效光催化剂.
1 实验部分
1.1 仪器和试剂
仪器:Nicolet-50X型红外光谱仪(美国Perkin-Elmer公司);TU-1901型紫外光谱仪(北京赛多利斯仪器系统有限公司);D8 FOCUS型X射线粉末衍射仪(德国布鲁克-AXS公司);Autosorb1型物理吸附脱附仪(美国康塔公司);S-4300型扫描电镜(日本HITACHI公司).
试剂:所有试剂均为分析纯.
1.2 催化剂的制备
K8[Cu(H2O)NiW11O39] 的制备:将18.15 g二水合钨酸钠溶于100 mL去离子水中,用冰醋酸调节pH=6.3,加热至沸腾,滴加0.01 mol Ni2+的水溶液并剧烈搅拌.反应完全后,滴加0.01 mol Cu2+的水溶液,用冰醋酸调节pH=5,反应1.5 h.冷却至室温,滴加适量无水乙醇及12.25 g氯化钾固体,常温搅拌0.5 h.所得溶液放入冰箱冷却过夜,抽滤,烘干,得到K8[Cu(H2O)NiW11O39](CuW11Ni).
PANI/ZnO中间体的制备:将50 mL含有5 mmol过硫酸铵的盐酸溶液(0.1 mol/L)加入到250 mL的烧瓶中,再加入0.2 g ZnO,超声分散0.5 h.向烧瓶中滴加50 mL含5 mmol苯胺的盐酸溶液(0.1 mol/L),并剧烈搅拌,冰水浴控温在0℃~5℃,反应5 h.离心上述溶液,沉淀依次用盐酸溶液(0.1 mol/L)及去离子水洗涤,烘干,得到PANI/ZnO.
K8[Cu(H2O)NiW11O39]/PANI/ZnO的制备:将0.2 g 中间体溶于20 mL蒸馏水,超声分散0.5 h.上述溶液用盐酸(0.1 mol/L)调节pH=3后,加入30 mL K8[Cu(H2O)NiW11O39](0.1 mol/L)(乙醇和水的体积比为1∶1的溶剂)溶液,60℃回流5 h.冷却至室温后,洗涤、抽滤,烘干,得到K8[Cu(H2O)NiW11O39]/PANI/ZnO(CuW11Ni/PANI/ZnO).
1.3 实验方法
光催化降解MG:配制不同浓度的MG(100 mL)做模拟污染物试样,加入定量催化剂,用冰醋酸调节pH,避光搅拌30 min,使其达到吸附-脱附平衡.利用可见分光光度计测吸光度A0,然后在30 W紫外灯下照射100 min,每隔10 min,离心后测试样吸光度At.降解率计算通式为
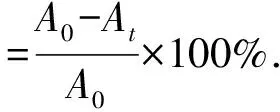
式中:A0为光照前试样吸光度,At为光照后试样吸光度.
2 结果与讨论
2.1 催化剂表征
2.1.1 FTIR分析
CuW11Ni/PANI/ZnO和PANI/ZnO的FTIR谱做对比(见图1).由图1可见,PANI/ZnO的FTIR谱出现PANI的特征吸收峰,1 582.95和1 503.05 cm-1处的吸收峰归属于醌式和苯式结构的特征峰.1 340.24 和1 308.17 cm-1处的吸收峰归属于C—N键的伸缩振动;1 167.23 和813.20 cm-1处的吸收峰归属于苯环中C—H面内和面外的弯曲振动,表明苯胺单体已被氧化为聚苯胺[14],且包覆在ZnO表面.CuW11Ni/PANI/ZnO的FTIR谱图显示,与CuW11Ni复合后,除了出现PANI的特征峰外,在503.96,813.20,892.60和954.45 cm-1处还出现Keggin结构杂多酸盐的特征峰.[15-16]此外,在569.99 cm-1处还出现了Zn—O四面体的反对称伸缩振动峰.由此说明,CuW11Ni已经成功复合到PANI/ZnO上,并且保持Keggin结构的基本骨架.
2.1.2 XRD分析
CuW11Ni/PANI/ZnO和PANI/ZnO的XRD分析见图2.由图2可见,在PANI/ZnO的XRD谱图中,未观察到纯的ZnO特征衍射峰,这是由于PANI中大量的非晶态衍射干扰了ZnO峰的出现.在2θ为6°,19°和25°左右出现了峰形宽化的衍射峰,这归因于PANI在ZnO表面聚合时,产生局部晶相微区,从而显示出一定程度的结晶度.[17]通过对比发现,CuW11Ni/PANI/ZnO的XRD谱图中,在2θ为11°,17°,29°和31°左右,出现具有典型Keggin结构杂多酸的特征衍射峰,说明复合后,对CuW11Ni的晶体结构未造成影响.因此可推断已成功合成CuW11Ni/PANI/ZnO复合材料.
2.1.3 UV-vis分析
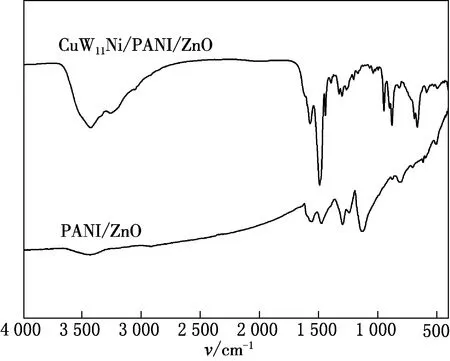
图1 CuW11Ni/PANI/ZnO和PANI/ZnO的FTIR谱
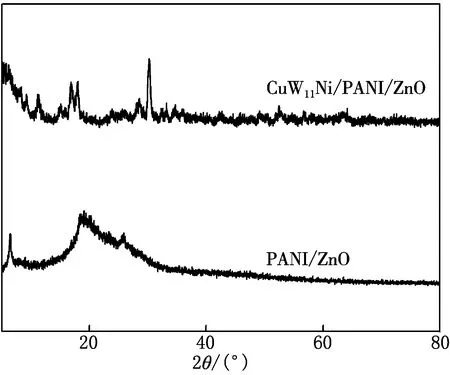
图2 CuW11Ni/PANI/ZnO和PANI/ZnO的XRD谱
2.1.4 N2BET分析
CuW11Ni/PANI/ZnO的N2BET表征结果见图4.由图4可见,CuW11Ni/PANI/ZnO的BET等温曲线未完全重合,形成环状回路的滞后环,属于物理吸附等温线分类中Ⅳ型吸附曲线,说明CuW11Ni/PANI/ZnO均为介孔结构.孔径集中在42.8 nm处,比表面积为44.68 m2/g,孔体积为0.11 cm3/g,进一步说明催化剂为介孔材料,增大比表面积 将有效提高CuW11Ni/PANI/ZnO的光催化活性.
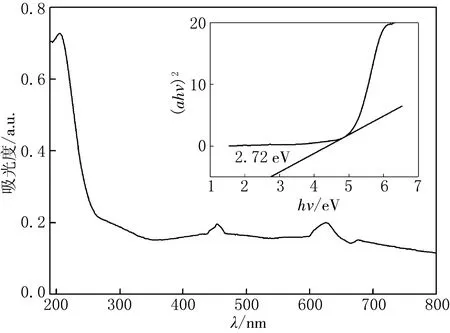
图3 CuW11Ni/PANI/ZnO的UV-vis及hν-(αhν)2曲线
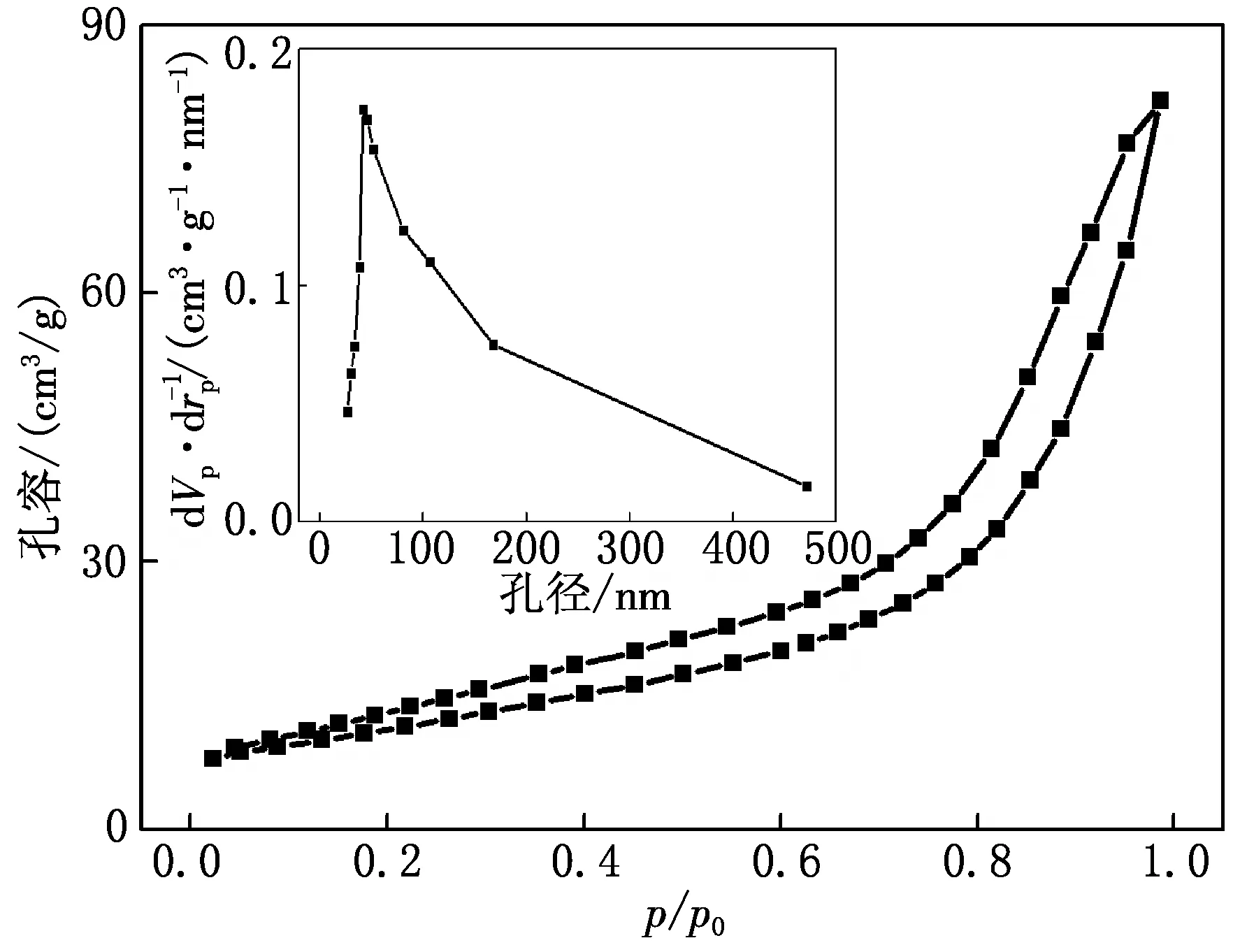
图4 CuW11Ni/PANI/ZnO的N2 BET分布曲线
2.1.5 SEM和EDS分析
CuW11Ni/PANI/ZnO的SEM和EDS表征结果见图5及表1.
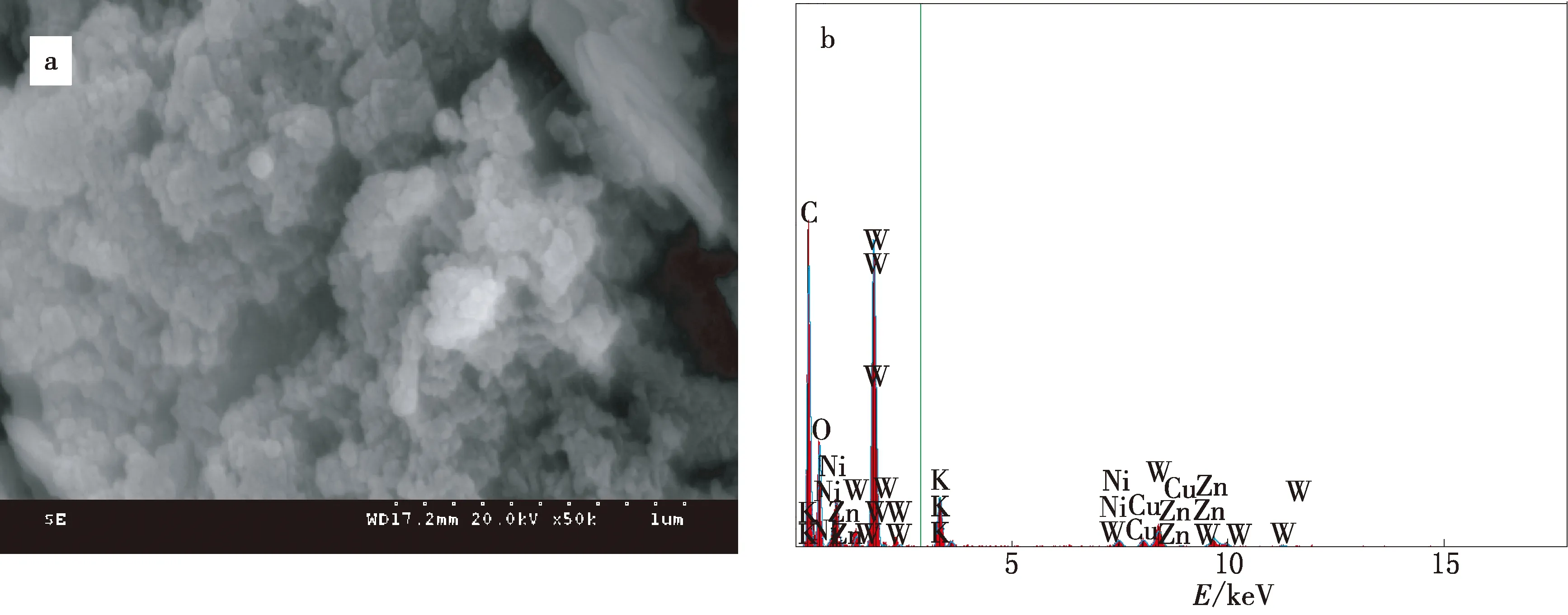
图5 CuW11Ni/PANI/ZnO的SEM照片(a)和EDS能谱(b)
表1CuW11Ni/PANI/ZnO中元素含量和峰强度
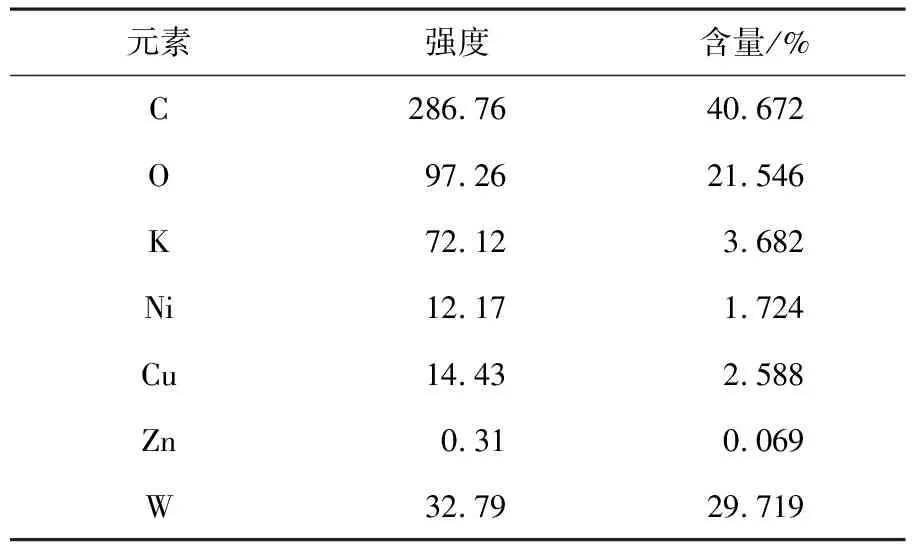
元素强度含量/%C286.7640.672O97.2621.546K72.123.682Ni12.171.724Cu14.432.588Zn0.310.069W32.7929.719
由图5a可见,CuW11Ni/PANI/ZnO复合材料表面是致密的纳米球状簇结构.CuW11Ni与PANI/ZnO复合后,能明显增大催化剂的比表面积,可在CuW11Ni/PANI/ZnO降解MG的过程中,提供更多的机会接触有机染料,更有效地发挥催化降解能力.利用EDS进一步分析了CuW11Ni/PANI/ZnO的化学元素组成,图5b及表1表明,复合材料由C,O,K,Ni,Cu,Zn和W组成,无其他杂质.另外,在能谱图低能区发现Zn的L峰,高能区发现其K峰,说明必定存在ZnO,而Zn的测试含量较低,可能是聚苯胺在ZnO表面充分包裹所致.由此说明CuW11Ni/PANI/ZnO复合材料已成功合成.
2.2 反应条件对降解率的影响
2.2.1 溶液初始pH对MG降解率的影响
用HCl或NaOH将MG溶液的初始pH值分别调节为2,3,4,5,6,MG的质量浓度为20 mg/L,CuW11Ni/PANI/ZnO用量为8 mg,做光催化实验,比较体系中MG的光降解情况,实验结果如图6所示.由图6可见,CuW11Ni/PANI/ZnO对MG的光催化降解率随着pH值的减小而逐渐增大,这是因为在光催化降解MG过程中,在酸性条件下,起降解作用的主要成分HO·更易于产生,CuW11Ni/PANI/ZnO的催化活性更好.当pH为2时,CuW11Ni/PANI/ZnO对MG的光催化降解率最高,100 min内可达97.1%.
2.2.2 染料初始浓度对MG降解率的影响
分别配制质量浓度为5,10,15,20,25 mg/L的MG溶液,pH调至2,CuW11Ni/PANI/ZnO用量为8 mg,做光催化实验,比较体系中MG的光降解情况,实验结果如图7所示.
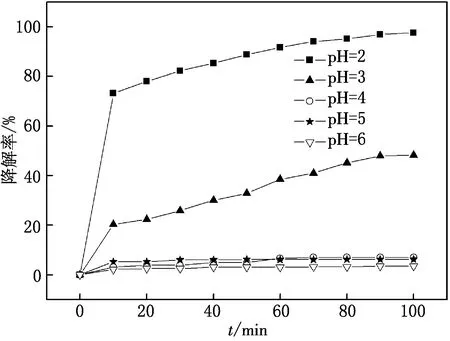
图6 溶液pH值对MG光催化降解的影响
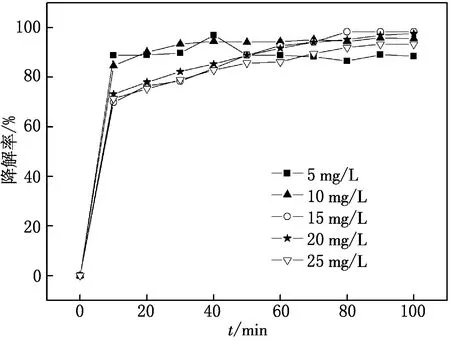
图7 染料初始浓度对MG光催化降解的影响
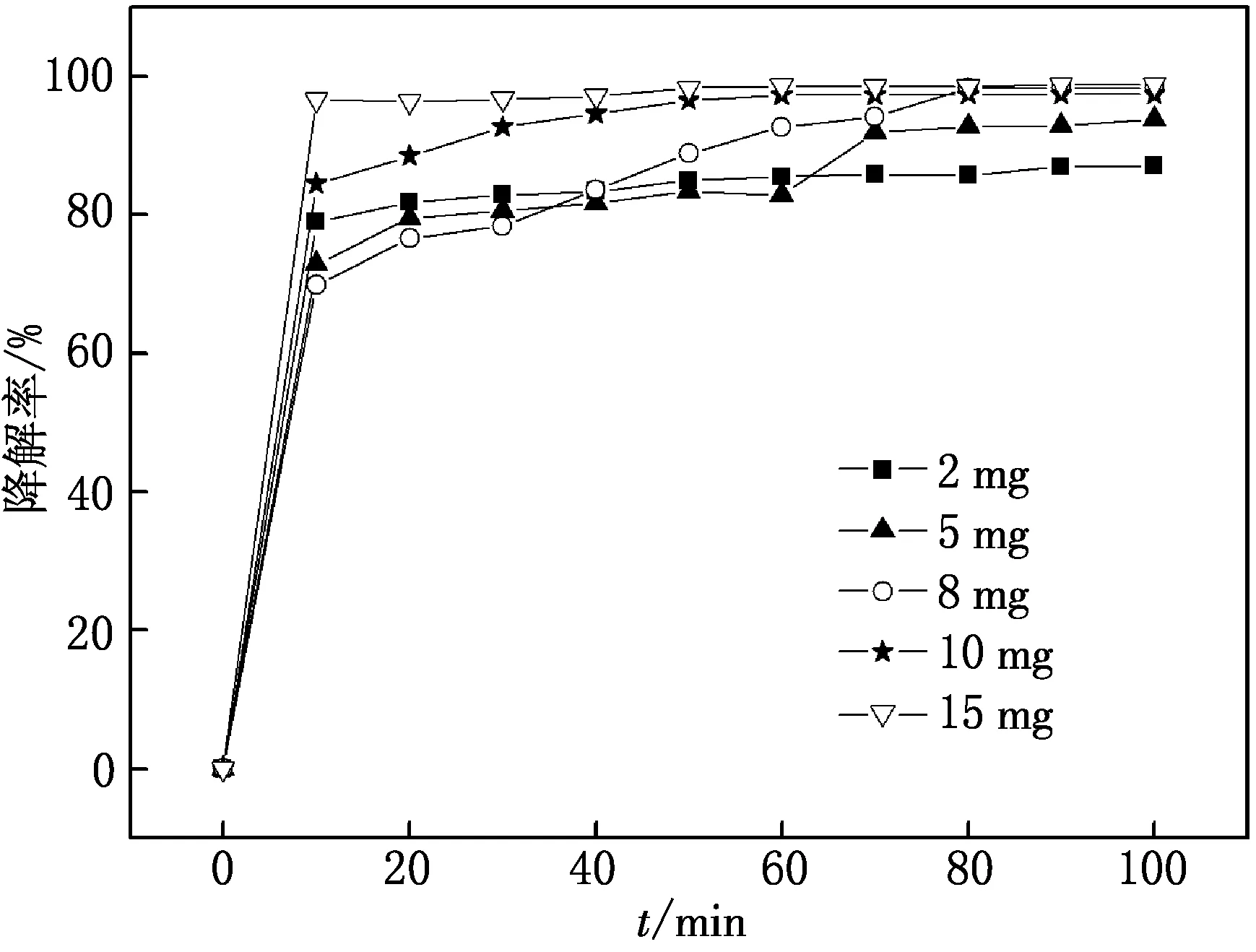
图8 CuW11Ni/PANI/ZnO用量对MG光催化降解率的影响
由图7可见,随着MG初始浓度的增加,CuW11Ni/PANI/ZnO对不同浓度MG的降解率呈“先增后减”的趋势.因为染料初始浓度的升高,影响了光透过率,从而影响了HO·的生成效率,导致CuW11Ni/PANI/ZnO的催化活性降低.当MG初始质量浓度为15 mg/L时,CuW11Ni/PANI/ZnO对MG的光催化降解率最高,100 min内可达98.3%.
2.2.3 催化剂用量对MG降解率的影响
分别加入CuW11Ni/PANI/ZnO质量为2,5,8,10,15 mg,pH调至2,MG的质量浓度为15 mg/L,做光催化实验,比较体系中MG的光降解情况,实验结果如图8所示.
由图8可见,在反应体系中,催化剂用量由2 mg增加至15 mg,CuW11Ni/PANI/ZnO对MG的降解率不断增加,这是因为增加的催化剂为光降解MG提供了更多的活性点位,能更有效地与染料反应.随着催化剂用量的增加,降解率增大趋势变缓,可能是因为催化剂量过多的情况下,降解产生的副产物也消耗HO·,从而对染料的光降解起到一定的抑制作用.当加入CuW11Ni/PANI/ZnO剂量为15 mg时,对MG的光催化降解率最高,100 min内可达98.8%.
2.2.4 不同催化剂的影响
MG的质量浓度为15 mg/L,pH调至2,加8 mg催化剂,比较ZnO,CuW11Ni,PANI/ZnO和CuW11Ni/PANI/ZnO对MG的光催化降解情况,实验结果如图9所示.
由图9可见,在相同反应条件下,降解率的顺序为CuW11Ni/PANI/ZnO > CuW11Ni > ZnO > PANI/ZnO.CuW11Ni与PANI和ZnO复合后,对MG的光催化降解率明显提高,这表明复合产物CuW11Ni/PANI/ZnO的光催化性能得到改善.
2.2.5 重复实验
为了考察CuW11Ni/PANI/ZnO复合材料的稳定性和重复使用性,对MG的光催化降解的重复实验结果如图10所示.
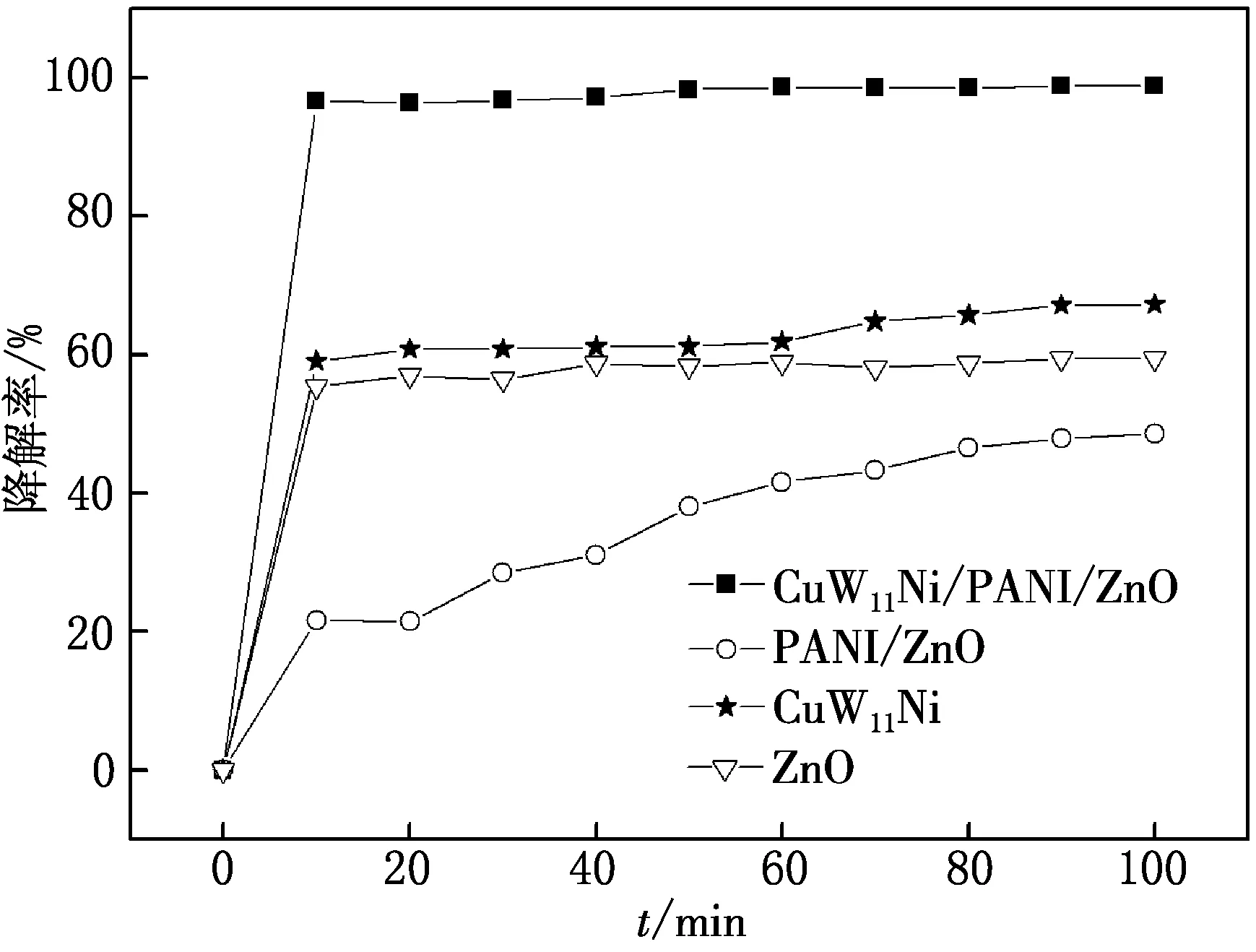
图9 不同催化剂对MG的光催化降解的影响
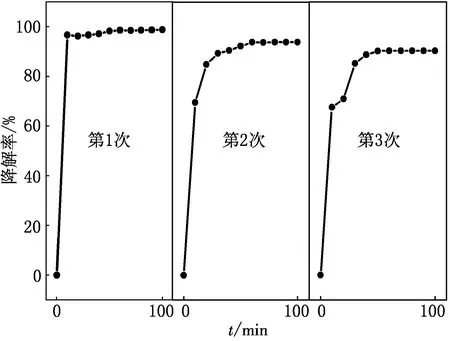
图10 CuW11Ni/PANI/ZnO重复光催化降解MG曲线
由图10可见,CuW11Ni/PANI/ZnO 3次重复使用,其对MG的光催化降解活性几乎没变化.重复使用过程中,催化活性略有降低,这是因为降解过程中有微量染料或副产物吸附在催化剂表面,未脱附,导致催化剂表面活性点位略有减少.经过3次重复使用,降解率仍在90%以上,表明CuW11Ni/PANI/ZnO具有良好的稳定性和重复使用性.
3 结论
通过静电自组装法制备CuW11Ni/PANI/Zn复合光催化剂.结果表明,CuW11Ni/PANI/ZnO成功合成,且Keggin结构未被破坏.在催化剂最佳活性条件下,生成大量HO·,对MG染料实现了高效的光催化降解,显示出优异的光催化性能,以及稳定性和重复使用性.说明CuW11Ni/PANI/ZnO复合材料在环境净化方面具有良好的应用前景.

