糖皮质激素性骨质疏松模型大鼠在性别上的差异性研究*
钟志勇 梁志健 刘月姝 李思婷 梁冠泽 谢超敏 唐小江
(广东省医学实验动物中心,佛山 528248)
骨质疏松是一种以骨量减少、骨纤维结构发生退行性病变为主要特征,可导致患者骨折风险增加的全身性骨骼系统疾病。目前骨质疏松患者已超过2亿,居世界常见疾病的第七位[1]。研发治疗骨质疏松新型、高效、价格低廉的药物首先是建立可靠的实验动物模型。目前,糖皮质激素性骨质疏松(glucocorticoid-induced osteoporosis,GIOP)模型多用于模拟临床上因使用糖皮质激素所导致的继发性骨质疏松的发生。对于GIOP模型,其发生的机理、常用的药物及其剂量等已有报道[2-5],但动物性别对GIOP模型的影响却鲜有研究。故本研究采用两种性别的SD大鼠分别给予地塞米松以制备GIOP模型,比较不同性别的GIOP大鼠模型的区别,完善GIOP模型的背景数据,为模型的应用提供资料参考。
1 材料与方法
1.1 主要药物及试剂
地塞米松磷酸钠注射液(广东三才石岐制药有限公司,批号 20140763);Rat 1,25-dihydroxyvitamin D3 ELISA Kit(武汉华美生物工程有限公司,批号:C1001070151);Rat Calcitonin ELISA Kit(武汉华美生物工程有限公司,批号:T02011771)。
1.2 主要实验仪器
7020型全自动生化分析仪,日本株式会社日立高新技术;Multiskan GO全波长酶标仪,美国Thermo Fisher Scientific;Unigamma M骨密度仪,意大利 l'acn;QX-W400型电子万能试验机,上海企想检测仪器有限公司;RM2235型轮转切片机,德国 LEICA©;TS-12C型生物组织全自动脱水机,湖北孝感医用仪器有限公司;EG1150型生物组织包埋机,德国LEICA©;CS-Ⅵ型摊片烤片机,湖北孝感医用仪器有限公司;BX43型生物显微镜,日本 OLYMPUS©;CellSens Standard显微图像软件,日本OLYMPUS©。
1.3 实验动物
SPF级SD大鼠24只,雌雄各半,由广东省医学实验动物中心提供,合格证明编号:44007200023787、44007200023788。动物饲养条件:6只/箱,群养,温度与湿度分别为 20~26℃、40%~70%,采用10 h:14 h昼夜间断照明,自由进食饮水,饲料和饮用水均由广东省医学实验动物中心提供,实验证明编号:00117781、00117782。
1.4 实验方法
SD大鼠常规饲养至3月龄后,随机分为正常对照组和骨质疏松组,12只/组,雌雄各半。骨质疏松组雌性大鼠和雄性大鼠在第1天~第21天按2.5 mg/kg体质量,第22天 ~第63天按1 mg/kg体质量肌肉注射地塞米松磷酸钠注射液,1次/2 d,持续9周。末次注射后1 h,大鼠腹腔注射戊巴比妥钠麻醉(剂量为45 mg/kg),腹主动脉取血,分离血清,-80℃保存。取双侧股骨和腰椎 L4,进行骨密度和生物力学检查;取胫骨,10%中性甲醛固定,进行病理组织学检查。
1.5 指标的检测
1.5.1 骨密度测定:取上述右侧股骨和腰椎L4置于Unigamma M骨密度仪,应用软件中的小动物对进行扫描,测定骨密度值(bone mineral density,BMD)。
1.5.2 骨生物力学测定:采用三点弯曲法,取上述冻存的左侧股骨,室温下复温,置于QX-W400型电子万能试验机,跨距为20.00 mm,加载速度为2.00 mm/min,下压于股骨中段,至股骨断裂。记录弹性载荷、最大载荷、弹性桡度,并用游标卡尺测量股骨断面的最大内、外径和最小内、外径。根据公式计算股骨的弯曲弹性模量、最大弯曲应力、最大应变、骨刚性系数。
截面惯性矩:J=π(BH3-bh3)/64;最大弯曲应力:σb=FmaxLH/8 J;最大应变 εb=12dmaxH/2L2:骨刚性系数:EJ=FpL3/48dp。(B为股骨测量横断面的最大外径,H为股骨测量横断面的最小外径,b为股骨测量横断面的最大内径,h为股骨测量横断面的最小内径、Fp为弹性载荷,L为跨距,J为截面惯性矩,dp为弹性桡度、Fmax为最大载荷,dmax为最大挠度)
1.5.3 血清生化指标测定:取上述血清,按照ELISA试剂盒说明书,测定其中维生素 D3、降钙素的含量;运用全自动生化仪测定其中 ALP、Ca、P的含量。
1.5.4 胫骨的病理检测:取上述浸泡于10%中性甲醛固定液中的胫骨,经脱钙、石蜡包埋、切片、HE染色等操作,然后观察骨皮质是否变薄,骨小梁是否减少、疏松、变细、断裂,成骨细胞是否减少、破骨细胞是否增多,并逐项进行评分,评分标准为:“0”分表示H.E染色结果基本正常;“1”分表示H.E染色结果偶见轻微病变;“2”分表示H.E染色结果轻度病变,范围≦1/4视野;“3”分表示H.E染色结果中度病变,范围≦1/2视野;“4”分表示H.E染色结果重度病变,病变范围≧3/4视野;如观察结果在“0~1”之间,则可记为“0.5”分,依次类推。计算每只动物胫骨各项病理变化的总积分。
1.6 统计分析
2 结果
2.1 体质量结果
与正常对照组比较,骨质疏松组动物体质量在第7天 ~第 63天降低,具有统计学意义(P<0.05)。
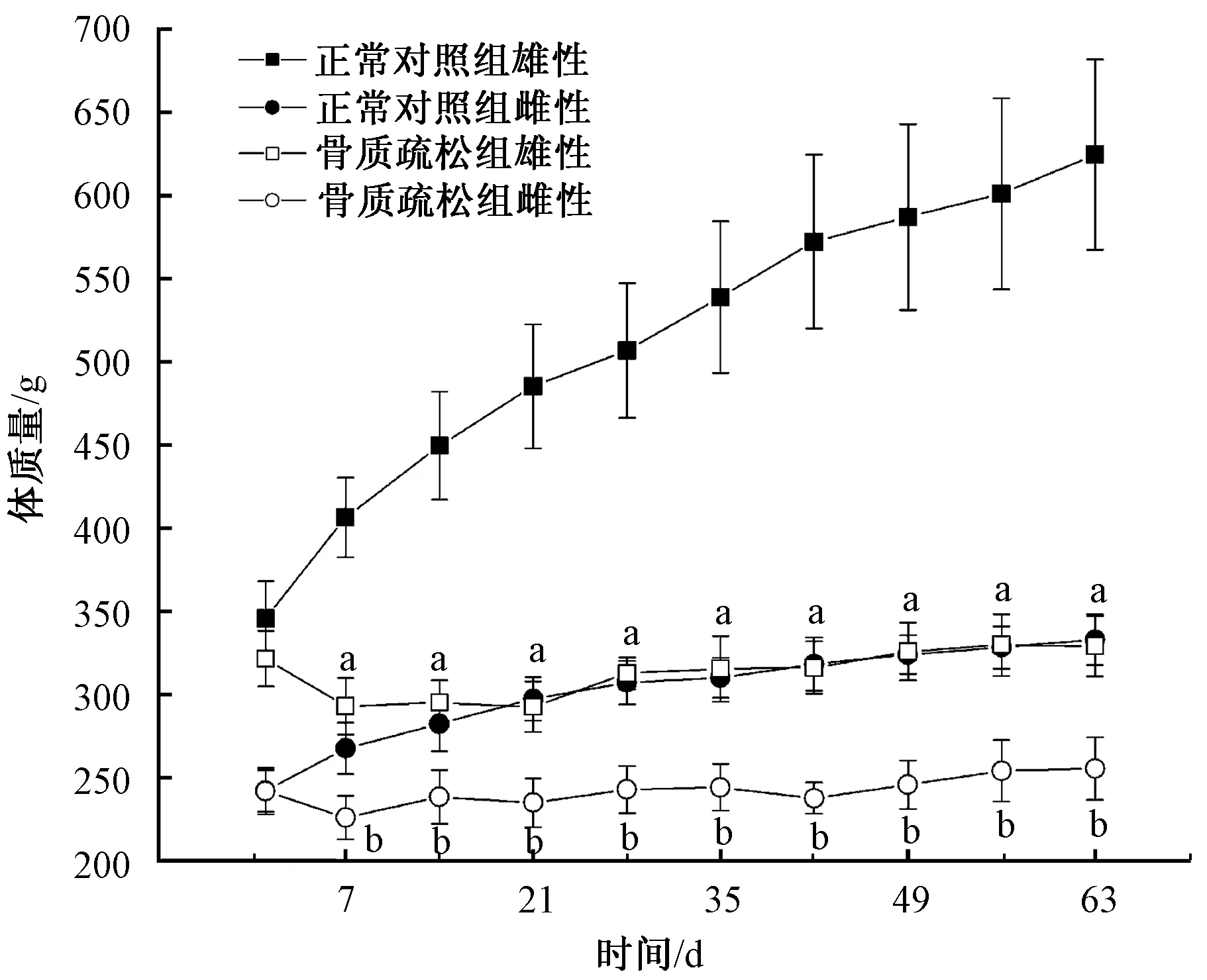
图1 动物体质量变化Fig.1 Anim al weight from d0 to d63
2.2 血清 ALP、Ca、P检测结果
与正常对照组比较,骨质疏松组动物ALP上升、雄鼠的Ca、P下降,差异具有统计学意义(P<0.05或0.01);其余指标无统计学意义(P>0.05),见表 1。
表1 性别对G IOP大鼠ALP、Ca、P的影响(±s±s,n=6)Table 1 Effect of Sex on ALP,Ca and P of G IOP rat( ±s ±s,n=6)

表1 性别对G IOP大鼠ALP、Ca、P的影响(±s±s,n=6)Table 1 Effect of Sex on ALP,Ca and P of G IOP rat( ±s ±s,n=6)
注:与正常对照组同性别比较,a P<0.05,aa P<0.01Note:Compare with same gender rats of normal control group,a P<0.05,aa P<0.01
组别 性别 ALP/(U/L)Ca/(mmol/L)P/(mmol/L)正常对照组2.41±0.05 2.16±0.47骨质疏松组♂ 142.2±19.3 2.44±0.04 2.42±0.50♀ 71.3±13.7 2.46±0.07 2.26±0.25♂ 170.7±23.3a 2.32±0.07aa 1.86±0.32a♀ 115.0±36.1a
2.3 血清降钙素、维生素D3检测结果
与正常对照组比较,骨质疏松组雄鼠的降钙素下降,差异具有统计学意义(P<0.01)。其余指标未见统计学差异,见表2。
2.4 股骨、椎骨BM D检测结果
第21天时,骨质疏松组动物的BMD高于正常对照组;第41天时,骨质疏松组动物BMD开始低于正常对照组。在结束实验第63天时,骨质疏松组动物的股骨BMD低于正常对照组,且骨质疏松组的雄鼠腰椎L4 BMD亦低于正常对照组,均具有统计学意义(P<0.05或 0.01),见表3。
表2 性别对GIOP大鼠降钙素、维生素D3的影响(±s±s,n=6)Tab le 2 Effect of Sex on calcitonin and vitam in D3 of GIOP rat(±s±s,n=6)

表2 性别对GIOP大鼠降钙素、维生素D3的影响(±s±s,n=6)Tab le 2 Effect of Sex on calcitonin and vitam in D3 of GIOP rat(±s±s,n=6)
组别 性别 降钙素/(fmol/L)维生素D3/(1 ×103 fmol/L)正常对照组 ♂ 4.63±1.55 62.3±28.5♀ 4.21±2.53 57.8±26.0♂ 2.01±0.61aa 48.5±19.6♀骨质疏松组3.58±1.73 39.5±17.6
表3 性别对G IOP大鼠股骨、腰椎L4 BM D的影响(±s ±s,n=6)Tab le 3 Effect of Sex on BM D of fem ur and L 4 of GIOP RAT(±s ±s,n=6)

表3 性别对G IOP大鼠股骨、腰椎L4 BM D的影响(±s ±s,n=6)Tab le 3 Effect of Sex on BM D of fem ur and L 4 of GIOP RAT(±s ±s,n=6)
注:与正常对照组同性别比较,a P<0.05,aa P<0.01Note:Compare with same gender rats of normal control group,a P<0.05,aa P<0.01
正常对照组骨质疏松组♂ 0.602±0.053 0.860±0.133♀ 0.536±0.035 0.659±0.068♂ 0.506±0.040a 0.705±0.051aa♀ 0.444±0.023a 0.597±0.037
2.5 弯曲弹性模量、最大弯曲应力、最大应变和最大负荷检测结果
与正常对照组比较,骨质疏松组雄鼠最大应变、最大负荷下降,具有统计学意义(P<0.05或0.01)。其余指标未见统计学意义(P>0.05),见表4。
表4 性别对G IOP大鼠骨生物力学指标的影响(±s±s)Table 4 Effect of Sex on biom echanical index of G IOP RAT( ±s ±s)

表4 性别对G IOP大鼠骨生物力学指标的影响(±s±s)Table 4 Effect of Sex on biom echanical index of G IOP RAT( ±s ±s)
注:与正常对照组同性别比较,a P<0.05,aa P<0.01Note: Compare with same gender rats of normal control group,a P<0.05, aa P<0.01
正常对照组130.0±34.9 0.13±0.02 9952±5503 177.3±26.5♀149.5±15.6 0.07±0.02 8655±3087 112.2±15.1♂骨质疏松组 ♂136.6±14.3 0.07±0.01 6923±3320 98.9±9.1 108.7±19.0 0.10±0.02a 7403±4365 110.6±18.8aa♀
2.6 胫骨病理组织学检测结果
正常对照组动物胫骨结构正常,骨皮质未见变薄,骨小梁致密,骨小梁周围可见成骨细胞、偶见破骨细胞,骨髓腔大小正常,骨骺可见大量透明软骨及少量骨化的软骨。骨质疏松组的雌雄动物均可见骨干变细、骨皮质变薄,骨髓腔面积缩小,骨小梁周围成骨细胞减少、破骨细胞增多,骨骺未见明显异常。且骨质疏松组动物胫骨各项病理评分和总积分均高于正常对照组,具有统计学意义(P<0.05)。此外,骨质疏松组雄性动物的骨小梁较该组雌性的减少、疏松和变细,该项评分和总积分也相应升高,具有统计学意义(P<0.05),见表 5、图 2。
表5 性别对G IOP大鼠胫骨组织各项病理评分和总积分的影响(±s±s)Tab le 5 Effect of Sex on tibia pathological score of of G IOP RAT( ±s ±s)

表5 性别对G IOP大鼠胫骨组织各项病理评分和总积分的影响(±s±s)Tab le 5 Effect of Sex on tibia pathological score of of G IOP RAT( ±s ±s)
正常对照组0.2±0.4 0.3±0.3 0.0±0.0 0.0±0.0 0.1±0.2♀0.2±0.4 0.1±0.2 0.3±0.4 0.0±0.0 0.3±0.3♂骨质疏松组2.8±0.4a 2.8±0.4ab 2.8±0.4ab 3.3±0.8ab 2.8±0.4a♀2.1±0.9a 2.0±0.5a 2.1±0.7a 2.3±0.5a 2.4±0.8♂a
表5(续) 性别对G IOP大鼠胫骨组织各项病理评分和总积分的影响(±s±s)Table 5(Con tinued) Effect of Sex on tibia pathological score of of G IOP RAT(±s ±s)
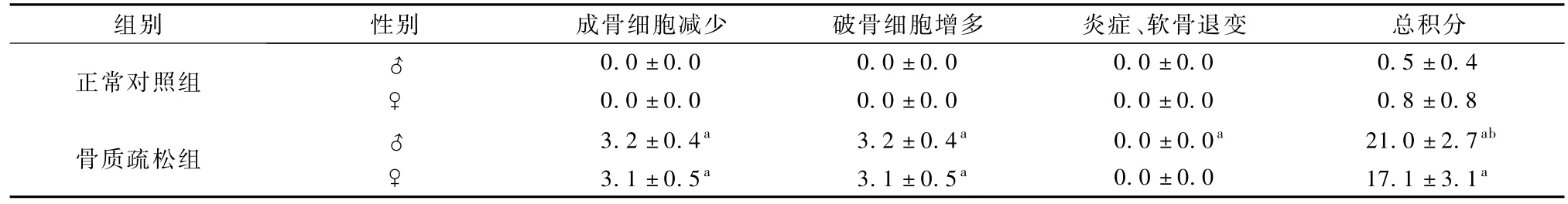
表5(续) 性别对G IOP大鼠胫骨组织各项病理评分和总积分的影响(±s±s)Table 5(Con tinued) Effect of Sex on tibia pathological score of of G IOP RAT(±s ±s)
注:与正常对照组同性别比较,a P<0.05;骨质疏松组雄性与雌性比较,b P<0.05Note: Compare with the same gender rat of normal control group, a P<0.05; compare with the female rat of osteoporosis group,b P<0.05
正常对照组0.0±0.0 0.0±0.0 0.0±0.0 0.5±0.4♀0.0±0.0 0.0±0.0 0.0±0.0 0.8±0.8♂骨质疏松组3.2±0.4a 3.2±0.4a 0.0±0.0a 21.0±2.7ab♀3.1±0.5a 3.1±0.5a 0.0±0.0 17.1±3.1♂a
3 讨论
骨质疏松可分为原发性、继发性和特发性,其中继发性骨质疏松是由于药物或疾病引起的,如过量地使用糖皮质激素。目前,糖皮质激素广泛应用于临床,致使糖皮质激素引起的继发性骨质疏松发病率增加。为了防治 GIOP、了解该病的发病机制,需建立可靠的GIOP动物模型并不断完善该模型的背景数据。
目前用于制备GIOP模型的动物种类并没有统一的规范,多见有啮齿类小动物(大、小鼠)和大动物(兔、狗、猪等)。虽然大动物具有哈弗氏系统,与人类的骨骼系统更为相似,但考虑到动物的易得性和使用的广泛性,故本实验采用SD大鼠作为研究对象。SD大鼠在6~8周龄达到性成熟,约在3月龄达到体成熟,此时骨骼系统发育完成,骨量也相对稳定,故采取3月龄大鼠[6]。目前关于动物的性别对GIOP模型的影响少有报道,选择何种性别以更好地制备GIOP模型成为开展研究首要解决的问题之一,而这正是本研究的目的。
在本实验条件下,雌、雄 SD大鼠注射大剂量地塞米松后均出现了GIOP的一系列症状。与正常对照组比较,骨质疏松组的雄性大鼠出现了股骨、腰椎L4骨密度下降,血清中的 ALP升高,钙、磷、降钙素下降,股骨的最大应变和最大负荷下降,胫骨组织病理评分升高,均有统计学差异(P<0.05);而雌性大鼠仅出现股骨骨密度下降,ALP升高,胫骨组织病理评分升高,具有统计学差异(P<0.05)。在胫骨骨组织病理检测中,骨质疏松组雄鼠骨小梁较该组雌性的减少、疏松和变细,该项评分和病理总积分也显著性地升高。故骨质疏松组中的雄鼠GIOP症状较雌鼠的明显。这可能与雌鼠中雌激素对骨代谢过程的保护作用有关。因为一方面雌激素可通过基因组或非基因组途径对骨形成起促进作用;另一方面,雌激素还可以抑制骨细胞的骨吸收作用[7-9]。有文献报道,雌鼠去势后体内缺乏雌激素,在糖皮质激素联合诱导下,可缩短骨质疏松的成模时间,且骨量丢失增大[10-11]。而雄激素在骨量丢失方面的作用尚未证实,也未见雄激素与糖皮质激素协同作用的报道。故在制备单纯的GIOP模型以研究糖皮质激素对骨骼系统的影响时,应考虑雌激素的影响。选择雄性大鼠较雌性大鼠理想,因为这可避免雌激素的干扰,使GIOP模型更为明显、稳定。

