6-溴-靛玉红-3′-肟抑制脂多糖诱导的小鼠乳腺上皮细胞凋亡
刘 畅,唐 鑫,张文劲,赵春阳,郭爱珍,2,胡长敏,2*
(1. 华中农业大学 动物医学院,武汉 430070; 2. 华中农业大学 农业微生物学国家重点实验室,武汉 430070)
奶牛乳腺炎严重危害养牛业,不仅制约养牛业发展,由治疗奶牛乳腺炎所导致的细菌耐药性增加及抗生素残留,给人类健康带来巨大威胁。乳腺炎是乳腺的一种炎症反应,多由病原微生物刺激乳腺细胞所致。乳腺上皮是乳腺的天然屏障,病原微生物或其分泌的毒素可损伤乳腺上皮并且引起上皮细胞的异常凋亡,使其屏障功能丧失,造成乳腺损伤。目前,大多数研究集中于抗奶牛乳腺炎药物的研究,但对抑制病原微生物刺激乳腺时所诱发的凋亡作用研究较少。
从青黛、大青叶等中药提取的主要有效成分——靛玉红(indirubin),具有良好的生物学活性,临床上主要用于治疗肿瘤[1]。研究发现靛玉红可以抑制乳腺炎过程中小鼠乳腺上皮细胞(MMECs)的凋亡作用,避免乳腺细胞产生过度的炎症[2]。6-溴-靛玉红-3′-肟(6-bromo-indirubin-3′-oxime, BIO或6BIO)是靛玉红的衍生物之一,解决了因靛玉红具有大π共轭体系平面刚性骨架所致的水溶性差的问题。BIO能特异性抑制糖原合成酶激酶-3(glycogen synthase kinase-3, GSK-3),激活Wnt信号通路[3]。Wnt信号不仅是胚胎发育过程的关键部分,而且在调节组织稳态中发挥重要作用[4]。
脂多糖(LPS)刺激Toll样受体4(TLR4)诱导关键促炎性细胞因子,对免疫调节必不可少,同时对细胞凋亡有促进作用[5]。本研究通过LPS刺激MMECs构建凋亡模型,BIO干预后检测相关凋亡因子及凋亡通路的变化,旨在阐明BIO对LPS诱导的MMECs凋亡反应的作用及机制。
1 材料与方法
1.1 实验动物
妊娠15~20 d昆明鼠购自长江大学试验动物中心,所有操作遵循动物福利。
1.2 试剂
BIO(HPLC≥98%)购自上海源叶生物科技有限公司;LPS、人表皮生长因子(hEGF)、胰岛素、转铁蛋白是Sigma公司产品;胎牛血清(FBS)、0.25%胰蛋白酶-EDTA、青链霉素双抗购自Gibco公司;DMEM/F12 于Hyclone公司购买;胶原酶Ⅰ、Ⅱ(Collagenase Ⅰ、Ⅱ)购自Solarbio公司;Trizol购自Life公司;BCA试剂盒购自碧云天公司;MTT试剂盒(A312-01/02)、Hiscript®II RT Super Mix for PCR(R212-01)、AceQ qPCR SYBR Green Master Mix(Q111-02)和Annexin V-FITC Apoptosis Detection Kit(A211-01/02)购自南京诺唯赞生物科技有限公司;Caspase-3、Caspase-8、Bcl-2一抗购自英国Abcam公司;β-actin一抗购自中国博士德生物公司;羊抗兔、羊抗鼠二抗购自Southern-Biotech公司;ECL发光液购自Thermo公司。15、50 mL离心管,T175细胞瓶,6、12、96孔细胞培养板购自LabServ公司;40和70 μm细胞滤器产自FALCON公司;美国ABI荧光定量PCR仪专用96、384孔板购自Life公司。
1.3 试验仪器
全温震荡培养箱(HZQ-F160)为太仓市试验设备厂生产;高速冷冻离心机(CT15RE)为Hitachi公司产品;细胞培养箱(HPG-280BX(HX)/400BX(HX))、超净工作台(DL-CJ-2NDI)为哈东联公司产品;流式细胞仪(BD_FACSCalibur)购自美国BD公司;涡旋振荡器(vortex-genie2)产自美国Scientific Industries公司;实时荧光定量PCR仪(VII7)产自美国ABI公司,化学发光仪(ImageQuant LAS 500)购自GE公司。
1.4 MMECs提取
断颈处死妊娠15~20 d的昆明鼠后,将其全身浸泡于75%酒精中1 min,超净台中采集小鼠第4、5对乳腺,称重;提前配制含2%双抗的PBS,预冷,将所得乳腺放于提前灭菌的250 mL烧杯中,用PBS清洗干净后将乳腺组织剪碎至糊状,每克乳腺加入胰蛋白酶-EDTA 4 mL、胶原酶Ⅰ、Ⅱ各4 mL加入烧杯中混合均匀后转入灭菌锥形瓶中,密封,37 ℃、110 r·min-1消化至无组织块,将消化后的匀浆液转入50 mL无菌离心管中25 ℃、250 g·min-1离心5 min。收集细胞沉淀用含10%FBS的DMEM/F12重悬,悬液用70 μm细胞筛过滤,收集滤液,去除未消化组织块。收集滤液,再次离心后取沉淀,加入适当胰蛋白酶-EDTA重悬,消化2 min,加入含10% FBS的DMEM/F12终止反应。相同条件离心,清洗细胞,彻底终止胰酶作用,反复离心3次,用40 μm细胞筛过滤后离心取细胞沉淀,用适量细胞生长液重悬细胞,加入细胞瓶中,放于37 ℃含5% CO2培养箱中,1 h后将细胞悬液吸出转入新的培养瓶中放于37 ℃、5% CO2培养箱中差速贴壁去除成纤维细胞,1 h后再将细胞悬液吸出加入细胞板中培养。
1.5 MTT试验
每孔104个细胞接种到96孔板,5% CO2,37 ℃培养过夜。设置无细胞对照孔、有细胞对照组(有细胞但不加药)、终浓度为1 μg·mL-1的LPS组,0.1%的DMSO组,5、25、50 nmol·L-1BIO处理组以及BIO(5、25、50 nmol·L-1)+LPS共刺激组,每组设置5个重复孔。5% CO2,37 ℃培养24 h,各孔加入10 μL MTT,4 h吸出上清,PBS小心润洗2~3遍,各孔加入150 μL DMSO,10 min后于490 nm和570 nm波长测定各孔OD值。细胞活力计算公式如下:
细胞活力 =(加药组细胞OD值-无细胞组OD值)/(对照组细胞OD值-无细胞组OD值),试验重复3次。
1.6 分组及处理
本试验设置空白对照组、DMSO组、BIO组、LPS组和BIO+LPS处理组。1)空白对照组:正常培养组;2)DMSO组:使用终浓度为0.1% DMSO刺激组(因DMSO为BIO的溶剂,为排除DMSO对MMECs存在影响的可能性,本试验设立DMSO组);3)BIO组:使用浓度为50 nmol·L-1的BIO刺激细胞;4)LPS组:使用终浓度为1 μg·mL-1的LPS刺激细胞;5)BIO+LPS处理组:使用BIO浓度为5、25、50 nmol·L-1预处理细胞,1 h后使用终浓度为1 μg·mL-1的LPS刺激细胞。
所有细胞均在细胞汇合度为80% 时开始处理,处理细胞24 h后进行后续试验,每组设置3个复孔,试验重复3次。
1.7 流式细胞术
刺激细胞完成后弃去培养基,用PBS清洗细胞。用不含EDTA的胰酶消化3 min,用含有10%FBS的DMEM/F12终止消化作用,收集细胞悬液后300 g 4 ℃离心5 min,PBS清洗3次后,用100 μL Binding Buffer重悬细胞。分别加入5 μL FITC、PI染料后混匀,室温避光静置10 min。最后加入400 μL Binding Buffer混匀后上机检测。
1.8 qRT-PCR
收集细胞,提取mRNA,反转录得到cDNA。以β-actin作为内参基因,检测凋亡相关基因的表达情况(引物见表1)。反应采用10 μL体系:AceQ®qPCR SYBR®Green Master Mix 5 μL;上下游引物各0.2 μL; cDNA 5倍稀释后加1.5 μL;ddH2O 3.1 μL。程序:95 ℃ 5 min,95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,进行40个循环。qRT-PCR的结果采用2-△△Ct法处理。
表1qRT-PCR相关引物序列表
Table1SequenceofprimersusedinqRT-PCR

基因Gene引物序列(5′→3′)Primers sequence(5′→3′)BaxF:TGCAGAGGATGATTGCTGACR:GATCAGCTCGGGCACTTTAGBakF:AGGTGACAAGTGACGGTGGTR:AAGATGCTGTTGGGTTCCAGBcl-xlF:GCTGGGACACTTTTGTGGATR:TGTCTGGTCACTTCCGACTGBcl-2F:ATGCCTTTGTGGAACTATATGGCR:GGTATGCACCCAGAGTGATGCCaspase-3F:TGTCATCTCGCTCTGGTACGR:AAATGACCCCTTCATCACCACaspase-8F:CCGAGAGGAGATGGTGAGAGR:TCGGTAGGAAACGCAGTTCTβ-actinF:TGCTGTCCCTGTATGCCTCTR:GGTCTTTACGGATGTCAACG
1.9 Western blot
收集刺激后细胞,每孔加预冷的PBS清洗 3遍;每孔加入适量预冷RIPA裂解液吹打裂解后将裂解液转移预冷的1.5 mL EP管中,冰上裂解1 h;4 ℃,12 000 g离心10 min,取上清转入新的1.5 mL EP管中;吸取20 μL上清用BCA试剂盒测蛋白浓度(严格按照说明书进行操作),其余上清中加入2×上样缓冲液,沸水煮10 min。
每孔上样20 μg进行SDS-PAGE电泳,蛋白湿转法转PVDF膜,BSA(5%)室温封闭2~3 h,一抗(Caspase-3和Bcl-2以1∶2 000稀释,Caspase-8以1∶1 000,β-actin以1∶500稀释)4 ℃孵育过夜;羊抗兔二抗和羊抗鼠二抗(1∶5 000)37 ℃孵育2 h, ECL发光检测。
1.10 数据分析
凋亡细胞百分比用FlowJo 7.6软件分析,Western blot灰度分析用Image J软件分析,统计学分析使用Prism 7.0软件进行分析,*为P<0.05;**为P<0.01;***为P<0.001。
2 结 果
2.1 BIO对MMECs生长活性的影响
基于本实验室前期对BIO细胞毒性的研究(数据未发表),选择BIO浓度为5、25、50 nmol·L-1进行其抗凋亡作用的评价。MTT法检测结果如图1,结果显示DMSO组MMECs的细胞活力略有升高,但与对照组相比,无统计学差异;LPS组MMECs的细胞活力略有下降,但与对照组无统计学差异,该结果提示DMSO与LPS对MMECs的生长无影响。单独使用BIO刺激及使用BIO与LPS共同刺激对细胞生长并无抑制作用,各个组细胞活力均在93%以上,且各组间无统计学差异,表明LPS和BIO对细胞生长无影响,后续试验结果不受细胞活性变化的影响。

CON.空白对照组;DMSO.DMSO处理组;LPS.LPS处理组,作用终浓度为1 μg·mL-1;5、25、50为BIO作用浓度,单位nmol·L-1;“5+LPS”、“25+LPS”、“50+LPS”为相应浓度的BIO与LPS联合使用CON.Blank control group;DMSO.DMOS treatment group;LPS.LPS treatment group,the final concentration was 1 μg·mL-1;5,25,and 50 were the concentrations of BIO (nmol·L-1);“5+LPS”,“25+LPS”, and “50+LPS” indicated the combined application of BIO (with corresponding concentration) and LPS图1 LPS及BIO对小鼠乳腺上皮细胞活力的影响Fig.1 Effect of LPS and BIO on MMECs viability
2.2 BIO抑制LPS诱导的MMECs的凋亡
选用流式细胞术研究不同浓度BIO对MMECs凋亡作用的影响。结果如图2所示,CON组凋亡细胞百分比为10.65%±0.41%,DMSO组凋亡细胞百分比为11.16%±0.31%,与CON组无明显差异,表明DMSO作为BIO的溶剂,低浓度时对MMECs凋亡无影响。BIO处理组凋亡细胞百分比为11.07%±0.63%,较对照组无明显差异,该结果提示BIO单独作用于MMECs时对细胞的凋亡无影响。LPS组凋亡细胞百分比(20.35%±0.34%)相较于CON组(10.65%±0.41%)升高近2倍,表明LPS可促进MMECs的凋亡,BIO+LPS组中,随BIO浓度的增加,细胞凋亡百分比逐渐减少(19.32%±0.25%、14.93%±0.64%、10.74%±0.51%),结果显示BIO以剂量依赖的方式抑制LPS诱发的细胞凋亡,且浓度为50 nmol·L-1时效果最好。
该结果提示BIO能够下调LPS诱导的MMECs的凋亡,但BIO单独作用时对MMECs的凋亡无影响,后续不再设置BIO单独刺激组作为对照。
2.3 BIO下调LPS诱导的Bak、Bax、Caspase-3及Caspase-8 mRNA相对转录量,上调Bcl-2、Bcl-xl mRNA相对转录量
为研究BIO抑制MMECs凋亡的分子机制,笔者首先检测了Bak、Bax转录水平的变化。如图3A所示,两个对照组(空白对照组和DMSO处理组)中BakmRNA表达无差异,LPS组相较于空白对照组表达量升高,但无统计学差异;5、25、50 nmol·L-1的BIO处理组相较于LPS组BakmRNA表达水平均极显著下降(P<0.001),各个浓度之间无显著差异;如图3B所示,对照组与DMSO组中的Bax表达量一致,LPS组表达量相较于对照组极显著升高(P<0.001),BIO处理组的BaxmRNA相对表达量较LPS组极显著下降(P<0.001),随药物作用浓度的升高BaxmRNA表达量稍有下降,但各个BIO处理组之间无差异,表明BIO可抑制LPS诱导的Bak与BaxmRNA的表达。

CON.空白对照组;DMSO. DMSO处理组;BIO. BIO单独处理组;LPS. LPS处理组;5~50为BIO预处理组,浓度分别为5、25、50 nmol·L-1;ns. P>0.05;*. P<0.05;**. P<0.01;***. P <0.001CON. Blank control group; DMSO. DMSO treatment group; BIO. BIO alone treatment group; LPS. LPS treatment group, and 5-50 is BIO pretreatment group, and the concentrations are 5, 25, 50 nmol·L-1, respectively. ns. P>0.05;*. P<0.05;**. P<0.01;***. P <0.001图2 BIO对MMECs凋亡率的影响Fig.2 Effect of BIO on apoptosis rate by flow cytometry
由于Bcl-2与Bcl-xl可抑制Bak与Bax活性,因此笔者检测了Bcl-2、Bcl-xl的转录情况。如图3C所示,空白对照组、DMSO组、LPS组的Bcl-xlmRNA相对转录量无显著差异,各个浓度BIO处理组对Bcl-xlmRNA相对转录量均具有上调作用,5 nmol·L-1即可促进Bcl-xlmRNA转录量的升高,但无统计学差异,25和50 nmol·L-1BIO对Bcl-xlmRNA转录量上调作用极显著(P<0.01)。图3D为Bcl-2 mRNA相对转录量变化的结果,空白对照组和DMSO组中,Bcl-2 mRNA相对转录量一致,LPS组Bcl-2 mRNA相对转录量相较对照组极显著下调(P<0.01),处理组中随着BIO浓度的增加Bcl-2 mRNA相对转录量逐渐升高,呈剂量依赖性,50 nmol·L-1组效果最好。
如图3 E 和 F 所示,Caspase-3与Caspase-8 mRNA转录趋势一致,DMSO与对照组相比mRNA相对转录量稍有升高,但没有统计学差异;LPS组的转录量较对照组极显著升高(P<0.001或P<0.01),BIO处理组的基因相对转录量相较LPS组均极显著降低(P<0.001)。
2.4 BIO抑制LPS诱导的Caspase-3及Caspase-8蛋白表达,促进Bcl-2蛋白表达
为更深入地研究凋亡相关因子的表达,笔者检测了其蛋白表达。结果(图4)显示,Bcl-2蛋白在对照组、DMSO组中表达量极低,LPS组的蛋白表达量较对照组显著下降(P<0.05),表明LPS可以抑制Bcl-2蛋白的表达,BIO处理组中,随浓度的增加Bcl-2蛋白的表达量也不断增加,呈现明显的剂量依赖性,50 nmol·L-1BIO对Bcl-2蛋白的上调作用最显著,与LPS组相较差异极显著(P<0.001)。上述结果表明BIO上调小鼠乳腺上皮细胞中Bcl-2的表达,进而发挥抑制凋亡的作用。
Caspase-3与Caspase-8蛋白表达检测结果与其mRNA表达检测结果一致,对照组与DMSO组相比,Caspase-3、Caspase-8蛋白表达水平一致,无统计学差异,LPS组Caspase-3和Caspase-8的蛋白表达量升高,处理组相较于LPS组蛋白表达量显著降低,50 nmol·L-1的BIO对Caspase-3和Caspase-8蛋白表达的抑制效果最显著,并呈现显著的剂量依赖性。
3 讨 论
治疗乳腺炎的过程中,除消除不良因素对乳腺的影响、抗菌消炎、提高免疫力外,还应保护组织完整性,加速乳腺组织恢复[6],因此治疗乳腺炎的药物能否减少细胞的异常凋亡至关重要。细胞凋亡,是细胞自主进行的程序性死亡。调控凋亡的信号通路复杂,包括细胞内的线粒体通路、内质网通路和细胞外的死亡受体通路等3条主要调控通路[7]。

A~F分别为Bak、Bax、Bcl-xl、Bcl-2、Caspase-3及Caspase-8转录水平变化;CON.空白对照组;DMSO. DMSO处理组;LPS. LPS处理组,作用终浓度为1 μg·mL-1, 5、25、50为BIO (nmol·L-1)作用浓度;*. P<0.05;**. P<0.01;***. P <0.001A-F show changes in the gene levels of Bak, Bax, Bcl-xl, Bcl-2, Caspase-3, and Caspase-8, respectively; CON. Blank control group; DMSO. DMSO treatment group; LPS. LPS treatment group, the final concentration was 1 μg·mL-1, and 5, 25, and 50 were the concentrations of BIO (nmol·L-1);*. P<0.05;**. P<0.01;***. P<0.001图3 BIO对凋亡相关蛋白转录水平影响Fig.3 Effect of BIO on apoptosis-related protein mRNA levels
本研究表明,BIO能够降低LPS诱导的MMECs凋亡。本试验中选用1 μg·mL-1的LPS刺激细胞构建MMECs凋亡模型,流式细胞术结果显示LPS刺激细胞后细胞的凋亡率(20.35%±0.34%)是空白对照组(10.65%±0.41%)的2倍,表明LPS成功诱导细胞凋亡。BIO提前孵育MMECs则可以降低LPS诱导的细胞凋亡,并且随着BIO浓度的增加MMECs的凋亡细胞百分比呈现梯度下降,50 nmol·L-1的浓度对细胞凋亡作用的抑制效果最显著,凋亡细胞百分比(10.74%±0.51%)与对照组(10.65%±0.41%)几乎一样。但并非所有中药或中药提取物都对凋亡有抑制作用,部分则有促进细胞凋亡的作用,如温莪术有效成分β-榄香烯加速HeLa细胞(人宫颈癌细胞)的凋亡,该作用的发挥可能依赖于下调Bcl-2基因表达[8]。本研究表明BIO能够抑制MMECs的凋亡,但对于其他细胞(如癌细胞)凋亡作用的影响尚不清楚。
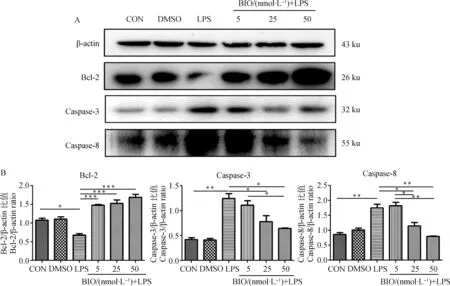
A. Western blot结果;B.相应图片灰度分析;CON.空白对照组;DMSO. DMSO处理组;LPS. LPS处理组,作用终浓度为1 μg·mL-1, 5、25、50为BIO (nmol·L-1)作用浓度;*. P<0.05;**. P<0.01;***. P<0.001A. Western blot results; B. Grayscale analysis; CON. Blank control group; DMSO. DMSO treatment group; LPS. LPS treatment group, the final concentration was 1 μg·mL-1, and 5, 25, and 50 were the concentrations of BIO (nmol·L-1);*. P<0.05;**. P<0.01;***. P <0.001图4 BIO对凋亡相关蛋白表达的影响Fig.4 Effect of BIO on expression of apoptosis-related proteins
在大多数细胞凋亡信号释放之后,促凋亡的Bax和Bak被激活并寡聚于线粒体外膜中,引发线粒体通透改变,释放可溶性致凋亡因子(例如参与Caspase活化的细胞色素C)到细胞质中[9]。由于其抗体购买困难,笔者主要进行了相关因子转录水平的研究。结果显示,LPS对Bax与BakmRNA的上调作用被BIO阻断,各个浓度的BIO对Bax与Bak表达均表现出良好的抑制作用,但无浓度间差异。这表明BIO能够抑制LPS诱导的Bax、Bak活化。
随后笔者研究了Bax与Bak的调控分子Bcl-2、Bcl-xl的变化。Bcl-2家族蛋白成员含有一个或多个Bcl-2同源结构域,该蛋白家族由抗凋亡成员和促凋亡成员组成。发挥抑制凋亡作用的主要为Bcl-2、Bcl-xl、Bcl-w、Mcl-1等,主要通过抑制Bax、Bak的活化来发挥功能[10]。本结果显示LPS能抑制Bcl-2 mRNA和Bcl-2蛋白表达,相较于对照组均差异极显著,LPS对Bcl-xl的表达无明显影响,而BIO与处理组Bcl-2、Bcl-xl的表达上调,且呈现一定的剂量依赖性。该结果提示BIO可能在一定程度上通过上调Bcl-2和Bcl-xl表达而抑制LPS诱导的MMECs凋亡,但BIO是否能够通过上调Bcl-2和Bcl-xl的表达而下调Bax与Bak的表达仍有待验证。
最后检测了Caspase-3与Caspase-8的活性变化。Caspase-3与Caspase-8是凋亡刺激信号传递汇聚的关键节点,Caspase-8主要受外源信号的Fas通路调控,Caspase-8被激活后促进下游Caspase的级联反应[11]。Caspase-3在凋亡通路的下游,受多种因素如细胞色素C的调控,对启动凋亡极为重要[12]。本研究发现LPS能够促进Caspase-3与Caspase-8转录和表达,具有良好的促凋亡作用,而BIO则能够抑制LPS诱导的Caspase-3与Caspase-8的表达,且各组之间没有明显的剂量依赖性,该结果提示BIO能在一定程度上或至少部分抑制了Caspase-3与Caspase-8的活性,进而抑制LPS诱导的MMECs凋亡。
BIO具体的作用靶点尚不清楚,可通过siRNA干扰相应可能的作用靶点或利用抗体封闭的方法找出BIO具体的作用靶点,这为BIO后续的研究提供了方向。
4 结 论
BIO可抑制LPS诱导的MMECs凋亡,该作用可能是依靠Bcl-2家族的Bax、Bak、Bcl-2、Bcl-xl及Caspase家族Caspase-3和Caspase-8而实现的(图5)。

LPS.脂多糖;BIO. 6-溴-靛玉红-3′-肟; Mitochondria. 线粒体;FADD.Fas相关死亡域蛋白;Apoptosis. 凋亡LPS. Lipopolysaccharide; BIO. 6-bromo-indirubin-3′-oxime; FADD. Fas-associating protein with a novel death domain图5 BIO抑制LPS诱导的小鼠乳腺上皮细胞凋亡示意Fig.5 Schematic of BIO inhibits LPS-induced mouse mammary epithelial cell apoptosis

