同时检测禽类六种病毒的金标银染可视化基因芯片的构建及初步应用
向 华,杨国淋,曹三杰,黄小波,伍 锐,赵 勤,文心田,文翼平
(四川农业大学动物医学院,成都 611130)
随着我国家禽养殖业集约化和规模程度的提高,家禽呼吸和免疫抑制类疾病的发病率逐渐上升。禽流感病毒(avian influenza virus,AIV)、新城疫病毒(Newcastle disease virus,NDV)、鸡传染性喉气管炎病毒(infectious laryngotracheitis virus,ILTV)是引发家禽呼吸道疾病的重要病毒性病原。传染性法氏囊病毒(infectious bursal disease virus, IBDV)、鸡马立克病病毒(Marek’s disease virus,MDV)、禽白血病病毒(avian leukosis virus,ALV)是引发家禽免疫抑制病的主要病毒性病原,临床症状相似,难以鉴别诊断,并表现出从单一的病原感染向多种病原混合感染方向发展的趋势。如J亚群ALV的env基因的可变区不断地发生变化,导致该病毒的抗原性不断地进化和改变[1-2]。2013年,新的AIV亚型H7N9被发现[3-4]。新出现的毒株,给家禽业造成了巨大的经济损失,也严重威胁着人类的健康。
基因芯片是继PCR后发展起来的一项具有快速、特异性好、敏感性强及高通量等优点的自动化基因检测技术,已被广泛地应用于药物开发、基因突变、基因表达等方面[5]。目前基因芯片在禽类病毒检测方面的应用大多是基于荧光扫描的基因芯片技术或酶与底物可视化显色技术[3, 6-9]。然而荧光扫描比较昂贵,酶和底物显色所使用的尼龙膜或者纤维素性薄膜芯片不易保存,这极大地限制了芯片诊断在临床诊断中的应用。近年来,关于金标银染可视化显色技术与基因芯片相结合的文献报道呈递增趋势[10-11],因其检测结果可脱离昂贵的传统荧光扫描仪,且操作简单,高灵敏性等特点,已广泛地应用于基因突变分析、疾病诊断、药物筛选等方面[12-14],因此越来越广泛地被人们用于疾病的检测[2]。
考虑到家禽疫病防控急需,且目前尚未见ALV、MDV、IBDV、NDV、AIV和ILTV六种病毒金标银染可视化基因芯片的报道。因此,本研究以ALV、MDV、IBDV、NDV、AIV以及ILTV为研究对象,通过金标银染显色,构建了一套能够同时检测这六种禽类病毒的可视化基因芯片检测技术,为家禽呼吸道和免疫抑制病的临床标准化诊断应用奠定基础,从而保障我国养禽业的健康发展。
1 材料与方法
1.1 生物材料
靶基因重组质粒T/AIV-np、T/DNV-f、T/ILTV-tk、λ定位基因重组质粒,大肠杆菌DH5α由四川农业大学猪病研究中心构建并保存。MDV和IBDV组织液由四川农业大学动物医学院黄勇教授提供。ALV的DNA核酸由山东农业大学崔治中教授提供。临床病料采自四川安岳、大邑、彭州、蒲江等地区疑似禽白血病、马立克病、鸡传染性法氏囊病、禽流感、新城疫和鸡传染性喉气管炎患病鸡的喉气管、肺、脾、肝、肾及法氏囊组织。
1.2 主要试剂
总RNA提取试剂盒、DNA提取试剂盒、普通DNA胶回收试剂盒购自天根生化科技(北京)有限公司;PrimeScript RT Reagent Kit购自宝生物工程(大连)有限公司;质粒提取试剂盒购自美国Omega公司;晶芯芯片点样液、晶芯光学级醛基基片、晶芯12样品芯片围栏购自北京博奥生物有限公司;金标链霉亲和素Nanogold-Streptavidin购自美国Nanoprobes公司;银染试剂Silver buffer A、Silver buffer B购自美国Sigma公司;封闭液按照0.5% BH4Na,25% Ethanol,0.75×PBS比例配制。
1.3 主要仪器
晶芯®SmartArrayerTM16,微阵列芯片点样系统Capitalbio Corporation购自北京博奥生物公司;分子杂交仪购自美国Thermo公司;芯片杂交盒及杂交相关产品购自北京Capitalbio生物有限公司;高纯氮气瓶购自四川冠峰气体有限公司。
1.4 ALV-env、MDV-meq、IBDV-vp2基因的克隆鉴定
λ定位基因的引物参考曹三杰[15]设计合成。利用DNAStar软件的Megalign对NCBI收录的ALV、MDV、IBDV毒株的基因序列进行比对分析,以Primer5.0设计3对引物(ALV的env基因,MDV的meq基因,IBDV的vp2基因),靶基因扩增长度在200~800 bp之间,Tm为(55±5) ℃,引物由北京擎科新业生物技术有限公司合成(表1),用生物素对靶基因下游引物的5′端进行修饰。
提取IBDV毒株的总RNA,并将其反转录为cDNA,提取ALV、MDV的DNA,以cDNA/DNA为模板扩增目的基因,1%琼脂糖凝胶电泳进行检测,切胶回收产物连接pMD19-T Simple载体,并转化DH5α感受态细胞,提取质粒后阳性的重组质粒送上海生物工程有限公司测序后保存备用。取ALV-env、MDV-meq、IBDV-vp2、AIV-np、NDV-f、ILTV-tk和λ菌落分别进行菌液PCR,用生物素对靶基因下游引物的5′端进行修饰。
表1病毒靶基因引物
Table1Primersfortargetgenesofvariousvirus

靶基因Target gene长度/bpLength引物序列(5′→3′)Primer sequencesALV-env312F: GGATGAGGTGACTAAGAAAGR: GGGAGGTGGCTGACTGTGTMDV-meq512F: CAGGGAGCAGACGGACTAR: GAGGGCAGAAGAGGGAATIBDV-vp2743F: GGCCCAGAGTCTACACCATAACR: CCGGATTATGTCTTTGAAGCCAIV-np272F:CCAGAAGCGGAGGAAACAR:GTCAAAGGAAGGCACGATNDV-f440F:CAAGAACCCAGCACCTATGATGR:GTCGGAGGATGTTGGCAGCILTV-tk278F:TCCTCGTAGATAGGCACCCACTCR:TACGTTGGAGGTAGGTGGTAGTATTCAλ500F:AAAGCGACGCAATGAGGCACTR:GTTCCACGACCGCAACTGC
F.上游引物;R.下游引物
F. Forward primer; R. Reverse primer
1.5 探针设计与芯片制备
针对每个靶基因序列片段,各选取一条单链核酸序列作为寡核苷酸探针,确保各探针的Tm值为75 ℃±5 ℃,长度为45 bp左右,并在每条寡核苷酸探针的5′端添加15个T碱基作为连接臂,同时进行氨基化修饰。探针由上海生物工程有限公司合成(表2)。
将点样缓冲液和ddH2O按1∶4的比例混匀,用以稀释合成的寡核苷酸探针,调整其终浓度为50 μmol·L-1, 按照设计好的检测阵列排布进行非接触喷样方式喷样(图1)。喷样结束后,紫外交联5 min,芯片置于湿盒内,37 ℃水合过夜。随后,在37 ℃条件下,封闭液封闭30 min。取出芯片,超纯水清洗5次。自然干燥,置于4 ℃保存备用。
表2探针信息
Table2Informationofprobes

靶基因Target gene长度/bp Length引物序列(5′→3′)Primer sequencesALV-env312P:NH2-T15-GGATTTCTGCCTCTCTACACAGTCAGCCACCTMDV-meq512P:NH2-T15-ATGGAGTTTGTCTACATAGTCCGTCTGCIBDV-vp2743P:NH2-T15-TGAACTAGCAAAGAACCTGGTCACAGAATACGGCAIV-np272P:NH2-T15-CAAGCCAAACAAAATGCTGCCAACATCCTCNDV-f440P:NH2-T15-CCCTCTGTTGGTTGGTGTTTCCTCCGCTTCTILTV-tk278P:NH2-T15-CTGCCTCATGAATACTACCACCTACCTCCAACGλ500P:NH2-T15-GATTTGGAGGGCAGTTGCGGTCGTG

图1 基因芯片矩阵设计图Fig.1 The design of DNA chip
1.6 可视化基因芯片的检测
用生物素标记的引物分别扩增ALV-env、MDV-meq、IBDV-vp2、NDV-f、AIV-np和ILTV-tk六种靶基因,并将其PCR产物等量混匀,于100 ℃水浴变性5 min,立即冰浴3 min,防止DNA双链复性。随后将PCR产物混合液加入含围栏固定的芯片阵列区域,40 ℃条件下杂交120 min,杂交结束后,超纯水洗净后自然干燥。将质量浓度为4 μg·mL-1的Nanogold-Streptavidin的链霉亲和素溶液缓慢加入到芯片对应的阵列区域,37 ℃孵育30 min。超纯水洗净后自然干燥。避光条件下,将银染试剂中的Silver buffer A和Silver buffer B等体积混匀,取200 μL混合液加入芯片阵列区域,观察并记录芯片上可视化信号出现的时间。当可视化芯片阳性对照相应位置出现明显的杂交信号,而阴性对照相应位置无明显的杂交信号时,清洗芯片,终止显色。眼观可视化芯片结果,在芯片相应位置若出现明显黑色银染信号,即判定为杂交阳性,反之则判定为杂交阴性。
1.7 可视化基因芯片的质量评价
1.7.1 特异性试验 ALV-env、MDV-meq、IBDV-vp2、AIV-np、NDV-f和ILTV-tk的单链靶基因,单独与芯片进行杂交显色,眼观杂交结果。
1.7.2 敏感性试验 使用ddH2O将提取的靶基因质粒(初始质量浓度为1 ng·μL-1)依次进行101~105倍稀释,PCR扩增标记,扩增产物混匀后与芯片进行杂交显色,眼观杂交结果。
1.7.3 稳定性试验 将同一批生产的芯片,分别放置在常温和4 ℃条件下密封保存。分别在30、60、75、90 d随机抽出一张芯片,按照“1.6”步骤,与生物素标记的靶基因进行杂交,银染显色眼观结果,以评价芯片的稳定性。
以上特异性、敏感性及稳定性试验均重复三次。
1.8 临床样品的初步验证
将收集的51份疑似患禽免疫抑制性和呼吸道疾病的青脚麻鸡、白羽肉鸡和乌鸡的喉气管、肺、肾、脾、肝、法氏囊组织,混合研磨匀浆后,灭菌的PBS匀浆稀释,-70 ℃条件下反复冻融三次,4 ℃,12 000 r·min-1离心10 min,取上清500 μL进行RNA和DNA的提取。提取的RNA反转录为cDNA。分别用临床样品的PCR技术和基因芯片同时进行检测,对比两者检测结果。
2 结 果
2.1 靶基因的扩增、克隆及重组质粒菌复苏鉴定
成功扩增ALV-env、MDV-meq及IBDV-vp2靶基因片段,测序结果显示,与NCBI中收录的同一病毒的不同毒株靶基因序列具有99%以上的相似性(表3)。对ALV-env、MDV-meq、IBDV-vp2、AIV-np、NDV-f、ILTV-tk进行菌液PCR扩增结果显示(图2),PCR扩增的目的片段与预期大小一致。
表3ALV-env、MDV-meq及IBDV-vp2靶基因的鉴定结果
Table3Identificationresultsoftargetgenes(ALV,MDVandIBDV)

靶基因Target gene长度/bp Length位置/nt Location相似性/% Identity参考株收录号Accession No.ALV-env312423—73499KF612340.1312359—67099JF913206.1MDV-meq512225—73699KT229640.1512225—73699HF546097.1IBDV-vp27431—71799JQ353503.1743605—1 34799KT381974.1

M. 相对分子质量标准(2 000 bp DNA ladder); 1. λ定位基因; 2. ALV-env;3. MDV-meq;4. IBDV-vp2;5. NDV-f;6. ILTV-tk;7. AIV-np;8.阴性对照M. Relative molecular mass (2 000 bp DNA ladder); 1. λ; 2. ALV-env; 3. MDV-meq; 4. IBDV-vp2; 5. NDV-f; 6. ILTV-tk; 7. AIV-np; 8. Negative control图2 靶基因鉴定结果Fig.2 The identification results of target gene
2.2 基因芯片制备的初检
2.2.1 阳性定位基因的检测 以λDNA定位基因为模板进行靶基因扩增标记,将λDNA扩增产物与含6种病毒探针的芯片进行杂交,银染显色,肉眼观察试验结果。结果显示阳性质控λDNA定位基因杂交斑点明显可见,阴性对照和其他探针斑点没有可见杂交斑点(图3)。表明本研究制备的醛基基片及阳性定位基因质量可靠。
2.2.2 共检芯片全基因的检测 6种病毒6个探针基因的全部探针位点均可以看到明显的杂交斑点,阳性对照斑点明显,阴性对照没有可见杂交斑点,表明制备的可视化共检芯片、选用探针基因质量可靠(图4)。

图3 定位基因的测定Fig.3 The result of located gene hybridization

图4 全探针的测定Fig.4 Hybridization scanning of all probes
2.3 可视化基因芯片的质量评价
2.3.1 特异性试验评价 ALV-env、MDV-meq、IBDV-vp2、AIV-np、NDV-f和ILTV-tk单独与可视化芯片杂交时只在芯片的相应位置出现了肉眼可见的杂交斑点,且各个探针之间无非特异性杂交的情况。使用IBV-n基因扩增产物与可视化芯片杂交后,芯片的相应位置无肉眼可见杂交信号斑点,杂交结果呈阴性(图5)。说明本试验构建的基因芯片具有高的特异性。
2.3.2 敏感性试验评价 当模板浓度为1 ng·μL-1、100 pg·μL-1、10 pg·μL-1时,在芯片相应位置能够看见明显的杂交信号;当模板浓度为1 pg·μL-1后,随着模板浓度降低,部分靶基因的杂交信号不断减弱。当模板浓度为100 fg·μL-1,肉眼无法观察到杂交信号(图6)。说明该检测芯片的最低检测浓度是1 pg·μL-1。
2.3.3 稳定性试验评价 在60 d内,常温和4 ℃ 条件下保存的芯片对杂交信号没有明显影响,检测信号点明显。随着芯片保存时间的延长,常温条件下的芯片在75 d时,杂交信号斑点变得模糊,个别靶基因信号点消失。而4 ℃条件下的芯片在90 d时,杂交信号斑点出现模糊,个别靶基因信号点消失(图7、8)。说明本研究建立的可视化芯片4 ℃ 条件下可保存75 d,常温条件下保存60 d。
2.4 可视化基因芯片的临床样品检测
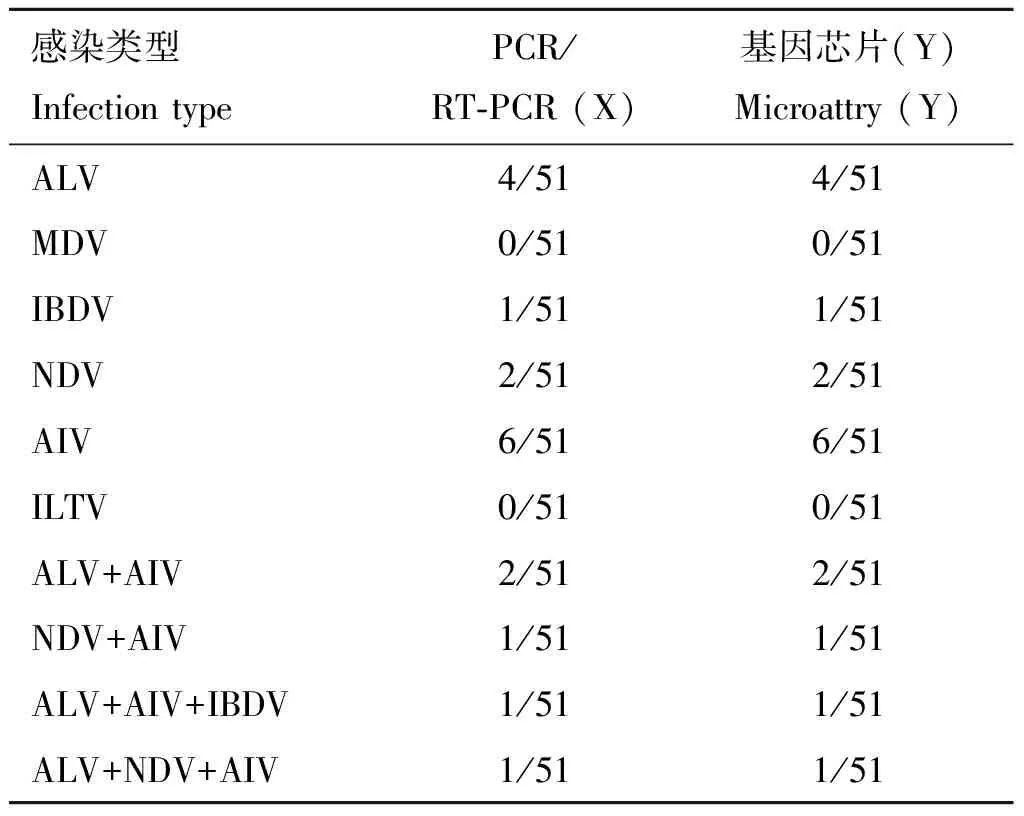
将处理好的临床样品分别进行PCR/RT-PCR和基因芯片检测,结果显示,ALV、MDV、IBDV、NDV、AIV和ILTV的检出率分别为7.8%、0%、2.0%、3.9%、11.8%、0%。其中混合感染ALV和AIV为3.9%,NDV和AIV为2.0%,ALV、AIV和IBDV为2.0%,ALV、NDV和AIV为2.0%。结果显示,此六种病毒在四川地区的禽类中AIV单独感染率较高,未检测到MDV和ILTV感染的现象。与PCR检测技术相比较,两者检测结果一致(表4)。

图5 可视化基因芯片特异性试验结果Fig.5 The specificity test of the visual chip
3 讨 论
基因芯片因具有高通量、特异性好、敏感性强和可机械化操作等优势,被广泛地应用于基因研究、药物分析和疾病诊断中。本研究的创新点为,在传统的基因芯片基础上,以ALV、MDV、IBDV、NDV、AIV及ILTV为研究对象,引入链霉亲和素标记的纳米金显色技术,构建一套能同时检测这六种禽类病毒的可视化基因芯片。通过优化基因芯片的检测过程条件,建立标准化的可视化基因芯片检测技术,并对其进行质量评价和临床初步应用评价,从而为促进国内家禽产业的发展提供技术支撑。
靶基因的选择是芯片技术对病原微生物进行快速、准确诊断的前提。ALV的env基因与病毒的抗原性、组织亲嗜性以及毒力密切相关,是ALV致肿瘤高度保守的关键基因[16]。meq基因为MDV所特有保守的基因,与致瘤作用密切相关[17]。vp2是IBDV的宿主保护性抗原基因[18]。NDV的f基因是构成NDV致病性的主要成分[19]。AIV的NP蛋白结构高度保守,是细胞毒性淋巴细胞识别的主要抗原[7, 9, 20]。tk基因具有高度的保守性,被广泛地用于ILTV中核酸探针的标记基因[21]。在本研究中,根据GenBank数据库,对编码env(ALV)、meq(MDV)及vp2(IBDV)蛋白的保守序列设计引物,将所有克隆的靶基因片段,软件DNAStar、BLAST比对分析后,与NCBI上的参考株可达99%以上的相似性,为下一步试验提供可靠性。

A. 1 ng·μL-1;B. 100 pg·μL-1;C. 10 pg·μL-1;D. 1 pg·μL-1; E. 100 fg·μL-1图6 可视化基因芯片敏感性试验结果Fig.6 The sensitivity results of visual chip

图7 可视化基因芯片稳定性试验结果(常温下)Fig.7 The retention period of visual chip(room temperature)

图8 可视化基因芯片稳定性试验结果(4 ℃)Fig.8 The retention period of visual chip(4 ℃)
51份病料样品中,AIV被检出的感染率最高,达到11.8%。研究表明,疾病的感染与所处的季节息息相关,如9月,在所检测的38份病料中,发现有11份病料同时感染NDV和AIV,而在同年的11月,在所检测的32份病料中未检测到NDV和AIV共感染现象,因此推测两种病毒混合感染现象与病料的收集时间有关[22]。在本文的51份病料样品内,其中AIV和NDV被检出同时感染的现象为2.0%,正恰好51份样品大部分在秋冬采集,这可能与疾病的流行季节有关。检测结果进一步显示,ALV、MDV、IBDV、NDV、AIV和ILTV的检出率分别为7.8%、0%、2.0%、3.9%、11.8%、0%。其中混合感染ALV和AIV为3.9%,NDV和AIV为2.0%,ALV、AIV和IBDV为2.0%,ALV、NDV和AIV为2.0%。这与常见文献报道AIV、NDV和ALV存在混合感染现象相一致[23-24]。而在51份 样品中未发现有四重或者五、六重感染情况,这可能与所采病料季节和地域有关。
表451份样品的检测结果
Table4Thedetectionresultsof51samples
感染类型Infection typePCR/RT-PCR (X)基因芯片(Y)Microattry (Y)ALV4/514/51MDV0/510/51IBDV1/511/51NDV2/512/51AIV6/516/51ILTV0/510/51ALV+AIV2/512/51NDV+AIV1/511/51ALV+AIV+IBDV1/511/51ALV+NDV+AIV1/511/51
数据以“阳性数/样品数”的形式给出
The data are given in the form of “positive number / sample number”
在本试验中引入λDNA作为定位基因,来保证芯片制作过程的正确性。同时在前期方法建立的过程中,通过PCR方法扩增目的基因,在构建质粒后测序验证目的基因的正确性,结果表明该PCR方法可用于目的基因的扩增。而在临床病料检测过程中,所使用的病料DNA提取方法和PCR过程均与前期方法完全一致,从而保证了临床检测PCR过程的正确性。然而,笔者也意识到使用GAPDH、β-actin等内参基因能够避免临床检测PCR假阴性出现的优势[25]。在后续的试验过程中笔者会利用内参基因对本方法进行改进。
4 结 论
构建了同时检测ALV、MDV、IBDV、NDV、AIV和ILTV的金标银染可视化基因芯片,其病原检出率和PCR技术的检出率保持一致,能有效、快速、特异地同时区别禽类的六种病毒,并应用于临床检测。这为基因芯片检测在家禽疫病防控中的应用奠定了基础。

