脑多头蚴重组蛋白rTm16和rTm-GST的免疫保护效果分析
郭 承,万 洁,杨应东,文建国,刘俞辰,古小彬,谢 跃,杨光友*
(1. 四川农业大学 动物医学院,成都 611130; 2. 攀枝花市农林科学研究院,攀枝花 617061)
脑多头蚴(Coenuruscerebralis)是多头带绦虫(Taeniamulticeps)的中绦期幼虫,常寄生于山羊、绵羊、牛等偶蹄类草食动物的脑和脊髓等中枢神经系统以及皮下、肌间等部位[1-2]。脑多头蚴病主要引起宿主脑及中枢神经系统的功能障碍[3]。该病常见于非洲、东南亚等经济欠发达的发展中国家,给草食动物养殖业带来巨大的经济损失[4-5]。在我国,以西北、华北、东北等广大牧区及南方农牧区最为多见[6]。此外,人也可偶然感染该病,在欧洲、非洲、巴西、以色列和美国等国家和地区已有相关报道[7-9]。脑包虫病的治疗通常包括药物治疗和手术治疗,发病后期用药物治疗常效果不佳,而手术治疗成本较高[6]。因此,开发新的防控技术对进一步搞好牛、羊脑多头蚴病的防控具有十分重要的意义。
近年来,多头带绦虫抗原基因的研究更多集中在诊断抗原的筛选上[2, 10-14],而对于疫苗候选抗原的研究却十分有限[15-21]。本试验通过原核表达多头带绦虫的Tm16基因和Tm-GST基因,用获得的重组Tm16蛋白和重组Tm-GST蛋白对山羊进行免疫,评价其免疫保护效果,旨在为牛、羊脑多头蚴病疫苗的研制奠定基础。
1 材料与方法
1.1 试验动物
44只3~4月龄攀枝花本地黑山羊(雌、雄各半),由攀枝花农林科学研究院提供。试验前1个月全部羊免疫小反刍兽疫苗,使用伊维菌素和丙硫咪唑进行试验前驱虫处理。
1.2 主要试剂和仪器
1.2.1 试验菌株EscherichiacoliBL21-pET32a(+)-rTm16[22]和BL21-pET32a(+)-rTm-GST[2]由四川农业大学动物寄生虫病研究中心提供。
1.2.2 主要试剂 蛋白Marker购自Fermentas公司;HRP标记兔抗山羊IgG购自武汉博士德公司;IPTG、Quil A(皂素)购自Sigma公司;Bio-Scale Mini Profinity Ni-charged IMAC预装柱购自Bio-Rad公司;96孔酶标板购自Corning公司;麦芽糖购自成都市科龙化工试剂厂;BCA试剂盒购自上海贝博生物公司。
1.2.3 主要仪器 NGCTM10中高压层析系统(Bio-Rad USA);LyoQuest冷冻干燥机(Telstar Spain)。
1.3 rTm16与rTm-GST蛋白的表达与纯化
取E.coliBL21-pET32a(+)-rTm16/BL21-pET32a(+)-rTm-GST表达菌株分别接种到含50 μg·mL-1Amp的LB培养液中,37 ℃培养6 h直至菌液OD值达到0.6,再加入1 mmol·L-1IPTG诱导表达6 h。随后使用NGCTM10中高压层析系统(Bio-Rad,USA)对所表达的重组蛋白进行纯化,将收集得到的蛋白进行超滤,并用SDS-PAGE鉴定。使用BCA试剂盒进行蛋白浓度测定。
1.4 重组蛋白的保存
参照Gauci等[17]的方法,将纯化后的重组蛋白混以皂素Quil A(Superfos, Denmark),使用麦芽糖作为冻干保护剂进行冻干保存。
1.5 动物免疫试验及免疫评价
1.5.1 试验分组 试验分组见表1。
表1试验动物分组
Table1Groupsofexperimentanimals
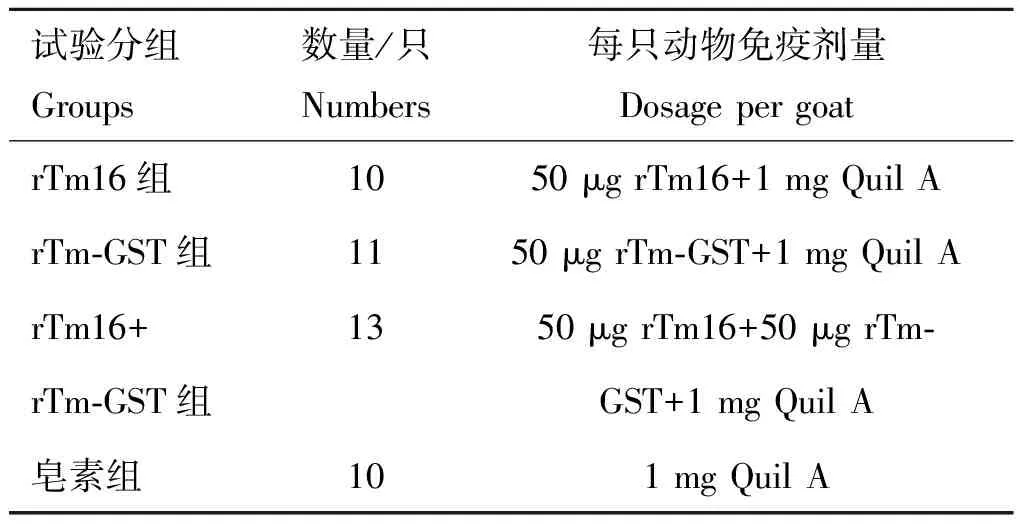
试验分组Groups数量/只Numbers每只动物免疫剂量Dosage per goatrTm16组1050 μg rTm16+1 mg Quil ArTm-GST组1150 μg rTm-GST+1 mg Quil ArTm16+1350 μg rTm16+50 μg rTm-rTm-GST组GST+1 mg Quil A皂素组101 mg Quil A
1.5.2 疫苗稀释 使用无菌生理盐水稀释rTm16/rTm-GST/rTm16+rTm-GST疫苗以及皂素,稀释后单疫苗组蛋白质量浓度为25 μg·mL-1,联合免疫组蛋白质量浓度为50 μg·mL-1,注射剂量为2 mL·只-1。
1.5.3 免疫程序 采用颈部皮下注射。借鉴绵羊包虫病Eg95基因工程疫苗免疫程序,稍作调整,首免后1个月进行二次免疫,首免后7个月进行第三次免疫[23]。
1.5.4 采血 免疫前、后定期对各组山羊进行颈部静脉采血,分离血清后保存于-20 ℃冰箱。
1.5.5 人工感染 第三次免疫2周后,全部试验山羊按照约5 500 枚·只-1的量,口服攻击多头带绦虫活虫卵(虫卵由四川农业大学动物寄生虫病研究中心提供)。
1.5.6 剖检计数 人工感染105 d(约3.5月),试验组山羊全部进行剖检,记录每只山羊脑部、肌间组织内脑多头蚴包囊的数量和大小。
1.5.7 血清抗体的间接ELISA检测 采用间接ELISA方法,使用rTm16、 rTm-GST分别作为检测抗原对各免疫组山羊血清进行特异性IgG抗体检测(联合免疫组使用rTm16和rTm-GST分别进行检测)。
1.5.8 数据分析 根据免疫组山羊与对照组山羊荷囊差异,统计出减囊率。公式如下:

应用The Mann-Whitney U test进行各疫苗组相对于对照组的保护效果评价[17]。同时使用SPSS 20.0对各试验组感染脑多头蚴包囊数量、各组特异性抗体OD450 nm值进行统计分析。
2 结 果
2. 1 重组蛋白疫苗的制备和纯化
E.coliBL21-pET32a(+)-rTm16和E.coliBL21-pET32a(+)-rTm-GST经1 mmol·L-1IPTG在37 ℃诱导6 h后,分别得到约30和41 ku的可溶性蛋白,并且蛋白稳定(注:pET32a(+)的His标签约18 ku),表明成功表达出重组rTm16蛋白和重组rTm-GST蛋白。对所表达的重组蛋白通过Ni-NTA亲和层析柱纯化,结果显示条带单一,纯度较好,见图1。
对rTm16蛋白、rTm-GST蛋白以及rTm16+rTm-GST蛋白进行冻干处理,结果获得淡黄色固体。
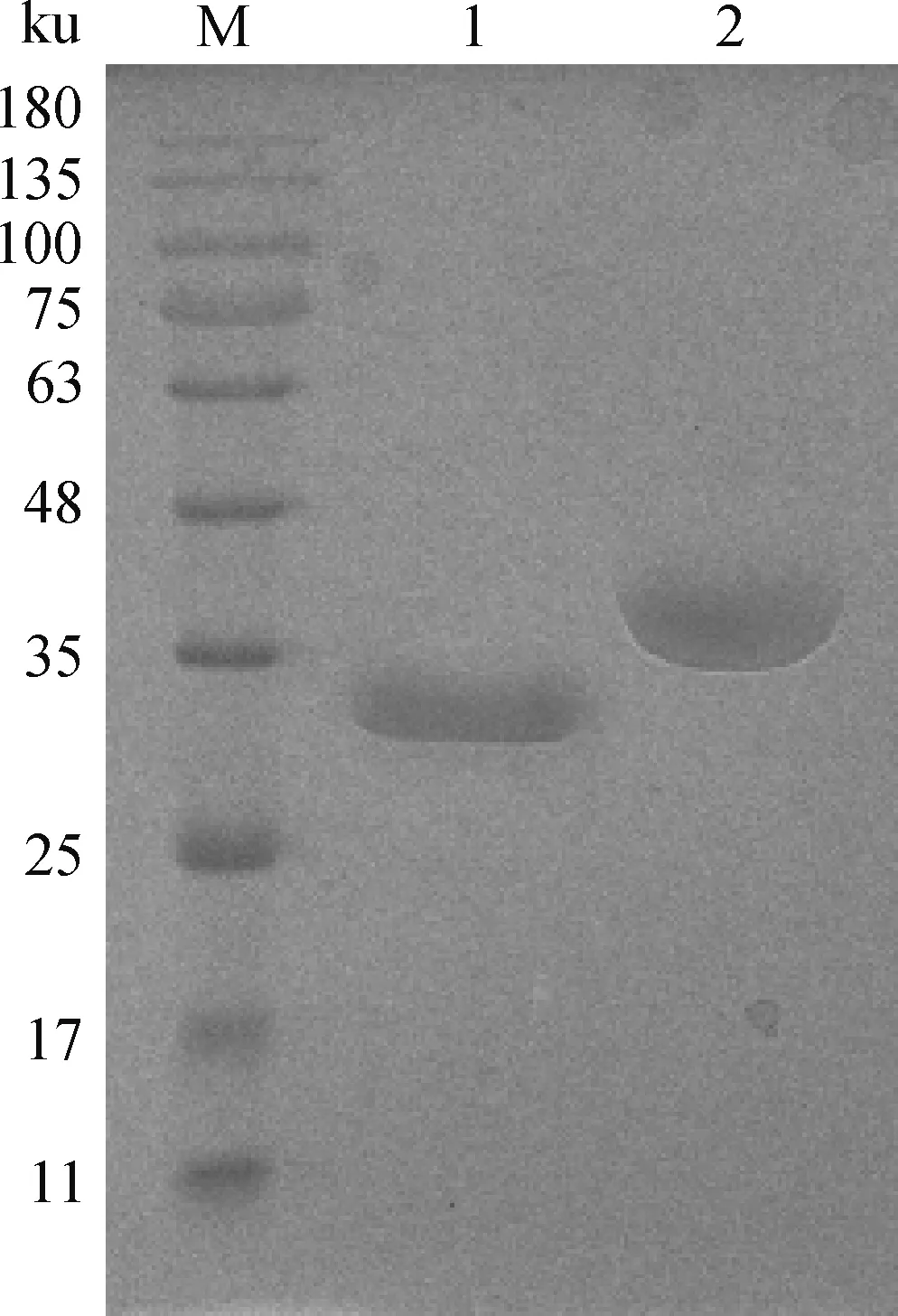
M. 蛋白质相对分子质量标准;1. 纯化后的rTm16蛋白;2. 纯化后的rTm-GST蛋白M. Protein marker; 1. The purified recombinant rTm16; 2. The purified recombinant rTm-GST图1 重组蛋白rTm16和rTm-GST纯化图Fig.1 The purification of recombinant proteins rTm16 and rTm-GST
2.2 免疫保护试验
2.2.1 人工感染 rTm-GST疫苗组和皂素对照组在口服攻击多头带绦虫的虫卵后1~2周,分别有1、3只羊死亡(表2),剖检发现脑组织有脑炎病变,同时,死前伴有体温升高、厌食、精神萎靡等脑膜脑炎症状。经口感染多头带绦虫的虫卵后105 d(约3.5个月),各组山羊全部进行剖检,对照组全部发现有包囊存在,疫苗组脑多头蚴包囊感染情况见表2。由表2可知,脑多头蚴包囊在皂素对照组中全部位于山羊的脑和脊髓部,平均直径约3 cm,而联合免疫组包囊全部位于肌肉组织间,平均直径约1.5 cm。相较于联合疫苗组,rTm16疫苗组和rTm-GST疫苗组山羊在脑、脊髓和肌间组织部位均有包囊分布,其中有36%(4/11)的包囊位于肌间组织。通过计算减囊率,联合免疫rTm16与rTm-GST的山羊获得最大的减囊率(87.5%),而注射rTm16疫苗、rTm-GST疫苗的山羊分别获得50%、62.5%的减囊率。与对照组相比,rTm16与rTm-GST的联合免疫显著地提高了试验山羊对多头带绦虫虫卵的抵抗能力(P=0.005),而单独使用rTm16或rTm-GST则差异不显著(P=0.172;P=0.06)。
表2各组山羊感染脑多头蚴包囊数量情况
Table2NumbersofCoenuruscerebralisofgoatsineachgroup
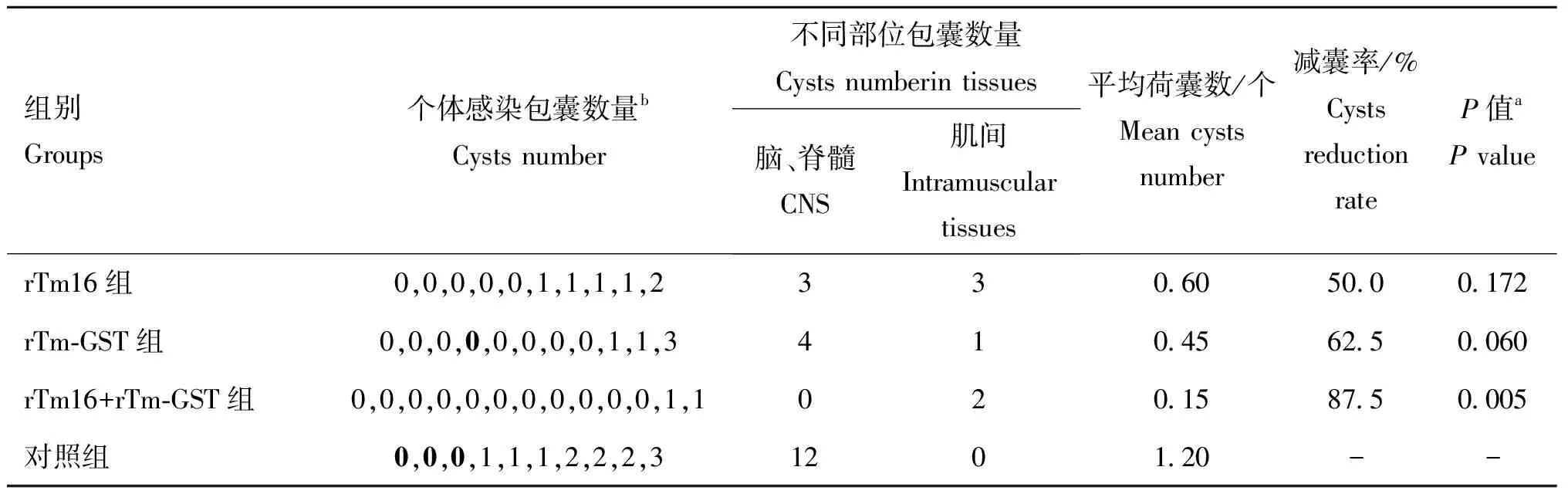
组别Groups个体感染包囊数量bCysts number不同部位包囊数量Cysts numberin tissues脑、脊髓CNS肌间Intramuscular tissues平均荷囊数/个Mean cysts number减囊率/%Cysts reduction rateP值aP valuerTm16组0,0,0,0,0,1,1,1,1,2330.6050.00.172rTm-GST组0,0,0,0,0,0,0,0,1,1,3410.4562.50.060rTm16+rTm-GST组0,0,0,0,0,0,0,0,0,0,0,1,1020.1587.50.005对照组0,0,0,1,1,1,2,2,2,31201.20--
a.The Mann-WhitneyUtest被用于检验接种山羊相对于对照组山羊包囊数量的差异性,P<0.05表示差异显著,P<0.01表示差异极显著;b.黑色加粗数字表示攻虫以后死亡的山羊
a.The Mann-WhitneyUtest was used for comparison of the number of cysts in vaccinated goats compared with controls.P<0.05 means significant difference between the controls,P< 0.01 means that the difference is very significant between the controls;b.Black bold numbers mean the dead goats post challenge
2.2.2 血清特异性抗体的间接ELISA检测 使用rTm16与rTm-GST蛋白分别作为检测抗原,采用间接ELISA方法进行血清特异性IgG的检测,各组血清IgG的OD450 nm值变化见图2。从图2可以看出,首免后,rTm-GST组、rTm16组、联合免疫组山羊血清IgG值有明显上升,进行二次免疫后各组山羊IgG达到最高,随后缓慢下降,但仍高于临界值。二免后半年进行三免,各免疫组特异性IgG迅速上升,其中rTm-GST疫苗组上升最明显。
整个试验期间,除去32周所检测值外,由rTm-GST所诱导的rTm-GST疫苗组特异性IgG水平均低于由rTm16诱导的rTm16疫苗组的IgG水平且在攻虫前具有显著差异(P<0.05);联合免疫组中rTm16抗体水平高于rTm-GST的抗体水平,仅在第4、12、14周差异显著(P=0.14;P=0.01;P=0.08)。随着试验的推进,rTm16疫苗组山羊的特异性IgG变化情况相比rTm-GST疫苗组更大。同时,在虫卵攻击以前,注射rTm-GST疫苗所诱导的血清抗rTm-GST-IgG水平均低于联合免疫(rTm16和rTm-GST蛋白)时所诱导的抗rTm-GST-IgG水平,普遍呈现显著差异(P<0.05),攻虫以后,两组山羊的抗rTm-GST-IgG水平差异不明显(P>0.05);而由rTm16蛋白所诱导的抗rTm16-IgG水平在单疫苗组和联合免疫组之间差异不明显(P>0.05),这些结果表明,rTm16与rTm-GST联合使用时对山羊抗rTm-GST-IgG的诱导可能产生了协同作用。

实线表示rTm16蛋白测定的临界值,虚线表示rTm-GST蛋白测定的临界值;* 表示联合免疫组中,抗rTm-GST-IgG水平与抗rTm16-IgG水平呈现显著差异;V1、V2、V3分别表示第一次免疫,第二次免疫和第三次免疫The real line means the cut-off value for the determination of rTm16 protein, the dotted line represents the cut-off value for rTm-GST protein. Asterisk (*) means that there was a significant difference in anti rTm-GST-IgG level and anti rTm16-IgG level in rTm16 and rTm-GST vaccine group. V1, V2, and V3 indicate that the first immunization, the second immunization and the third immunization, respectively图2 各疫苗组山羊的血清特异性IgG OD450 nm值Fig.2 Serum specific IgG OD450 nm values of each vaccine group goat
3 讨 论
3.1研究者最初发现六钩蚴的代谢产物具有较好的抗多头带绦虫感染的免疫效果[24],使用多头带绦虫六钩蚴的代谢产物接种绵羊进行免疫保护试验,免疫组绵羊获得了75%的保护率[25]。随着带科绦虫相关保护性抗原的相继发现,针对带科绦虫中间宿主的保护性疫苗也得到了相应的发展[26]。在这之中,不乏有抗原被成功制备成商业化疫苗[27-29]。带科绦虫16 kDa抗原基因最早是从羊带绦虫的六钩蚴cDNA文库筛选得到,是一类分泌抗原,国内外学者已对部分带科绦虫的16 kDa抗原进行了研究,证实其具有较好的免疫原性而可用作疫苗抗原分子,Tm16与羊带绦虫(Taeniaovis)To16基因同源,研究已显示该抗原能引起绵羊产生较高免疫力而抵抗多头带绦虫的感染[17, 30]。谷胱甘肽转移酶(GST)广泛存在于各种生物体内,具有抗氧化和解毒等重要作用,同时,该蛋白作为WHO提出的几个最具潜力的候选疫苗分子之一,在保护宿主抵抗寄生虫攻击过程中也具有重要作用[31-32]。已有研究表明,日本血吸虫、细粒棘球绦虫和原虫等多种寄生虫的GST能诱导宿主产生一定水平的免疫力[33-36]。与此同时,多头带绦虫的GST已成功应用于山羊脑多头蚴病的临床诊断[2]。
在多头带绦虫疫苗抗原的研究中,Gauci等[17]首次扩增出多头带绦虫16 K基因与18 K基因,并分别构建了带有GST标签的表达载体,并用表达出的蛋白进行了免疫保护试验,单蛋白免疫组绵羊按每只50 μg蛋白、联合免疫组rTm16与rTm18各50 μg,分别配以1 mg Quil A佐剂的剂量对绵羊进行三次免疫,各次免疫间隔两周;结果发现,Tm16组和Tm16+Tm18组绵羊的包囊数量(分别为6个和11个)与对照组(34个包囊)相比均差异显著(P=0.023;P=0.015),且两组绵羊无一死亡,诱导产生了显著的免疫保护力。在此基础上,Varcasia等[37]对意大利六个农场共计632只绵羊进行田间试验,其中208只作为免疫组分别皮下注射Tm18重组蛋白50 μg并配以1 mg皂素佐剂,1个月后进行第二次免疫,免疫后的40个月时间里,仅一只羊发病,与对照组32只羊发病呈极显著差异(X2= 14.08,P< 0.001)。此外,张壮志等[15]使用福氏佐剂乳化的多头带绦虫重组45M蛋白对免疫组6只绵羊进行注射,共免疫四次,每次间隔3周,结果免疫组绵羊减囊率约70%。
而本试验通过原核表达获得了带His标签的重组rTm16和rTm-GST,配以皂素为佐剂免疫山羊,末次免疫后2周进行活虫卵感染。多头带绦虫感染常会引起宿主死亡,疫苗组除rTm-GST组中有1只羊死亡,其余各组山羊均存活。而对照组中三只羊于攻虫后1~2周死亡,剖检发现脑部有局部炎症,同时有充血现象,因此其死亡原因应为六钩蚴移行引起的急性死亡。从各组剖检情况来看,疫苗组包囊平均大小均小于对照组,反映出rTm16或rTm-GST能对山羊产生一定保护作用。从最终数据分析来看rTm16组、rTm-GST组、rTm16+rTm-GST组山羊均获得50%以上减囊率,其中rTm16+rTm-GST组减囊率达到87.5%,且高于rTm45M蛋白对绵羊免疫保护的结果[17]。研究结果表明:rTm16、rTm-GST以及rTm16+rTm-GST蛋白均能诱导山羊产生一定的保护力,但采用rTm16+rTm-GST的联合免疫方式更有效。
3.2Gauci等[17]研究中各组绵羊由Tm16所诱导的特异性抗体效价始终高于Tm18所诱导的抗体效价,Tm16组与Tm16+Tm18组绵羊均获得了显著的保护力(P分别为0.023与0.015),并且rTm18特异性抗体水平并没有因为两种重组蛋白的联合免疫而得到提高。本试验在攻虫以前,各时间点所测rTm16组IgG水平均高于rTm-GST组并具有显著性差异,但rTm16组并未获得显著的免疫保护力(P=0.172);而联合免疫组中,虽然由rTm16诱导的IgG水平仍高于由rTm-GST诱导的IgG水平,但只在部分观测点(4、12、14周)具有显著性差异,与此同时,联合免疫rTm16和rTm-GST蛋白引起了高于单独注射rTm-GST蛋白所诱导的血清抗rTm-GST-IgG值,该组山羊也获得了极显著的保护效力(P=0.005)。这表明rTm16与rTm-GST之间可能存在协同效应而诱导了更高的特异性抗体水平。
4 结 论
rTm16、rTm-GST单疫苗组按50 μg·2 mL-1,联合疫苗组按100 μg·2 mL-1(rTm16与rTm-GST各50 μg)的免疫剂量,分别配以1 mg皂素佐剂对山羊皮下免疫3次(首免后1个月进行二免,二免后6个月进行三免),三免后2周攻虫。免疫保护结果为rTm16组、rTm-GST组、rTm16+rTm-GST组山羊分别获得了50%、62.5%和87.5%的减囊率,其中rTm16+rTm-GST组山羊保护效果最好(P=0.005)。与此同时,rTm16与rTm-GST的联合使用能诱导山羊产生更高的抗rTm-GST-IgG水平,表明rTm16与rTm-GST之间可能存在某种协同效应。

