猪繁殖与呼吸综合征病毒M蛋白的ITIM基序对IFN-β产生的正调节作用
魏凤灵,张莹莹,许瑞勤,李 闻,李想通,孙杨杨,张留君,杨国宇,夏平安,张改平
(河南农业大学 牧医工程学院,郑州 450002)
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome, PRRS)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)引起的高度接触性传染病。其特征为母猪的流产,产死胎和木乃伊胎;幼龄仔猪发生呼吸系统疾病和大量死亡[1]。该病是威胁全球养猪业的最重要传染病之一,给我国养猪业造成巨大经济损失。PRRSV是正链单股RNA病毒,其基因组全长约 15 kb,含 10 个开放阅读框,其中ORF1a 和ORF1b 主要编码与病毒复制和转录相关的16 种非结构蛋白[2-3],其中ORF2~5至少编码 7种囊膜糖蛋白,包括主要结构蛋白GP5蛋白和次要结构蛋白GP4、GP3、GP2a 蛋白以及小分子疏水蛋白 E(GP2b)和ORF5a 蛋白。ORF6编码M蛋白,ORF7编码N蛋白(核衣壳蛋白)[4]。
PRRSV是一种猪免疫抑制病病毒,早期感染可诱导Ⅰ型干扰素的产生,感染后期Ⅰ型干扰素的产生则受到明显抑制[5-8]。PRRSV诱导Ⅰ型干扰素产生是一个动态平衡过程,受病毒自身成分和宿主细胞自身成分的双重调节。目前有关PRRSV的非结构蛋白负调控Ⅰ型干扰素产生的机制研究得比较清楚,而其结构蛋白调节Ⅰ型干扰素产生的相关机制研究得相对较少。免疫细胞表面存在着调控天然免疫的酪氨酸受体分子,包括含ITAM激活型基序的激活型受体和含ITIM抑制型基序的抑制型受体。激活型ITAM基序介导抗病毒炎症因子分泌的信号具有双重性[9-11],而抑制型ITIM基序主要是反向激活Ⅰ型干扰素的产生。序列分析显示PRRSV GP3、GP5和M等结构蛋白中都存在一段ITIM抑制基序,但该基序在PRRSV诱导Ⅰ型干扰素的产生过程中是否具有调节作用还不清楚。
SHP-1和SHP-2都属于非受体样的蛋白酪氨酸磷酸酶,是胞内负调控分子,在细胞磷酸化调控的信号传导途径中发挥重要作用。SHP-1可抑制TLR信号介导的NF-κB和MAPK的激活,从而抑制炎性细胞因子的产生,但有研究表明SHP-1可通过相反的方式调节Ⅰ型干扰素的产生,对TLR和RIG-I介导的Ⅰ型干扰素的产生有激活作用[12]。研究表明SHP-2可抑制TLR3-TRIF依赖型信号通路,负调控JAK激酶以及IFN-α和IFN-γ启动的STAT转录信号通路的信号转导和激活因子[13-14]。
本试验将通过检测TLR介导信号通路中TRIF、MyD88、TRAF6、IRF3、IRF7、NF-κB(p65)、IFN-β等关键分子及SHP-1、SHP-2的mRNA转录水平变化及其相互关系,来研究PRRSV M蛋白中ITIM抑制基序在PRRSV诱导Ⅰ型干扰素产生中作用,为进一步明确PRRSV感染诱导Ⅰ型干扰素产生的平衡作用机制提供参考。
1 材料与方法
1.1 载体、菌种、病毒、细胞株
载体pcDNA3.0、DH5α菌株、PRRSV Hn-1/06毒株(TCID50为104.8·mL-1)及Marc-145细胞均由本实验室保存。
1.2 主要试剂
Reverse Transcriptase M-MLV、dNTPs、Oligod(T)、Ribonuclease Inhibitor、Trizol、LipofectamineTM2000转染试剂、RIPA裂解液、T4连接酶、限制性内切酶Hind Ⅲ和EcoR Ⅰ等均购自宝生物工程(大连)有限公司,鼠抗PRRSV Hn-1/06毒株IgG(ELISA 1∶6 400)由本实验室保存,兔抗鼠HRP标记的IgG购自武汉三鹰生物技术有限公司。
1.3 重组质粒的构建
ORF6基因片段长525 bp,其中 ITIM基序对应碱基位点为70—87 bp,并将ORF6基因分成两段,即为片段1(1—69 bp)和片段2(88—525 bp),简称为D1和D2。设计扩增ORF6、D1、D2片段引物,序列如下,GP6 F: 5′-CCCAAGCTTATGGGG- TCGTCCTTAGATGA-3′,GP6 R:5′-CGGAATTCTTATTTGGCATATTTGACAAGG-3′;D1 F:5′- CCCAAGCTTATGGGGTCGTCCTTAGATGA-3′,D1 R:5′-CATATATCATAGAAAACGCCAAA-AGCACC-3′;D2 F:5′-GGCGTTTTCTATGAT-ATATGCCCTAAAGGTGAG-3′,D2 R:5′-CG-GAATTCTTATTTGGCATATTTGACAAGG-3′(斜体及下划线表示酶切位点)。采用SOE-PCR扩增GP6△ITIM片段。分别将ORF6和GP6△ITIM基因片段连接至载体pcDNA3.0中,测序正确后用于后续试验。
1.4 Western blot检测
将Marc-145 细胞接种于12孔板,待细胞长至约80%时进行重组质粒转染。收集48 h转染后细胞,加入适量的RIPA裂解液,离心取上清,用Western blot方法检测目的蛋白的表达。
1.5 细胞因子mRNA转录水平检测
将Marc-145 细胞接种于12孔板,待细胞长至约80%时进行重组质粒转染,具体操作参照LipofectamineTM2000试剂说明书。
分别收集转染后培养12、24、36及48 h的细胞,根据实验室建立的荧光定量PCR方法检测转染细胞中不同时间段TRIF、MyD88、TRAF6、IRF3、IRF7、NF-κB及IFN-β的mRNA转录水平。荧光定量PCR反应程序:95 ℃ 10 min,95 ℃ 5 s,TRIF、NF-κB:64 ℃ 34 s,MyD88、TRAF6、IRF3、IRF7:62 ℃ 34 s,IFN-β:61 ℃ 34 s,共40个循环。
1.6 靶标SHP-1、SHP-2的siRNA干扰效率检测
根据SHP-1、SHP-2基因序列,分别设计SHP-1-siRNA-781、SHP-1-siRNA-832、SHP-1-siRNA-2000、SHP-2-siRNA-420、SHP-2-siRNA-639、SHP-2-siRNA-1335 6条RNAi靶序列,同时设计一条阴性对照siRNA,如表1所示。将上述siRNA转染Marc-145细胞,设置正常Marc-145细胞作为空白对照,分别培养12、24、36、48 h。收集细胞,荧光定量PCR方法检测SHP-1、SHP-2基因的干扰效率。
表1SHP-1、SHP-2基因siRNA片段
Table1siRNAsegmentsofSHP-1andSHP-2

基因Gene靶点NumbersiRNA片段(5′→3′)siRNA segmentsSHP-1781GCAAGAACCAGGGUGACUUTTAAGUCACCCUGGUUCUUGCTT832CCCAUAUUCGGAUCCAGAATTUUCUGGAUCCGAAUAUGGGTT 2 000GCAGGAAAGUCUGUUUCAUTTAUGAGGCAGACUUUCCUGCTTSHP-2420CCAGUAUUACAUGGAACAUTTAUGUUCCAUGUAAUACUGGTT639GCGCACUGGUGAUGACAAATTUUUGUCAUCACCAGUGCGCTT1 335GCGUGUUAGGAAUGUCAAATTUUUGACAUUCCUAACACGCTTNegative controlUUCUCCGAACGUGUCACGUTTACGUGACACGUUCGGAGAATT
1.7 SHP-1与SHP-2的沉默试验
将SHP-1-siRNA、SHP-2-siRNA干扰效率最高的序列分别与重组质粒pcDNA3.0-GP6、 pcDNA3.0-GP6△ITIM共转染Marc-145 细胞,荧光定量PCR方法检测转染细胞中TRIF、IRF3、IRF7、NF-κB、IFN-β的mRNA转录水平。
2 结 果
2.1 重组质粒pcDNA3.0-GP6与pcDNA3.0-GP6△ITIM的鉴定
将构建的重组质粒pcDNA3.0-GP6与pcDNA3.0-GP6△ITIM测序并分析比对,结果与其目的片段相似性高达100%,证明重组质粒构建正确。
2.2 目的蛋白的检测
收集重组质粒pcDNA3.0-GP6、pcDNA3.0-GP6△ITIM及空载体pcDNA3.0转染48 h后的Marc-145 细胞,用鼠抗PRRSV Hn-1/06 IgG和兔抗鼠HRP-IgG进行Western blot检测。pcDNA3.0-GP6与pcDNA3.0-GP6△ITIM转染组出现了大小在19 ku左右的条带,而空载体pcDNA3.0转染组与Marc-145 细胞空白组无此条带(图1)。

M. 蛋白质相对分子质量标准;1. Marc-145细胞空白对照组;2. pcDNA3.0-GP6转染组;3. pcDNA3.0空载体转染组;4. pcDNA3.0-GP6△ITIM转染组M. Protein marker;1. Normal Marc-145 cells group;2. Transfection of pcDNA3.0-GP6;3. Transfection of pcDNA3.0;4. Transfection of pcDNA3.0-GP6△ITIM图1 目的蛋白Western blot检测结果Fig.1 Western blot analysis of target proteins
2.3 转染细胞相关因子mRNA的转录水平
将pcDNA3.0、pcDNA3.0-GP6和pcDNA3.0-GP6△ITIM分别转染Marc-145 细胞,设Marc-145 细胞为对照组,培养12、24、36及48 h后用荧光定量PCR方法检测相应细胞中MyD88、TRAF6、TRIF、NF-κB、IRF3、IRF7、IFN-β的mRNA转录水平,如图2所示,转染pcDNA3.0-GP6后与对照组相比,MyD88、TRAF6、NF-κB、IRF3、IRF7 mRNA转录水平在12、24、36 及48 h四个时间段均升高,且极显著高于对照组(P<0.01或P<0.001),而TRIFmRNA转录水平在24及36 h时间段均极显著高于对照组(P<0.001),IFN-β mRNA转录水平在24、36及48 h三个时间段均极显著高于对照组(P<0.001),说明GP6蛋白的表达可增强IFN-β及其信号通路中关键分子的表达水平。pcDNA3.0-GP6转染组与pcDNA3.0-GP6△ITIM转染组相比,IFN-β mRNA转录水平在24、36及48 h三个时间段均显著上升(P<0.05或P<0.001),TRIFmRNA转录水平在24及36 h极显著上升(P<0.001),IRF3 mRNA转录水平在12、24、36及48 h四个时间段均极显著上升(P<0.01或P<0.001);IRF7 mRNA转录水平在24、36及48 h三个时间段均极显著上升(P<0.001);NF-κB mRNA转录水平在12 h极显著低于pcDNA3.0-GP6△ITIM转染组(P<0.001),24 h后开始上升,36及48 h则极显著高于pcDNA3.0-GP6△ITIM转染组(P<0.001);而MyD88 mRNA转录水平则在12、24及36 h极显著下降(P<0.001),TRAF6 mRNA转录水平在12、24及36 h显著下降(P<0.05或P<0.001)。这说明IFN-β mRNA转录水平升高可能与TLR介导的信号通路中TRIF、IRF3、IRF7 mRNA转录水平升高相关,与MyD88、TRAF6分子不相关,而NF-κB则在36 h后作用显著。

A. MyD88;B. TRIF;C. TRAF6;D. NF-κB; E. IRF3;F. IRF7;G. IFN-β;***. P<0.001;**. P<0.01;*. P<0.05图2 正常细胞转染pcDNA3.0、pcDNA3.0-GP6和pcDNA3.0-GP6△ITIM质粒后关键细胞因子mRNA转录水平变化Fig.2 The cytokines mRNA levels in normal cells or transfection of pcDNA3.0, pcDNA3.0-GP6 and pcDNA3.0-GP6△ITIM were measured by real-time quantitative RT-PCR
2.4 Poly(I:C)刺激转染细胞相关因子mRNA转录水平
用浓度为500 ng·mL-1Poly(I:C) 分别刺激正常Marc-145 细胞、转染pcDNA3.0-GP6的Marc-145 细胞和转染pcDNA3.0-GP6△ITIM的Marc-145 细胞,培养12、24、36及48 h后用荧光定量PCR方法检测相应细胞中TRIF、NF-κB、IRF3、IRF7及IFN-β mRNA转录水平。如图3所示,Poly(I:C) 刺激组的IFN-β mRNA转录水平及其信号通路中的TRIF、NF-κB、IRF3、IRF7及IFN-β关键分子的mRNA转录水平在12~48 h均高于Marc-145 细胞对照组,其中TRIFmRNA转录水平在12~36 h差异极显著(P<0.01或P<0.001),IRF3及IRF7 mRNA转录水平在12、24 h差异极显著(P<0.01或P<0.001),NF-κB mRNA转录水平在24、36 h差异极显著(P<0.001),IFN-β mRNA转录水平在 24~48 h差异极显著(P<0.001),说明Poly(I:C) 可增强IFN-β及关键分子mRNA转录水平; pcDNA3.0-GP6转染组的IFN-β mRNA转录水平在36及48 h高于pcDNA3.0-GP6△ITIM转染组(缺失转染组),且36 h差异极显著(P<0.01),其信号通路中的TRIFmRNA转录水平在12、24、36及48 h四个时间段都高于缺失转染组,其中24与36 h差异显著(P<0.001或P<0.05);IRF3 mRNA转录水平在12、24及36 h显著高于缺失转染组(P<0.05或P<0.01);IRF7 mRNA转录水平在36及48 h显著高于缺失转染组(P<0.05或P<0.01);NF-κB mRNA转录水平在36 h极显著高于缺失转染组(P<0.001)。这些结果显示M蛋白的ITIM基序可上调由Poly(I:C) 刺激产生的IFN-β mRNA转录水平,而TRIF、IRF3、IRF7、NF-κB等关键分子在该信号通路中发挥作用。
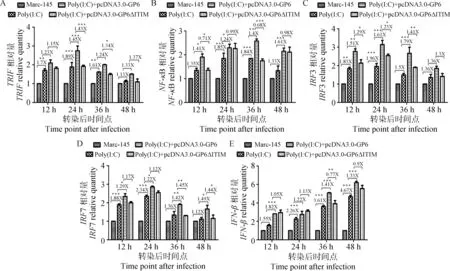
A. TRIF;B. NF-κB;C. IRF3;D. IRF7; E. IFN-β; ***. P<0.001;**. P<0.01;*. P<0.05图3 Poly(I:C)刺激后正常细胞转染pcDNA3.0-GP6和pcDNA3.0-GP6△ITIM质粒后关键细胞因子mRNA转录水平变化Fig.3 Effect of Poly(I:C) on the cytokines mRNA levels in normal cells or transfection of pcDNA3.0-GP6 and pcDNA3.0-GP6△ITIM were measured by real-time quantitative RT-PCR
2.5 靶标SHP-1、SHP-2的siRNA干扰效率检测
SHP-1、SHP-2的siRNA干扰效率检测结果如图4所示,空白对照组与阴性对照组的mRNA转录水平基本一致,6条干扰序列在12~48 h时间段均能降低靶基因SHP-1、SHP-2 mRNA转录水平,其中SHP-1-siRNA-781在12、36及48 h显著下调SHP-1 mRNA转录水平(P<0.001或P<0.05),SHP-2-siRNA-1335在24、36及48 h极显著下调SHP-2 mRNA转录水平(P<0.001),结果表明,SHP-1-siRNA-781与SHP-2-siRNA-1335的干扰效果最优。

A. SHP-1;B. SHP-2; ***. P<0.001;**. P<0.01;*. P<0.05图4 siRNA对SHP-1、SHP-2的干扰情况Fig.4 The effects of siRNA on SHP-1 or SHP-2 gene of Macr-145 cells
2.6 沉默SHP-1和SHP-2后相关因子mRNA的转录水平
将SHP-1-siRNA-781、SHP-2-siRNA-1335分别与pcDNA3.0-GP6、pcDNA3.0-GP6△ITIM重组质粒转染Marc-145 细胞,培养 12、24、36及48 h后用荧光定量PCR方法检测相应细胞中TRIF、IRF3、IRF7、NF-κB及IFN-β mRNA转录水平。如图5所示,pcDNA3.0-GP6转染组TRIF、IRF3、IRF7及NF-κB mRNA转录水平分别在24~36 h、24~48 h、12~48 h、12 h不同时间段内均显著低于pcDNA3.0-GP6△ITIM转染组(P<0.05、P<0.01或P<0.001);pcDNA3.0-GP6转染组IFN-β mRNA转录水平在12~48 h均低于pcDNA3.0-GP6△ITIM转染组(缺失转染组),36及48 h时期差异极显著(P<0.001)。结果显示,沉默SHP-1后,M蛋白的ITIM基序能够显著下调细胞中TRIF、IRF3、IRF7、NF-κB、IFN-β mRNA转录水平,表明SHP-1分子可能是ITIM基序激活调控TLR3-TRIF-IFN-β信号通路中的关键分子。如图6所示,沉默SHP-2后,pcDNA3.0-GP6转染组TRIFmRNA转录水平12及48 h高于缺失转染组但差异不显著,24及36 h极显著低于缺失转染组(P<0.01或P<0.001);pcDNA3.0-GP6转染组IRF3 mRNA转录水平在12及48 h显著高于缺失转染组(P<0.05或P<0.001),24及36 h低于缺失转染组但差异不显著;pcDNA3.0-GP6转染组IRF7 mRNA转录水平在12、24、36及48 h高于缺失转染组,12及36 h差异极显著(P<0.01);pcDNA3.0-GP6转染组NF-κB mRNA转录水平在12及48 h高于缺失转染组,12 h差异极显著(P<0.001),24及36 h均低于缺失转染组,24 h差异极显著(P<0.01);pcDNA3.0-GP6转染组IFN-β mRNA转录水平在12、36及48 h均高于缺失转染组,且12及36 h差异显著(P<0.05或P<0.001),而24 h低于缺失转染组且差异极显著(P<0.001);结果表明,瞬时干扰SHP-2后, ITIM基序对TRIF、IRF3、NF-κB及IFN-β mRNA转录水平的调节均为先升高,再降低,后趋于稳定,对IRF7则能够持续上调到48 h。综上所述, SHP-1分子可能是ITIM基序激活调控TLR3-TRIF-IFN-β信号通路中的关键分子,而ITIM 基序与SHP-2在该通路中的调节关系还需要进一步探索。
3 讨 论
本研究中,将构建的重组质粒pcDNA3.0-GP6、pcDNA3.0-GP6△ITIM转染细胞后发现,pcDNA3.0-GP6转染组TRIF、IRF3、IRF7、NF-κB和IFN-β mRNA转录水平均高于pcDNA3.0-GP6△ITIM转染组,而MyD88、TRAF6转录水平低于pcDNA3.0-GP6△ITIM转染组。这一结果说明M蛋白ITIM基序的缺失影响了IFN-β的产生,而TRIF、IRF3、IRF7、NF-κB等关键分子在IFN-β的产生中发挥作用,MyD88 和TRAF6关键分子可能作用不明显。由于PRRSV复制过程中产生的双股RNA可被宿主细胞位于吞噬体膜上的TLR3受体识别,激活TLR3信号通路,招募TRIF,随后TRIF与TBK、IKKi相互作用,TBK和IKKi作用于IRF3使其磷酸化,磷酸化后的IRF3转入细胞核激活Ⅰ型干扰素启动子,诱导IFN-β的产生[15],而病毒蛋白等自身成分可对TLR3-TRIF信号通路进行调节[16],本试验结果初步证明含有ITIM基序的病毒蛋白可正调节TLR3-TRIF信号通路,增强IFN-β的产生。

A.TRIF;B. IRF3;C. IRF7;D. NF-κB;E. IFN-β;***. P<0.001;**. P<0.01;*. P<0.05图5 SHP-1-siRNA对正常细胞转染pcDNA3.0、pcDNA3.0-GP6和pcDNA3.0-GP6△ITIM质粒后关键细胞因子mRNA转录水平变化的影响Fig.5 Effect of SHP-1-siRNA on the cytokines mRNA levels in normal cells or transfection of pcDNA3.0, pcDNA3.0-GP6 and pcDNA3.0-GP6△ITIM were measured by real-time quantitative RT-PCR

A.TRIF;B. IRF3;C. IRF7;D. NF-κB;E. IFN-β;***. P<0.001;**. P<0.01;*. P<0.05图6 SHP-2-siRNA对正常细胞转染pcDNA3.0、pcDNA3.0-GP6和pcDNA3.0-GP6△ITIM质粒后关键细胞因子转录水平的影响Fig.6 Effect of SHP-2-siRNA on the cytokines mRNA levels in normal cells or transfection of pcDNA3.0、pcDNA3.0-GP6 and pcDNA3.0-GP6△ITIM were measured by real-time quantitative RT-PCR
本研究通过Poly(I:C) 刺激试验证明M蛋白的ITIM基序能进一步上调Poly(I:C) 激活通路中的TRIF、IRF3、IRF7、NF-κB等关键因子以及IFN-β的mRNA转录水平。这一结果进一步证明了M蛋白的ITIM基序可经TLR3-TRIF信号通路对IFN-β的产生进行调节。
笔者以前的研究发现含有ITIM基序的抑制型受体FcγR IIb被选择性激活后通过增加Ⅰ型干扰素水平来抑制PRRSV的复制[17]。有资料表明Ly49Q 受体分子在胞浆样树突状细胞(pDC)膜上高度表达,其细胞质结构域中含有的ITIM基序能使Ly49Q 受体分子正向调节Ⅰ型干扰素产生[18];Trem系列蛋白分子在胞浆样树突状细胞(pDC) 膜上也高度表达,其中Trem6的细胞质结构域中含有ITIM基序是TLR介导的Ⅰ型干扰素产生所必需的[19]。这些研究结果表明抑制型ITIM基序主要是反向激活Ⅰ型干扰素的产生,与笔者的研究结果一致,但相关机制还需要进一步研究。
研究表明灭活的IRAK1能够增加由TRIF和RIG-I诱导激活的IRF3/IRF7磷酸化,促进Ⅰ型干扰素的表达[20],也有文献报道,SHP-1能够直接结合并抑制激酶IRAK1的活化来促进TLR和RIG-I激活的Ⅰ型干扰素的产生[13],这是由于IRAK1激酶的结构域中包含ITIM基序,SHP-1结合IRAK1激酶结构域中的ITIM基序后可能通过竞争或空间位阻机制抑制IRAK1激酶活性以及IRAK1自身磷酸化,从而解除了IRAK1对I型干扰素产生的抑制作用,这些研究结果说明,SHP-1可通过与含ITIM基序的IRAK1分子结合激活Ⅰ型干扰素的产生。本研究证明沉默SHP-1后,M 蛋白的ITIM基序可显著下调细胞中TRIF、IRF3、IRF7、IFN-β mRNA转录水平,这说明SHP-1在PRRSV M蛋白的ITIM基序介导IFN-β产生的信号通路中具有激活调节作用,然而其相关机制还不清楚,需要进一步研究。研究表明,SHP-2仅特异性抑制TRIF依赖性促炎性细胞因子的产生,与SHP-1可发挥协同作用,但更多时候,SHP-1和SHP-2对信号传导具有相反的调节作用[15, 21]。本研究证明沉默SHP-2后,ITIM基序对TRIF、IRF3、NF-κB、IFN-β的调节规律均为先升高,再降低,后趋于稳定,这说明SHP-2在PRRSV M蛋白的ITIM基序介导IFN-β产生的信号通路中作用不明显。
4 结 论
含有ITIM基序的PRRSV M蛋白可正调节TLR3-TRIF信号通路,增强IFN-β的产生。ITIM基序能上调Poly(I:C) 激活通路中的TRIF、IRF3、IRF7、NF-κB等关键因子以及IFN-β的mRNA转录水平。SHP-1在PRRSV M蛋白的ITIM基序介导IFN-β产生的信号通路中具有激活调节作用,SHP-2在PRRSV M蛋白的ITIM基序介导IFN-β产生的信号通路中作用不明显。

