酱香型白酒耐乳酸酵母的筛选及特性研究
王 莉,陈良强,杨 帆,陈宗校,王和玉
(贵州茅台酒股份有限公司 技术中心,贵州 仁怀 564500)
酵母菌是白酒酿造过程中重要的一类微生物,不仅是推动发酵进程的主导力量之一,同时代谢产生的挥发性风味化合物也是影响白酒风格和品质的重要因素[1-4]。在酱香型白酒酿造过程中,酵母菌经堆积发酵过程得到大量的富集与繁殖,然后进入窖内参与厌氧发酵过程[5-6]。
由于酱香型白酒酿造工艺轮次多、周期长,在窖内厌氧发酵过程中,乳酸菌等产酸微生物代谢产生大量的酸类物质,使酒醅中难挥发性酸类物质不断积累。乳酸作为酒醅中主要的酸类物质,在中后期轮次酒醅中乳酸含量达到20~40 g/kg酒醅[7]。一般情况下,过高的乳酸会使微生物细胞内外质子和阴离子对细胞膜、核糖体核糖核酸(ribonucleic acid,RNA)和脱氧核糖核酸(deoxyribonucleic acid,DNA)、活性酶类产生破坏作用,进而影响其生长和代谢过程[8-9]。但长期处于酱香型白酒这样酸性酿造环境的胁迫和驯化下,一些酿造微生物已经具有较强的抗逆特性,从而保障了后期轮次发酵的正常进行[10-12]。文献报道传统发酵食品中部分酵母菌对弱酸具有较强的耐受性,如酿酒酵母(Saccharomyces cerevisiae)可在1%的乙酸条件下生长[13-14],拜氏接合酵母(Zygosaccharomyces bailii)对乙酸、乳酸、山梨酸等都具有较高的耐受性[15-16],然而对酱香型白酒酿造过程中耐乳酸酵母的种类及特性的相关研究还较少。
本研究以酱香型白酒发酵酒醅为实验对象,筛选一株具有高乳酸耐受性的酵母菌,并比较该菌株与模式菌株ATCC6258及用于白酒酿造菌株CICC1926对乳酸和乙酸的耐受特性。最后,初步解析该菌株在不同乳酸含量条件下产挥发性风味物质的代谢特征。该研究不仅有助于加深对酱香型白酒酿造机制的认识和理解,同时也为耐酸酵母的筛选提供了较好的参考价值,为酵母高乳酸耐受性机理的研究奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
酱香型白酒发酵酒醅:贵州茅台酒股份有限公司制酒车间。
1.1.2 菌株
库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)、库德里阿兹威氏毕赤酵母模式菌株ATCC6258、用于白酒酿造库德里阿兹威氏毕赤酵母CICC1926:中国工业微生物菌种保藏管理中心(ChinaCenterofIndustrialCultureCollection,CICC)。
1.1.3 主要试剂
酵母基因组提取试剂盒:日本TaKaRa公司;其他所需试剂均为分析纯,均购买自国药集团化学试剂有限公司。
1.1.4 培养基
富集培养基:乳酸40 g/L,葡萄糖50 g/L,蛋白胨20 g/L,酵母膏10g/L,磷酸氢二钾2g/L,氯化钠1g/L,硫酸镁0.1g/L,硫酸锰0.05 g/L。
筛选培养基:乳酸40 g/L,葡萄糖50 g/L,蛋白胨20 g/L,酵母膏10 g/L。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液态培养基:葡萄糖20g/L,蛋白胨20g/L,酵母膏10g/L。YPD液态培养基中添加琼脂20 g/L即为YPD固态培养基。
含5%葡萄糖YPD液态培养基:葡萄糖50 g/L,蛋白胨20 g/L,酵母膏10 g/L。
上述培养基pH自然,115℃灭菌15~20 min。
1.2 仪器与设备
Multiskan FC全自动酶标仪:美国Thermo公司;CX23光学显微镜:日本Olympus公司;c1000触摸屏(双模块)聚合酶链式反应(polymerase chain reaction,PCR)仪、Gel Doc XR+凝胶成像系统:美国Bio-Rad公司;7890A-5975C气相色谱质谱联用仪(gas chromatography-mass spectrometer,GC-MS):美国Agilent公司。
1.3 方法
1.3.1 耐乳酸特性菌株的筛选
称取样品10g于90mL带玻璃珠的无菌水中,振荡均匀,吸取0.1 mL上清液于100 mL富集培养基中,分别在有氧/无氧、30℃/37℃条件下静置培养2~4 d,观察培养液是否浑浊;若培养液已明显浑浊时,吸取0.1 mL富集培养液于新的100mL液态筛选培养基中30℃静置培养2 d,培养3~4次后将培养液梯度稀释于YPD固体培养基上,培养3~4 d后,其单菌落即为抗乳酸特性的目标菌株。
1.3.2 菌株的鉴定
菌株形态观察:将筛选得到的耐乳酸特性菌株接种于YPD固体培养基上,30℃培养4 d,观察菌落形态;同时在显微镜下观察菌种细胞形态。
分子生物学鉴定:采用试剂盒法提取基因组[17],以其为模板对目标菌株的26S rDNA D1/D2区基因序列进行PCR扩增。测序引物为NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)和NL4(5′-GGTCCGTGTTTCAAGACGG-3′)。PCR扩增体系(25 μL):Taq-Mix酶12 μL,引物NL1和引物NL4各1 μL,模板1 μL,ddH2O 10 μL。PCR扩增程序:94 ℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸1 min,循环30次;72℃再延伸10 min。PCR扩增产物经1%琼脂糖凝胶检验合格后送往生工生物工程(上海)股份有限公司进行测序。将26SrDNAD1/D2区测序结果上传至美国国立生物技术信息中心(national center for biotechnology infor mation,NCBI)数据库中进行BLAST比对,下载同源性高的菌株的基因序列,采用Clustal X进行序列比对分析,再利用MEGA6.0软件中的邻接法(neighbor joining,NJ)构建系统进化树。
1.3.3 菌株生长曲线的测定
种子液制备方法:利用YPD固态培养基对各酵母菌株进行划线活化,30℃培养2 d,然后利用接种环挑选平板上单菌落接种于装液量为50 mL/250 mL的YPD液态培养基中,30℃、180 r/min条件下培养12 h。
将目标菌株、模式菌株ATCC6258和用于白酒酿造库德里阿兹威氏毕赤酵母CICC1926的种子液分别接入含有5%葡萄糖的YPD液体培养基中,接种后液体培养基中初始细胞数量约为106CFU/mL,30℃静置培养,每隔8 h取样测定其OD600nm值。
1.3.4 菌株耐受性研究
乳酸耐受性:将目标菌株MT-Y01、菌株ATCC6258和CICC1926的种子液分别接种于含不同质量浓度乳酸(0、40 g/L、60 g/L、80 g/L、100 g/L、120 g/L)的YPD液体培养基中,接种后液体培养基中初始细胞数量约为106CFU/mL,30℃静置培养4 d后测定其OD600nm值。
乙酸耐受性:将目标菌株MT-Y01、菌株ATCC6258和CICC1926的种子液分别接种于含不同质量浓度乙酸(0、5 g/L、10 g/L、15 g/L、20 g/L)的YPD液体培养基中,接种后液体培养基中初始细胞数量约为106CFU/mL,30℃静置培养4 d后测定其OD600nm值。
1.3.5 挥发性风味物质分析
将目标菌株的种子液接种于含有5%葡萄糖的YPD液体培养基中,接种后液体培养基中初始细胞数量约为106CFU/mL,同时在培养基中添加不同质量浓度的乳酸(0、20 g/L、40 g/L、60 g/L、80 g/L、100 g/L、120 g/L),30 ℃静置发酵4 d。
发酵结束后,将发酵液8 000×g离心10 min,取上清液10 mL装于顶空进样瓶中,并加入3 g氯化钠。通过顶空固相微萃取技术(head-space solid phase microextraction,HS-SPME)进行萃取,再利用气相色谱质谱联用仪(GC-MS)进样分析。气相色谱分离条件:柱温初始温度为60℃,以6℃/min的升温速率升至230℃,保持15min;柱流量1.6mL/min,采用恒压模式;进样口温度230℃。质谱条件:电子电离电压为70 eV;四极杆温度150℃;离子源温度230℃;采用全扫描方式(scan),使用35~550 amu的质量范围,溶剂延迟5 min。将未知物质图谱与美国国家标准与技术研究院(NationalInstitute ofStandardsandTechnology,NIST)08a.L Datebase中标准图谱进行比对,进行定性分析。采用面积归一法确定相对含量。
1.3.6 数据处理
将得到的挥发性风味物质峰面积进行归一化处理后,然后利用R语言的pheatmap程序包进行热图制作。
2 结果与分析
2.1 菌株的筛选分离与鉴定
为模拟发酵实际环境,将酒醅样品稀释后直接接入液态富集培养基,然后置于不同条件下进行培养,培养结束时,观察发酵液是否浑浊,从而判断是否有菌株生长,结果见表1。

表1 不同培养条件下菌株的生长情况Table 1 Growth situation of strains under different culture conditions
由表1可知,酒醅样品在含有40 g/L的乳酸液态培养基中生长良好,其中有氧条件下生长最为旺盛。初步表明酒醅中存在耐乳酸特性的菌株。为进一步确认,对30℃有氧条件下培养的发酵液进行多次传代培养,以确定其微生物具有稳定的乳酸耐受能力。传代富集培养3~4代后,对富集培养液稀释涂布,分离得到单菌落,其菌落及细胞形态结果见图1。

图1 酒醅样品中菌株在YPD培养基上的菌落形态(a)与细胞形态(b)Fig.1 Colonial morphology(a)and cell morphology(b)of strain from fermented grains samples on the YPD medium
通过多次的富集培养,培养基中的微生物种类大大减少,由图1可知,所有菌落形态一致,菌落呈白色,表面粗糙,质地均匀,易挑取。通过显微镜观察形态结果发现分离筛选得到的菌种细胞呈椭圆状,部分正在出芽分裂。因此,初步确定分离得到的菌株为酵母菌。
从该平板中随机挑选7个单菌落,菌株编号分别为MTY01~MT-Y07。7株菌株的测序结果经BLAST比对发现,该7株菌均与库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)NRRL Y-5396的26S rDNA基因序列相似度为99%。选取同源性较高的菌株构建系统发育树,结果见图2。

图2 7株菌株基于26S rDNA D1/D2区域序列构建的系统发育树Fig.2 Phylogenetic tree of 7 strains based on 26S rDNA D1/D2 sequences analysis
由图2可知,7株酵母菌与库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)NRRL Y-5396聚于一支,结合形态观察结果,确定7株酵母菌均为库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)。因此,挑选编号为MT-Y01的酵母菌作为代表菌株进行研究。菌株MT-Y01现已保藏于中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center,CGMCC),编号为CGMCC 14068。
2.2 菌株MT-Y01的菌落形态
为研究不同环境对库德里阿兹威氏毕赤酵母形态特性的影响,对菌株MT-Y01、ATCC6258和CICC1926的菌落形态进行对比,菌落形态结果见图3。
由图3可知,3株菌株虽然都属于同一种酵母,但形态差别明显。其中菌株MT-Y01和CICC1926的菌落均为白色、圆形,表面呈粉状,但菌株MT-Y01的菌落周围有圆环。来源于人的口腔中模式菌株ATCC6258的菌落形态与其他两株差异较大,分析原因可能是由于环境不同造成的,菌株MT-Y01和CICC1926都来源于白酒酿造过程,因此两者菌落形态较为相似,但由于不同香型白酒酿造工艺、环境的不同,从而也造成这两株菌之间的菌落形态仍有一定的差别。
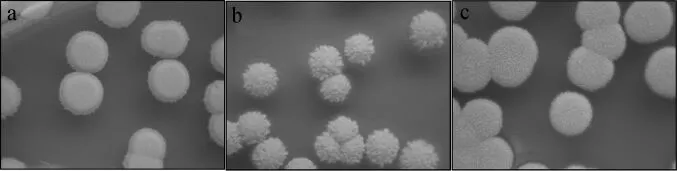
图3 菌株MT-Y01(a)、ATCC6258(b)、CICC1926(c)在YPD培养基的菌落形态特征Fig.3 Colonial morphological characteristics of strain MT-Y01(a),ATCC6258(b)and CICC1926(c)on the YPD medium
2.3 菌株MT-Y01的生长特性
分别将3株酵母接入含有5%葡萄糖的YPD液态培养基中,30℃静置培养,测得不同时间发酵液中菌体浓度,绘制其生长曲线,结果见图4。

图4 菌株MT-Y01、ATCC6258和CICC1926在含有5%葡萄糖YPD液态培养基中的生长曲线Fig.4 Growth curves of strain MT-Y01,ATCC6258 and CICC1926 in YPD liquid medium containing glucose 5%
由图4可知,菌株MT-Y01生长速率最快,模式菌株ATCC6258生长慢,且菌体浓度最高OD600nm值<26;而来源于白酒酿造过程中的CICC1926生长速率和菌体浓度略低于菌株MT-Y01。结果表明,在白酒酿造环境过程中驯化的菌株生长速率更快,特别是在酱香型白酒酿造过程中高温高酸等环境胁迫条件下,菌株具有更好的适应性和繁殖能力。
2.4 菌株MT-Y01的酸耐受性分析
2.4.1 乳酸耐受性能研究
将菌株MT-Y01和ATCC6258、CICC1926分别接入含有不同质量浓度乳酸的YPD液态培养基中,30℃静置培养4d,培养结束后测定培养液中菌株的OD600nm值,结果见图5。
由图5可知,3株酵母菌都具有较强的乳酸耐受特性,且当乳酸含量为40 g/L时,菌体的OD600nm值最高,在35.0~36.3之间,表明该种类的酵母菌均具有一定的乳酸耐受性。但菌株MT-Y01有极强的乳酸耐受性能,在乳酸含量为100~120 g/L的条件下仍可生长,而其他两株菌在乳酸含量为60g/L条件下生长非常缓慢,在80g/L的条件下已不能生长。
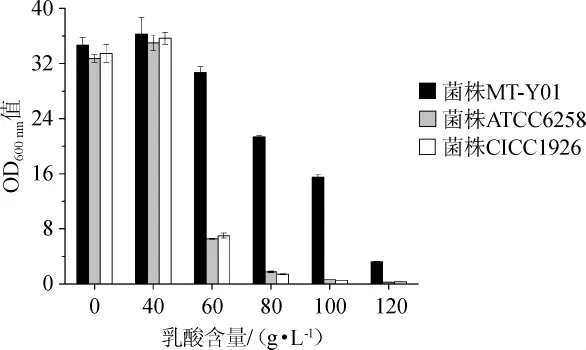
图5 不同乳酸含量下酵母菌株的生长情况Fig.5 Growth situation of yeasts with different lactic acid contents
2.4.2 乙酸耐受性能研究
将菌株MT-Y01和ATCC6258、CICC1926分别接入含有不同质量浓度乙酸的液态培养基中,30℃静置培养4 d,培养结束后测定培养液中菌株OD600nm值,结果见图6。

图6 不同乙酸含量下酵母菌株的生长情况Fig.6 Growth situation of yeasts with different acetic acid contents
由图6可知,3株酵母菌对乙酸的耐受性较弱,当乙酸含量>30g/L之后,所有菌株都不能生长,但与菌株ATCC6258和CICC1926相比,菌株MT-Y01在乙酸含量为20 g/L的条件下仍有一定的生长。
酱香型白酒独特的发酵环境长期对酿酒微生物进行驯化,促成了酿酒微生态环境中丰富的抗高温、抗高酸和抗高乙醇等特性的极端微生物的富集。与模式菌株ATCC6258和来源于其他白酒酿造环境的CICC1926相比,菌株MT-Y01在生长速率、乳酸耐受性及其乙酸耐受性方面都具有更强的特性。
2.5 挥发性风味物质的分析
菌株MT-Y01在不同质量浓度的乳酸条件进行发酵,挥发性风味物质的分析结果见图7。从2.4.1节可知,菌株MT-Y01在不同乳酸质量浓度条件下生长有所差异,同样其代谢活动和代谢产物也可能发生改变。同时在酱香型白酒制酒过程中,其酒醅中的乳酸含量也在不断发生变化,下沙堆积时,酒醅中乳酸含量<10g/kg酒醅,中后期则升高至40g/kg酒醅。因此,对菌株MT-Y01在不同乳酸质量浓度条件下的代谢产物进行了研究,结果见图7。
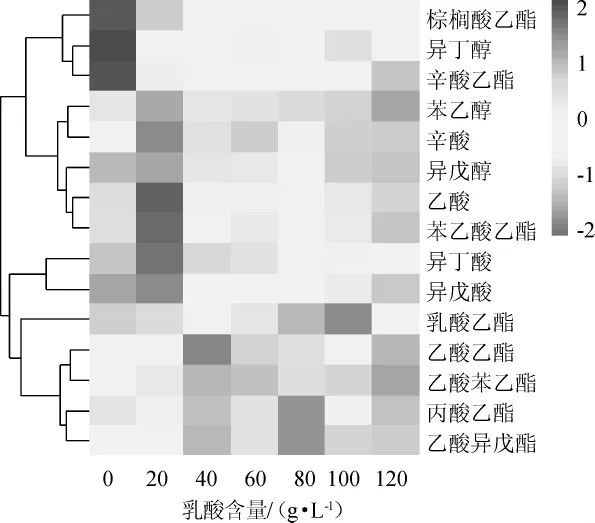
图7 菌株MT-Y01在不同乳酸含量下所产风味化合物的变化热图Fig.7 Heat map of flavor compounds changes produced by strain MT-Y01 with different lactic acid contents
由图7可知,菌株MT-Y01在不同的乳酸含量条件下主要代谢产生了15种挥发性化合物,这些物质都是酱香型白酒中重要的风味化合物,包括4种酸类、3种醇类和8种酯类。其中酯类物质的种类和含量分别占全部风味物质种类和含量的50%以上,这表明该酵母菌酯类物质代谢生成能力强,是一株酱香型白酒酿造过程中重要的产酯酵母菌。不同乳酸含量条件下,菌株MT-Y01代谢能力差别明显,当乳酸质量浓度为40 g/L时,其产酯能力最强;当乳酸质量浓度为120 g/L时,菌株MT-Y01的产酯能力受到严重抑制。表明该菌株可在0~100 g/L的乳酸含量条件下产酯,但不同酯类物质在不同乳酸含量条件下产量差异大,如乙酸乙酯在乳酸含量为40 g/L时产量最高,占总风味物质峰面积的47.1%,丙酸乙酯在乳酸含量为80 g/L时产量最高,占总风味物质峰面积的4.3%,而辛酸乙酯在不含乳酸时产量最高,占总风味物质峰面积的1.9%。
3 结论
酱香型白酒酿造工艺独特,是在高温、高酸等极端环境条件下进行发酵。本研究利用多次传代筛选的方式,从酱香型白酒酒醅中分离得到了一株高乳酸耐受性的库德里阿兹威氏毕赤酵母(Pichia kudriavzevii),该菌株有一定乙酸耐受性,最高可耐受120 g/L的乳酸。菌株在0~120 g/L的乳酸含量条件下,可代谢重要的风味物质,当乳酸含量为40 g/L时,其产酯种类多、能力强,特别是乙酸乙酯、丙酸乙酯、乙酸异戊酯和乙酸苯乙酯含量高,该结果表明此菌株是一株乳酸耐受能力强的产酯酵母菌,是酱香型白酒酿造过程中重要的功能菌之一。

