茶多酚处理对泥鳅微冻贮藏过程中肌原纤维蛋白功能性质的影响
窦川林,林 静,董 唯,尚永彪,3,4,*
(1.西南大学食品科学学院,重庆 400715;2.隆昌市农产品质量安全监督检验检测站,四川 隆昌 642150;3.农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆 400715;4.重庆市特色食品工程技术研究中心,重庆 400715)
泥鳅(Misgurnus anguillicaudatus)属于鲤形目鳅科泥鳅属[1]。泥鳅食性杂,繁殖能力强,存活率高,生长快,抗病力强,是我国重要的名优经济淡水鱼类。泥鳅肉质细腻、味道鲜美、营养丰富、有水中人参之美誉[2]。每100 g泥鳅肉中约含有蛋白质22.6 g、脂肪2.9 g、碳水化合物2.5 g、灰分1.6 g、钙51 mg、磷154 mg、铁3 mg、硫黄素0.08 mg、核黄素0.16 mg、尼克酸5 mg,还有多种维生素、较多的不饱和脂肪酸[3]。
目前泥鳅主要是以水养鲜活的方式进行运输和销售,不仅损耗大、成本高,也不符合现代社会对食品卫生、环保及贮运物流的要求,由加工企业集中宰杀并通过冷链销售必然会成为今后生鲜泥鳅的主要供应模式。微冻是近些年来开始使用的水产品保鲜技术,特点是将水产品保存在稍低于细胞汁液冻结点的温度中,使水产品处于部分冻结或过冷却的状态[4]。相对于其他冷冻保鲜技术而言,微冻冷藏对鱼体冻害不严重,设备简单、费用低,能较好地保持淡水鱼鲜度,鱼体表面色泽好,且能有效地抑制细菌繁殖,延长保鲜期,延缓脂肪氧化,解冻汁液流失少,所需降温耗能较少。因此,作为一种较好的中短期贮藏水产品的方法,微冻技术的应用受到越来越多的关注。茶多酚作为一种优质天然抗氧化剂,具有无异味、无毒副作用、安全性高、抗氧化性强等优点,是一种能够延缓腐败变质的食品添加剂,范文教等[5]研究表明,茶多酚处理能延长鲢鱼的微冻保鲜时间。
肌原纤维蛋白是一类具有重要生理学功能特性的盐溶性蛋白质,其溶解性、乳化性、表面疏水性、流变特性、凝胶特性等功能特性很大程度上决定了鱼肉产品的组织学品质,是影响鱼肉加工及产品保水性、保油性、凝胶质构、色泽、感官等品质的关键因素[6]。目前,部分学者已经展开了茶多酚在鱼肉微冻贮藏中的应用研究,重点关注的是鱼肉的感官特征、汁液流失率、剪切力、色泽、挥发性盐基氮含量、硫代巴比妥酸值等理化及微生物品质指标[7-8],然而对茶多酚在泥鳅微冻贮藏技术中的应用,尤其是对泥鳅肌原纤维蛋白功能特性的影响鲜见报道。本实验采用茶多酚和微冻相结合的技术,研究了在微冻条件下不同质量浓度茶多酚处理的泥鳅肌原纤维蛋白的溶解性、乳化性、表面疏水性、巯基含量以及流变学性质的变化。旨在为泥鳅的初级加工保鲜和深加工、烹饪的原料品质控制提供参考。
1 材料与方法
1.1 材料与试剂
泥鳅由重庆市梁平县水生农业养殖公司提供,选择体态完好、体型均匀、体质量100~110 g的泥鳅为实验材料。
茶多酚(食用级,纯度为99%) 西安康之乐生物技术有限公司。
1.2 仪器与设备
UltraScan PRO型色差仪 美国HunterLab公司;PHS-4C+型pH计 成都世纪方舟科技有限公司;DW-25W518型冰箱 青岛海尔电器有限公司;XHF-D型匀浆机 宁波新芝生物科技股份有限公司;DHP-420型电热恒温培养箱 北京永光明医疗仪器厂;722-P型可见分光光度计 上海现科仪器有限公司;Avanti J-30I型冷冻离心机 美国贝克曼库尔特公司;KjelFlex K-360型全自动凯氏定氮仪 瑞士Buchi公司;SX-4-10型马弗炉 北京中兴伟业仪器有限公司;RZ-288c型绞肉机美的集团;HR-1型流变仪 美国TA公司。
1.3 方法
1.3.1 实验设计
将泥鳅带头宰杀去内脏处理后,用水洗净,沥水30 min。GB 2760—2014《食品安全国家标准 食品添加剂使用标准》[9]规定,在水产品中茶多酚的最大使用量为0.3 g/kg。本实验中处理组选取的茶多酚溶液质量浓度为1、2、3 g/L(预实验中发现进一步增加茶多酚的质量浓度会导致刚浸泡的泥鳅体表色泽急剧变差,对泥鳅的味道、体表光滑度、色泽影响较大)。实验分为对照组(蒸馏水浸泡泥鳅)、处理组(1、2、3 g/L茶多酚溶液浸泡泥鳅),各组在4 ℃冰箱中放置30 min后取出,沥干后摊晾5 min,待泥鳅表面水分晾干后分装在硬塑托盘中,用聚氯乙烯保鲜膜覆膜包装,每盘约200 g,先在-18 ℃条件下速冻至-2.5 ℃,之后放入-2.5 ℃控温冰箱中贮藏。贮藏过程中,分别在0、5、10、15、20、25、30 d随机取泥鳅试样,在4 ℃冰箱中解冻之后测定泥鳅肌原纤维蛋白的理化指标。
1.3.2 肌原纤维蛋白质的提取
参考Wang Xu等[10]的Tris-HCl法提取鱼肉肌原纤维蛋白,并做一定修改。取出泥鳅样品,剔骨去皮,取净肉搅碎,称取一定量肉糜于离心管中,加入5 倍体积的4 ℃蒸馏水,使用高速匀浆机(10 000 r/min)匀浆60 s后,用纱布过滤2 次去除结缔组织,取滤液,然后用冷冻离心机4 ℃、8 000 r/min离心15 min后,除去上清液。沉淀物用3 倍体积、pH 7.0的缓冲液(0.1 mol/L KCl、20 mmol/L Tris-HCl,4 ℃)悬浮,再10 000 r/min匀浆30 s后,4 ℃、8 000 r/min冷冻离心10 min;重复3 次上述悬浮、匀浆、离心、清洗沉淀的过程。最后所得沉淀物,即为肌原纤维蛋白。肌原纤维蛋白贮存在4 ℃冰箱中待用。
1.3.3 肌原纤维蛋白质溶解性的测定
参考周茹等[11]的方法测定肌原纤维蛋白质溶解度,并做适当的修改。用天平称取1 g的肌原纤维蛋白于离心管中,然后加入40 mL 4 ℃磷酸盐缓冲液(50 mmol/L Na2HPO4、0.6 mol/L NaCl,pH 6.25),2 000 r/min、4 ℃匀浆30 s使蛋白质充分溶解,混合均匀,分散过程中尽量避免产生气泡,配制成2.5 mg/mL的溶液。将配制好的溶液于4 ℃冰箱中静置1 h,然后取出冷冻离心(5 500 r/min、4 ℃)15 min,取上清液。肌原纤维蛋白质量浓度的测定采用双缩脲法,空白对照为磷酸盐缓冲液。肌原纤维蛋白溶解度的计算如公式(1)所示。

1.3.4 肌原纤维蛋白质表面疏水性的测定
参考Agyare等[12]的方法测定肌原纤维蛋白疏水性。用天平称取1 g肌原纤维蛋白于离心管中,然后加入20 mL的4 ℃磷酸盐缓冲液(0.02 mol/L K2HPO4,pH 7.0)中,2 000 r/min、4 ℃匀浆30 s使蛋白质混合均匀,充分溶解,在分散过程中避免产生气泡,配制成5 mg/mL蛋白溶液。取200 μL 1 mg/mL溴酚蓝溶液和1 mL蛋白样液于离心管中,于室温下振荡10 min使溶液充分混匀,在2 000 r/min下离心15 min。取上清液1 mL,加入9 mL磷酸盐缓冲液稀释10 倍后,于595 nm波长处测定吸光度A,空白对照为用磷酸盐缓冲液代替样品。肌原纤维蛋白表面疏水性用肌原纤维蛋白结合溴酚蓝的质量来表示,溴酚蓝的结合量越大,表面疏水性越大。溴酚蓝结合量计算如公式(2)所示。
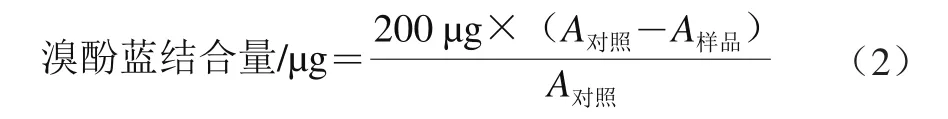
1.3.5 肌原纤维蛋白乳化性和乳化稳定性的测定
以乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)分别表示肌原纤维蛋白的乳化性和乳化稳定性,具体测定参考吴菊清[13]的方法,并做适当修改。用天平称取1 g的肌原纤维蛋白质,然后加入50 mL、4 ℃磷酸盐缓冲溶液(0.1 mol/L KH2PO4/K2HPO4,pH 6.5),4 ℃、2 000 r/min匀浆30 s使蛋白质混合均匀且充分溶解,匀浆过程中避免产生气泡,配制成1 mg/mL 的蛋白溶液。取5 mL大豆油于离心管中,加入配制好的蛋白溶液20 mL,10 000 r/min、4 ℃匀浆60 s后,从距管底0.5 cm处吸取50 μL乳浊液,加入到5 mL质量分数0.1%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液的试管中。在静置0、10 min时分别用分光光度计在500 nm波长处测定吸光度,分别记为A0、A10。肌原纤维蛋白EAI和ESI的计算如公式(3)、(4)所示。

式中:A500nm表示所测吸光度,在0、10 min时分别为A0、A10;φ表示油相体积分数/%;ρ表示蛋白质量浓度/(g/mL)。
1.3.6 肌原纤维蛋白巯基含量的测定
1.3.6.1 总巯基含量的测定
参考崔素萍等[14]的方法测定肌原纤维蛋白总巯基含量,并做适当的修改。在50 mL离心管中加入25 mL 4 ℃缓冲液C(10 mmol/L乙二胺四乙酸、0.6 mol/L KCl、8 mol/L尿素、50 mol/L磷酸盐缓冲液,pH 7.0),然后加入1 g的肌原纤维蛋白质,2 000 r/min、4 ℃匀浆30 s,使蛋白质混合均匀且充分溶解,匀浆过程中避免产生气泡,配制成4 mg/mL的蛋白溶液。取配制好的蛋白溶液1 mL与9 mL的缓冲液C混合,取4 mL混合液,加入0.4 mL、质量分数0.1%的5,5’-二硫双(2-硝基苯甲酸),空白对照为10 mL缓冲液C和0.4 mL 0.1%的5,5’-二硫双(2-硝基苯甲酸),在40 ℃的恒温水浴锅中保温25 min,最后在412 nm波长处测定溶液吸光度A。总巯基含量的计算如公式(5)所示。

式中:ε表示吸光系数(13 600 L/(mol·cm));D表示稀释倍数;ρ表示肌原纤维蛋白质量浓度/(mg/mL);b表示光程(1 cm)。
1.3.6.2 活性巯基含量的测定
参考总巯基含量的测定方法测定活性巯基的含量。将缓冲液C替换为缓冲液D(10 mmol/L乙二胺四乙酸、0.6 mol/L KCl、50 mmol/L磷酸盐缓冲液,pH 7.0),混合溶液在4 ℃下反应1 h后,利用分光光度计在412 nm波长处测定吸光度,计算同公式(5)。
1.3.7 肌原纤维蛋白质流变学性质的测定
参考刘琴[15]的方法测定肌原纤维蛋白流变学性质,并做适当的修改。在烧杯中加入20 mL的4 ℃磷酸盐缓冲液(0.6 mol/L NaCl、50 mmol/L Na2HPO4,pH 6.25),然后加入5 g的肌原纤维蛋白,2 000 r/min、4 ℃匀浆30 s使蛋白质混合均匀,充分溶解,匀浆过程中避免产生气泡,配制成40 mg/mL的蛋白溶液。用HR-1型流变仪进行肌原纤维蛋白流变学性质的测定,采用40 mm的夹具,振荡频率1 Hz,应变0.002 5,狭缝宽度0.5 mm,样品以1 ℃/min的速率从20 ℃升温至85 ℃,在85 ℃保持3 min,最后以5 ℃/min的速率从85 ℃降温至5 ℃。
1.4 数据处理
每个实验重复3 次,每次3 个平行。采用WPS 2016软件对数据进行统计处理,结果以表示,采用Origin 8.6软件作图,采用SPSS 17.0软件的方差分析(analysis of variance,ANOVA)对数据进行差异显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 不同处理对泥鳅贮藏过程中肌原纤维蛋白溶解度的影响
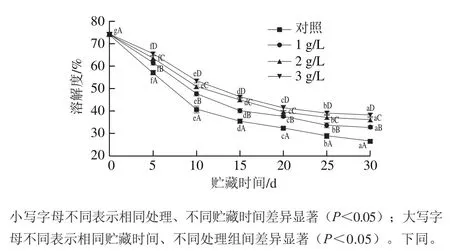
图1 不同处理对泥鳅贮藏过程中肌原纤维蛋白溶解度的影响Fig.1 Effects of different treatments on loach myofibrillar protein solubility during storage
由图1可知,随着微冻贮藏时间的延长,所有组别泥鳅肌原纤维蛋白的溶解度均呈显著下降趋势(P<0.05),且在贮藏前10 d下降速率最快,10 d后溶解度下降速率有所减缓,30 d时,对照组和1、2、3 g/L茶多酚处理组溶解度分别下降到了26.55%、33.78%、36.01%、38.28%。另外,不同质量浓度茶多酚处理对泥鳅肌原纤维蛋白溶解度变化有显著影响(P<0.05),3 个不同质量浓度茶多酚处理组的肌原纤维蛋白的溶解度在整个微冻过程中均显著大于对照组(P<0.05);且3 g/L茶多酚处理组显著高于1、2 g/L茶多酚处理组(P<0.05)。
冻藏过程中蛋白质微环境变化和蛋白质的变性导致不溶性大分子质量蛋白质聚集体的形成,这是肌原纤维蛋白溶解性不断下降的重要原因[16]。从热力学上来看,蛋白质溶解性的降低是由于冻藏过程中蛋白质与水之间、蛋白质与蛋白质之间相互作用的平衡发生变化,导致了蛋白质与蛋白质分子间的作用力增强而蛋白质与水间的作用力减弱,即蛋白质与结合水之间的结合状态被破坏[17]。本实验中,随着微冻时间的延长,蛋白质结构发生改变,使蛋白质疏水基团不断暴露,相互作用导致蛋白质产生凝聚和沉淀,导致蛋白质溶解度逐渐减小;而3 个茶多酚处理组的溶解度下降速率显著低于对照组(P<0.05),是因为茶多酚具有的较强的抗氧化性,抑制了蛋白质的氧化变性,从而降低蛋白质溶解度的下降速率。另外,茶多酚对微生物生长和繁殖具有一定的抑制作用,致使微生物对蛋白的破坏能力减弱,也可减缓蛋白质溶解度下降趋势。茶多酚处理泥鳅可抑制其在微冻贮藏过程中肌原纤维蛋白溶解性能的劣变,3 g/L茶多酚处理效果最佳。
2.2 不同处理对泥鳅贮藏过程中肌原纤维蛋白表面疏水性的影响

图2 不同处理对泥鳅贮藏过程中肌原纤维蛋白表面疏水性的影响Fig.2 Effects of different treatments on loach myofibrillar protein hydrophobicity during storage
由图2可知,随着微冻贮藏时间的延长,对照组和3 个不同质量浓度茶多酚处理组泥鳅肌原纤维蛋白的溴酚蓝含量均呈不断上升的趋势,且上升趋势明显。对照组和1、2、3 g/L茶多酚处理组泥鳅肌原纤维蛋白与溴酚蓝结合量初始分别为13.01 μg和12.95、12.99、12.87 μg,贮藏30 d后,分别上升到了56.01 μg和52.07、47.22、45.31 μg,比初始含量分别增加了3.31 倍和3.02、2.64、2.52 倍。在整个贮藏过程中,茶多酚处理组泥鳅溴酚蓝含量均显著小于对照组(P<0.05),且茶多酚质量浓度越大,与溴酚蓝的结合量越小。肌原纤维蛋白与溴酚蓝的结合量越大,说明其疏水性越强[18]。茶多酚处理组与肌原纤维结合的溴酚蓝质量显著低于对照组(P<0.05),表明茶多酚处理组泥鳅的肌原纤维蛋白表面疏水性更弱。
蛋白质分子表面疏水性氨基酸的相对含量反映了蛋白质的表面疏水性的大小,表面疏水性基团暴露得越多,蛋白质的疏水性也越大。肌原纤维蛋白分子发生聚集,导致蛋白质的变性是不可逆的;因此蛋白质的变性程度也可以用表面疏水性来衡量[19]。本实验泥鳅肌原纤维蛋白表面疏水性随微冻时间的延长而增大,是由于贮藏过程中蛋白质变性程度不断增加,引起蛋白质构象发生变化,表面疏水性氨基酸基团不断暴露,从而导致表面疏水性不断增大,结果与Mutilangi等[20]研究蛋白质的降解变性作用使埋藏在蛋白质内部的分子暴露出来,导致疏水性的增加的结果相一致。而茶多酚处理泥鳅后,微冻贮藏过程中表面疏水性增大趋势有所减缓,这一研究结果则表明茶多酚能有效减缓蛋白质的降解以及变性,这也与吕卫金等[19]采用3 g/L茶多酚处理大黄鱼能够延缓其肌原纤维蛋白表面疏水性的增加结果相一致。
2.3 不同处理对泥鳅贮藏过程中肌原纤维蛋白乳化性的影响
由图3A、B可知,随着微冻贮藏时间的延长,对照组和3 个不同质量浓度茶多酚处理组泥鳅肌原纤维蛋白EAI和ESI均呈不断下降的趋势。不同质量浓度茶多酚处理对泥鳅肌原纤维蛋白EAI和ESI均具有显著影响(P<0.05);3 个不同质量浓度茶多酚处理组的ESI和EAI的下降速率在整个贮藏过程中均显著小于对照组(P<0.05),且茶多酚质量浓度越高,下降速率越慢。研究结果表明茶多酚处理泥鳅能够延缓其乳化性能的劣变,且质量浓度越大效果越明显。

图3 不同处理对泥鳅贮藏过程中肌原纤维蛋白EAI(A)、ESI(B)的影响Fig.3 Effects of different treatments on EAI (A) and ESI (B) of loach myofibrillar protein during storage
蛋白质的乳化能力体现在其既能与水又能同脂肪相互作用。乳化能力是衡量在一定条件下蛋白质溶液所能乳化脂肪的能力[21]。研究表明,蛋白质的乳化能力与其溶解度有关,溶解度越高,乳化能力越好[22]。本实验中,微冻泥鳅在贮藏过程中肌原纤维蛋白乳化能力的下降与溶解度的降低有着较大的关系。另外也有研究表明,在微冻过程中蛋白质氧化变性引起肌球蛋白交联程度慢慢增加,进一步使蛋白质丧失了表面吸附脂肪颗粒的灵活性,从而使乳化能力降低[23]。经过茶多酚溶液处理后的泥鳅在微冻过程中蛋白质的氧化变性及微生物破坏引起的蛋白质变性都受到了一定的抑制,进而有效延缓了肌原纤维蛋白溶解性的降低及蛋白质表面吸附脂肪颗粒能力的减弱,因此乳化能力的下降也明显低于对照组。
2.4 不同处理对泥鳅贮藏过程中肌原纤维蛋白巯基含量的影响
由图4A、B可知,随着微冻贮藏时间的延长,对照组和3 个不同质量浓度茶多酚处理组泥鳅肌原纤维蛋白的总巯基和活性巯基含量整体上均呈逐渐下降的趋势(P<0.05),变化趋势与Mutilangi等[20]的测定结果相似。茶多酚处理组的泥鳅在微冻过程中肌原纤维蛋白总巯基、活性巯基含量的下降速率均慢于对照组(P<0.05),茶多酚质量浓度对总巯基、活性巯基含量的变化均有显著性影响(P<0.05)。

图4 不同处理对泥鳅贮藏过程中肌原纤维蛋白总巯基(A)、活性巯基(B)含量的影响Fig.4 Effects of different treatments on total sulfhydryl (A) and active sulfhydryl (B) contents of loach myofibrillar protein during storage
巯基基团是肌原纤维蛋白的功能基团,在所有的功能基团中,巯基基团最活泼、最具反应活性,对于肌原纤维蛋白空间结构的稳定具有非常重要的意义,巯基含量的降低是由于肌原纤维蛋白质变性后结构发生变化,导致巯基暴露,巯基容易被氧化为二硫键,从而导致肌原纤维蛋白质中巯基含量明显降低[24]。蛋白质氧化变性的程度可以由巯基含量间接反映,并且巯基对蛋白质的凝胶功能性质、乳化性有一定的影响[25]。本实验结果显示,3 个茶多酚处理组泥鳅在微冻过程中肌纤维蛋白质总巯基和活性巯基含量相对于对照组保持较高水平,说明茶多酚能够有效减缓肌原纤维蛋白氧化变性和降解,且处理的质量浓度越大,效果越明显。这一结果也符合上述溶解度、乳化性、表面疏水性的结果。与Ramirez等[26]报道的抗氧化剂可结合蛋白质,从而使蛋白质的降解和氧化减缓的结果相似。
2.5 不同处理对泥鳅贮藏过程中肌原纤维蛋白流变学特性的影响
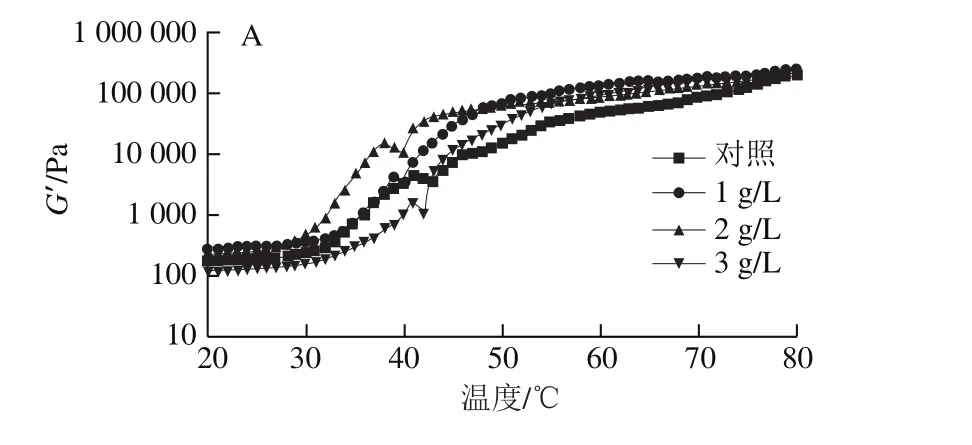

图5 不同处理对泥鳅贮藏过程中肌原纤维蛋白弹性模量的影响Fig.5 Effects of different treatments on elastic modulus of loach myofibrillar protein during storage

表1 贮藏过程中泥鳅肌原纤维蛋白最大弹性模量的变化Table1 Change in maximum elastic modulus of loach myofibrillar protein during storage Pa
流变学是指从应变、应力、时间和温度等方面来研究物质流动和(或)形变的物理力学,表现为形变、力及时间之间的函数,肌原纤维蛋白凝胶的流变学性质能够反映肌原纤维蛋白在加热过程中蛋白分子性质和形态的变化[27]。弹性模量(G’)是衡量蛋白质凝胶能力的一个重要指标,G’值越高,反映蛋白质凝胶能力越强。由图5A~G和表1可知,微冻贮藏过程中,对照组和3 个茶多酚处理组泥鳅肌原纤维蛋白的G’值总体上均呈先缓慢上升后下降再显著上升最后趋于平稳的趋势。对于G’值这一变化趋势,通常的解释是:加热过程中随着温度的升高,肌球蛋白结构发生变化,初步形成较弱的三维网络结构,G’值第一次达到最大;之后随着维持网络结构的氢键在加热过程中大量断裂,蛋白质发生变性,破坏了最初形成的较弱的网络结构;内源性蛋白酶被激活,蛋白质发生水解,G’值又降至最小;最后随着温度的升高,变性的蛋白质凝聚最终形成了稳定的、不可逆的三维网状结构凝胶,G’值又开始增加直到最后趋于稳定[28-31]。
在整个微冻过程中,5~30 d的每个实验时间点上,G’值曲线整体均随茶多酚质量浓度的增大而上移,对照组G’值的变化曲线总体处于最下方,少部分时间处于1、2 g/L茶多酚处理组上方;这是加热升温过程中蛋白结构的不规则变化导致的。同时由表1可知,对照组G’的最大值始终低于茶多酚处理组,表明对照组蛋白凝胶性能最差。茶多酚处理组和对照组G’的最大值随着微冻贮藏时间的延长整体上均呈减小的趋势,但与对照组相比,3 个不同质量浓度茶多酚处理组G’的最大值变化趋势受到了明显的抑制;且3 g/L茶多酚处理抑制效果最明显,表明3 g/L茶多酚处理更能有效保持肌原纤维蛋白的流变学性能。这也表明茶多酚处理泥鳅后能够有效延缓其在微冻贮藏过程中肌原纤维蛋白凝胶能力的减弱,反映出茶多酚能够有效抑制蛋白质的变性和降解,并且在本实验条件下,茶多酚质量浓度越高效果越好。
3 结 论
本研究发现茶多酚对微冻贮藏过程中泥鳅的肌原纤维蛋白功能性质有显著影响。随着微冻贮藏时间的延长,茶多酚处理组和对照组泥鳅的溶解性、乳化性、巯基含量均呈不断下降的趋势,表面疏水性呈不断上升的趋势,茶多酚处理组的变化趋势均小于对照组,且茶多酚质量浓度越大,变化幅度越小。G’曲线整体上均随茶多酚质量浓度的增大而上移,对照组G’的最大值始终低于茶多酚处理组,3 g/L茶多酚处理更能有效保持肌原纤维蛋白的流变学性能。茶多酚处理可显著抑制泥鳅在微冻贮藏肌原纤维蛋白功能性质的劣变,且3 g/L茶多酚处理效果较佳。

