纳米Ag@SiO2改性聚偏二氯乙烯涂膜材料及提高清洁鸡蛋贮藏保鲜效果
梁艳文,严文静,赵见营,赵 媛,赵国峰,章建浩*
(国家肉品质量与安全控制工程技术研究中心,江苏省肉类生产与加工质量安全控制协同创新中心,南京农业大学食品科技学院,江苏 南京 210095)
聚偏二氯乙烯([CH2-CCl2]n,polyvinylidene chloride,PVDC)为偏二氯乙烯和氯乙烯形成的共聚物,是一种结构灵活、化学稳定性好的高阻隔性包装材料,其阻隔性能受温度变化的影响较小[1-2]。同时,PVDC无毒、安全可靠,被广泛用于包装肉制品[3]、休闲食品[4]、茶叶[5]、蛋制品[6]等。伴随着PVDC在众多行业中的广泛应用,其固有的使用缺陷也逐步显现,例如乳液黏稠、起泡、不均匀、不耐热、易变黄、黏着性差、成膜厚度不均等[7-8];因此,PVDC乳液及其成膜改性已经成为国内外研究的热点。Jomekian等[9]利用PEO-MCM-41改性PVDC,提高了PVDC膜的机械性能;Bhaskar等[10]在PVDC加工过程中加入乙烯-醋酸乙烯酯共聚物,延长其加工周期的同时降低了乳液的黏度,从而增加其流动性。
纳米粒子由于其尺寸较小,具有极大的比表面积、表面能以及宏观物质所不具备的特性,应用较多的如表面效应和量子尺寸效应[11-12]。自德国科学家Gleiter[13]提出“纳米晶体材料”的概念后,纳米材料已引起世界科技界与产业界的广泛关注,在医学、生物学、光电学、化工等领域广泛应用。近年来,利用纳米粒子改性食品包装材料逐渐成为一个新的研究热点,主要包括纳米SiO2、纳米TiO2、纳米Ag、纳米层状硅酸盐、纳米a-Fe2O3等。其中纳米Ag在抗菌方面具有高效快速的特点,在较低的浓度范围内依然具有很强的抗菌性能,是目前常用的抗菌材料之一,常被广泛用于生物传感[14]、催化[15]、抗菌[16]等领域。但纳米Ag易聚集,结构单一;而纳米SiO2尺寸小,疏松多孔,比表面积大,具有良好的透光性、生物兼容性等优异性能,是一种良好的载体材料,可以避免纳米颗粒的聚集并提高纳米颗粒的稳定性。Ag@SiO2核壳型纳米颗粒可作为有效的抗菌剂,而且银核可通过多孔的SiO2壳层释放银离子,提供良好的缓释性及持久的抗菌性能。因此其在抗菌[17]、检测[18]、催化[19]及电化学[20]等方面得到广泛应用。如杜华梅[21]采用循环伏安法以纳米族复合材料为催化剂,研究了其对H2O2及硝基化合物的电化学检测;Guo Liangqia等[22]将纳米Ag@SiO2应用于金属荧光增强,但利用纳米Ag@SiO2改性PVDC包装材料还鲜见报道。因此,本研究采用具有抑菌作用的纳米Ag@SiO2改性PVDC涂膜液,通过乳液的抑菌性、流动性和结构表征确定PVDC改性的可行性,并通过改性的PVDC涂膜液延长清洁鸡蛋的保质期,以期为PVDC在食品包装保鲜中的应用提供技术支持。
1 材料与方法
1.1 材料与试剂
清洁鸡蛋 南京禄口禽业发展有限公司;硝酸银、正硅酸乙酯(tetraethylorthosilicate,TEOS) 阿拉丁试剂(上海)有限公司;硼氢化钠 美国Sigma公司;无水氯化钙、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
85-2型恒温磁力加热搅拌器 常州国华电器公司;CTHI-250型恒温恒湿箱 上海施都凯仪器有限公司;AUY120型电子天平 日本岛津公司;HP8183型电吹风荷兰皇家飞利浦公司;HH-4型数显恒温水浴锅 上海和晟仪器科技有限公司;COF10/4-W型磁力耦合式聚合釜 威海汇鑫化工机械有限公司;evo18扫描电子显微镜(scanning electron microscopy,SEM) 德国蔡司公司;D8 Advance多晶X射线衍射(X-ray diffraction,XRD)仪 德国Bruker-AXS公司。
1.3 方法
1.3.1 纳米Ag@SiO2制备
参考Yan Wenjing等[23]的合成方法,取一个洁净的锥形瓶置于冰浴中,依次加入20 mL纯净水、5 mL质量分数1%聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)溶液、0.6 mL质量分数0.1%硼氢化钠溶液,混合一定时间,用两支50 mL针管分别装5 mL质量分数1% PVP溶液和5 mL质量分数0.1% AgNO3溶液。两支管固定在微流注射泵的两边,以30 mL/h的速率同时将两种溶液加入到冰浴的锥形瓶中,边搅拌边加入,直至反应结束,溶液从无色变为淡黄色。将反应物置于80 ℃反应2 h,去除未反应的硼氢化钠,于13 000 r/min、4 ℃下离心20 min,并用去离子水洗涤,得到纳米Ag。将纳米Ag超声重悬于20 倍体积的乙醇中。取10 mL纳米Ag-乙醇混合液于烧杯中,边搅拌边依次加入1 mL氨水和6 μL TEOS。用封口膜封口并持续搅拌2 h后于13 000 r/min、4 ℃下离心20 min,得到Ag@SiO2核壳型纳米颗粒。
1.3.2 PVDC乳液的制备
参照马磊等[6]的合成方法,将440.0 g质量分数12%氢氧化钠溶液加入到三口烧瓶中,然后加入130.0 g三氯乙烷和0.5 g对苯二酚,65 ℃下通氮气搅拌使其反应,两次蒸馏产物后收集31~33 ℃的馏分,即为偏氯乙烯单体。向磁力耦合式聚合釜中加入150.0 g蒸馏水、1.0 g辛基酚聚氧乙烯基醚、2.5 g SDS、0.2 g亚硫酸氢钠和0.5 g过硫酸钾,抽真空后加入10.0 g丙烯酸甲酯以及90.0 g偏氯乙烯单体,充入氮气至常压,500 r/min搅拌10 min后再加热至50 ℃,反应10 h即得到PVDC乳液。
1.3.3 纳米Ag@SiO2改性PVDC及成膜
纳米Ag@SiO2改性PVDC基涂膜材料:取质量分数为0.4%的SDS于85 ℃溶解于蒸馏水中,冷却至25 ℃;向SDS溶液中缓慢加入所需的纳米Ag@SiO2,3 000 r/min、25 ℃搅拌5 min;将上述纳米Ag@SiO2水溶液与PVDC乳液按照质量比1∶1混合,于25 ℃、1 000 r/min搅拌25 min,即为纳米Ag@SiO2改性PVDC基涂膜材料。利用溶液插层-流延成膜法[24]制备PVDC乳液成膜。
1.3.4 纳米Ag@SiO2改性PVDC基涂膜材料成膜性能的测定
纳米Ag@SiO2质量分数分别为0.07%、0.14%、0.21%、0.28%、0.35%、0.42%,制备纳米Ag@SiO2改性PVDC基涂膜材料,分析不同纳米Ag@SiO2质量分数下改性PVDC乳液的黏度、阻水性能及结构特征。
1.3.5 纳米Ag@SiO2改性PVDC基涂膜材料成膜杀菌性能的测定
1.3.5.1 杀菌性能的测定
取冻存的大肠杆菌、金黄色葡萄球菌,接种于营养肉汤培养基中,置于37 ℃的恒温振荡摇床中培养24 h,然后7 000 r/min、4 ℃离心7 min,取沉淀用生理盐水重悬并稀释至107CFU/mL,备用。分别用质量分数为0%、0.07%、0.14%、0.21%、0.28%、0.35%、0.42%的纳米Ag@SiO2改性PVDC乳液并制备成薄膜材料,并用粉碎机将其制成粉末。取1 g成膜材料,分别加入到10 mL菌液中,以PVDC组(纳米Ag@SiO2质量分数0%)作为空白对照(CK),于37 ℃下培养。分别在1.5、3.0、4.5、6.0、7.5 h时取出0.5 mL菌液,加入4.5 mL生理盐水,摇匀,制成体积比1∶10的样品稀释液,依次进行梯度稀释。取3 个适宜稀释度的样品稀释液100 μL涂布于平板中,大肠杆菌涂布于结晶紫中性红胆盐琼脂培养基琼脂平板上,金黄色葡萄球菌涂布于甘露醇高盐琼脂平板上。每个稀释度涂3 个平板。于37 ℃的培养箱中培养24 h,记录平板菌落数。
1.3.5.2 SEM观察
按照1.3.5.1节方法,成膜材料与大肠杆菌和金黄色葡萄球菌作用6 h后,吸取8 mL菌液于3 000 r/min、7 ℃下离心5 min,吸出4 mL上清液,同时加入4 mL质量分数2.5%戊二醛固定液固定3 min,5 000 r/min离心5 min,弃去上清液,随后用0.1 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)清洗沉淀3~4 次,最后加入1 mL 2.5%戊二醛固定液固定,采用SEM观察。
1.3.6 纳米Ag@SiO2改性PVDC基涂膜材料对清洁鸡蛋保鲜效果的影响
将清洁鸡蛋浸没于25 ℃涂膜液中,浸泡10 s后捞出并吹干,分析不同涂膜材料的涂膜效果。将不同处理组置于25 ℃、相对湿度70%下分别贮藏1、2、3、4、5、6、7、8 周,分析纳米Ag@SiO2改性PVDC涂膜材料对清洁鸡蛋贮藏保鲜效果(质量损失率、哈夫单位、菌落总数、蛋黄指数)的影响。具体涂膜材料及分组如下:对照组(CK):鸡蛋表面无任何涂膜包装材料;PVDC组(T1):未改性PVDC与水以质量比1∶1混合后进行清洁鸡蛋涂膜;改性聚乙烯醇(polyvinyl alcohol,PVA)组(T2):参考顾凤兰等[25]的方法,制备玉米油改性的PVA涂膜材料进行清洁鸡蛋涂膜;纳米Ag@SiO2改性PVDC组(T3):以纳米Ag@SiO2改性PVDC为涂膜材料进行清洁鸡蛋涂膜。
1.3.7 指标测定
1.3.7.1 粒径分析
利用纳米粒度及Zeta电位仪分析纳米Ag@SiO2粒径分布,并利用透射电子显微镜观察。
1.3.7.2 黏度测定
采用NDJ-79型旋转黏度计测定样品的黏度。在室温下将配制好的涂膜液放于旋转黏度计中,每个样品测3 次取平均值,单位为Pa·s。
1.3.7.3 阻水性测定
在玻璃杯中放入干燥后粒度为2 mm的无水CaCl2至杯口5 mm处。将均匀、无孔洞、平整的薄膜测量其厚度后紧密固定在玻璃杯口上,称质量后放入37 ℃、相对湿度85%的恒温恒湿箱中,每隔6 h称量玻璃杯的质量,依据公式(1)计算透湿率[26]。透湿率越小,成膜阻水性越高。
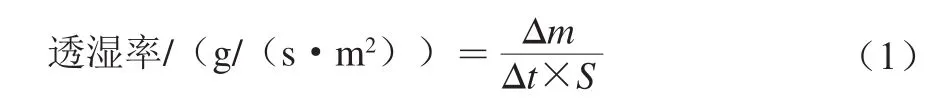
式中:Δm为玻璃杯质量的增量/g;Δt为测定时间间隔/s;S为薄膜的有效面积/m2。
1.3.7.4 XRD分析
XRD分析在D8 Advance多晶XRD仪上进行,测试条件:室温,X射线波长λ=0.154 nm,Cu靶K线,石墨单色器,管压40 kV,管流40 mA,步长0.02°,扫描速率4(°)/min,扫描范围20°~80°,最后由阵列探测器接收测定数据。
1.3.7.5 SEM观察
不同处理组PVDC复合膜经液氮脆断获得断面表面,镀金后利用SEM观察断面表观形态,加速电压5.0 kV。
1.3.7.6 菌落总数测定
在超净工作台中用酒精棉球对蛋壳表面充分消毒,然后打开蛋壳,将鸡蛋内容物倒入无菌烧杯中,充分搅拌,使蛋清、蛋黄混合均匀。取1 mL鸡蛋内容物分别注入盛有9 mL灭菌膜稀释液的试管内,经充分振摇做成体积比1∶10的均匀稀释液。10 倍梯度稀释样品匀液,吸取2~3 个适宜稀释度的样品匀液1 mL于无菌培养皿中央,每个稀释度作3 个平行。同时,分别吸取1 mL空白无菌生理盐水于无菌培养皿中作为空白对照。注入冷却至43~47 ℃的营养琼脂培养基约15 mL,迅速转动培养皿使其混合均匀,待琼脂凝固后,置于(36±1)℃恒温培养箱内(48±2)h,对生长的菌落进行计数。
1.3.7.7 质量损失率的测定
用精度为0.001 g的电子天平称量鸡蛋的质量,依据公式(2)计算贮藏清洁鸡蛋的质量损失率。
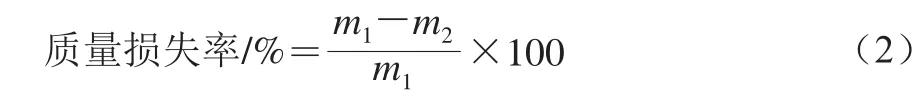
式中:m1为清洁鸡蛋初始质量/g;m2为清洁鸡蛋贮藏一段时间后的质量/g。
1.3.7.8 哈夫单位的测定
利用游标卡尺测定浓厚蛋白的高度,用精度为0.001 g的电子天平称量鸡蛋的质量,按公式(3)计算哈夫单位(HU)[27]。

式中:H为蛋白高度/mm;m为鸡蛋质量/g。
1.3.7.9 蛋黄指数的测定
使用精度为0.02 mm的游标卡尺测定蛋黄高度及宽度,按式(4)计算蛋黄指数(YI)。

式中:H为蛋黄高度/mm;W为蛋黄宽度/mm。
1.3.7.10 银的渗透量的测定
选取纳米Ag@SiO2改性PVDC涂膜液涂膜后的清洁鸡蛋,剥离蛋壳膜,利用分离器将蛋清、蛋黄分离,利用电感耦合等离子体质谱仪测定蛋清及蛋壳膜中银元素的含量。
1.4 数据统计分析
所有数据利用Excel软件进行处理,用SAS 9.2软件进行方差分析(ANOVA),利用LSD法进行差异显著性检验(n=3),P<0.05表示差异显著。
2 结果与分析
2.1 纳米Ag@SiO2结构表征分析

图1 纳米Ag@SiO2透射电子显微镜图Fig.1 Transmission electron micrographs of nano-Ag@SiO2
从图1中可以看出,SiO2包覆于纳米Ag外层,纳米Ag@SiO2呈单分散状态,粒径均一,体系中没有明显的颗粒聚集,且几乎没有找到单独的银核。从图2中可以看出,纳米Ag@SiO2颗粒尺寸集中在100 nm左右,粒径分布较为均匀。从图3中可以看出,在2θ为38.15°、44.10°、64.55°、77.65°处出现了纳米银的4 个特征衍射峰(银的标准数据为38.096°、44.257°、64.406°、77.452°),分别对应纳米银的(111)、(200)、(220)和(311)4 个特征晶面。说明纳米银在Ag@SiO2核壳结构中以晶体的形式存在。此外,在2θ为21.00°处出现了SiO2的特征吸收峰,说明SiO2以无定型态存在。
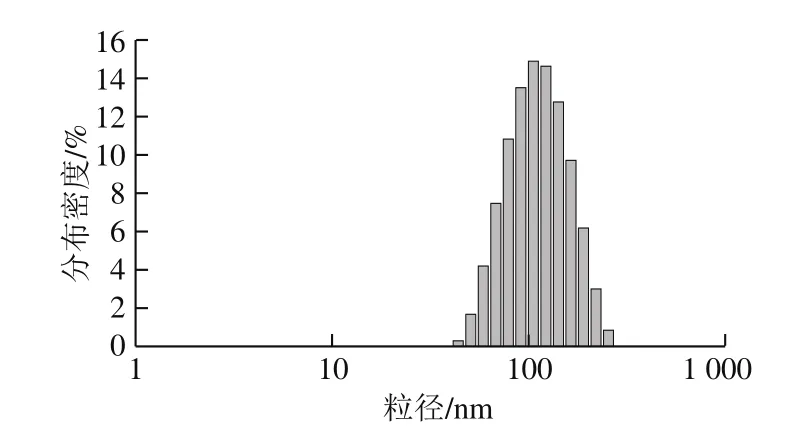
图2 纳米Ag@SiO2粒径分布Fig.2 Particle size histogram of nano-Ag@SiO2

图3 纳米Ag@SiO2 XRD图谱Fig.3 X-ray diffraction (XRD) pattern of nano-Ag@SiO2
2.2 纳米Ag@SiO2改性PVDC乳液成膜性能分析
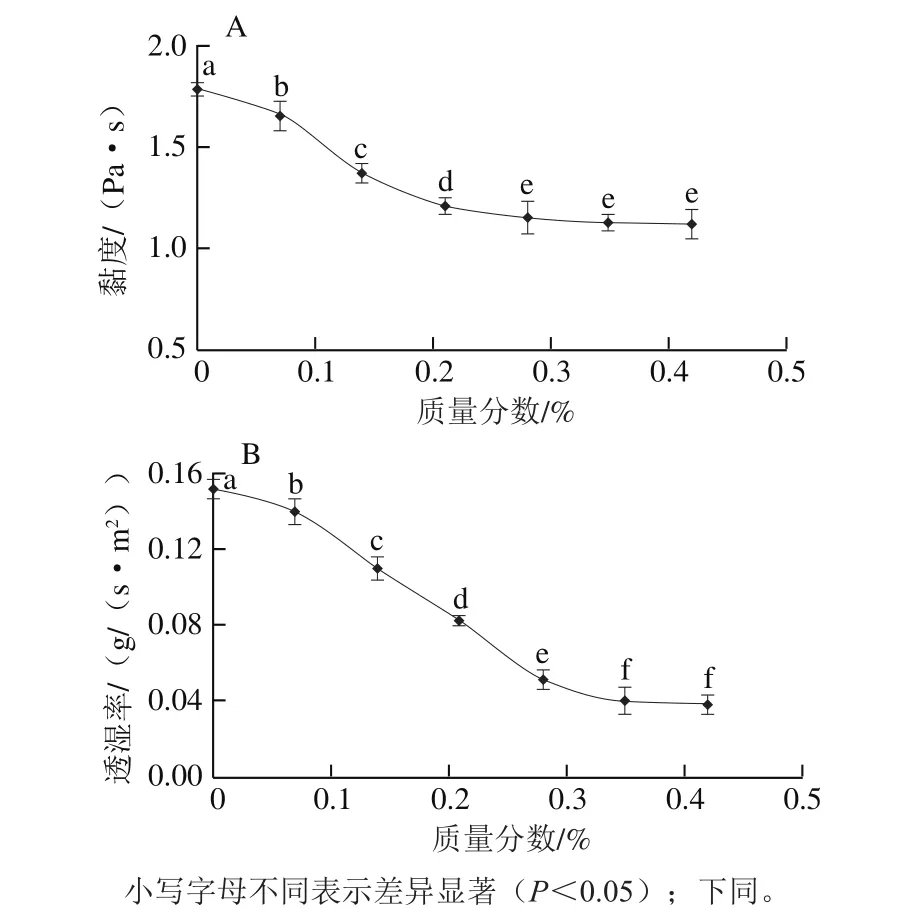
图4 纳米Ag@SiO2质量分数对PVDC乳液黏度(A)及成膜透湿率(B)的影响Fig.4 Effect of nano-Ag@SiO2 addition on PVDC viscosity (A) and water vapor permeability (B)
由于PVDC乳液黏度较高,导致其在涂膜过程中存在结块、气泡等不良现象,不利于涂膜稳定性。经过纳米Ag@SiO2改性后可以有效降低PVDC乳液黏度。从图4A中可以看出,随着纳米Ag@SiO2质量分数的增加,乳液黏度呈显著的下降趋势(P<0.05),但是随着纳米粒子质量分数的继续增加,当质量分数超过0.21%时,乳液黏度无显著变化(P>0.05)。由此可以看出,纳米Ag@SiO2可以显著降低PVDC乳液的黏度,增加其流动性。这主要是因为纳米Ag@SiO2与PVDC分子通过“物理键”稳定地结合在PVDC长链的外侧基团中,从而减小了PVDC长链分子间的相互作用而使黏度降低。同时,纳米Ag@SiO2改性PVDC材料后,可显著提高PVDC的成膜阻水性(图4B)。随着纳米Ag@SiO2质量分数的增加,成膜透湿率持续减小。这主要是因为纳米Ag@SiO2与PVDC结合后,可以缩小PVDC分子间隙,提高其致密度。
2.3 纳米Ag@SiO2改性PVDC涂膜材料成膜结构分析
2.3.1 片层间距分析
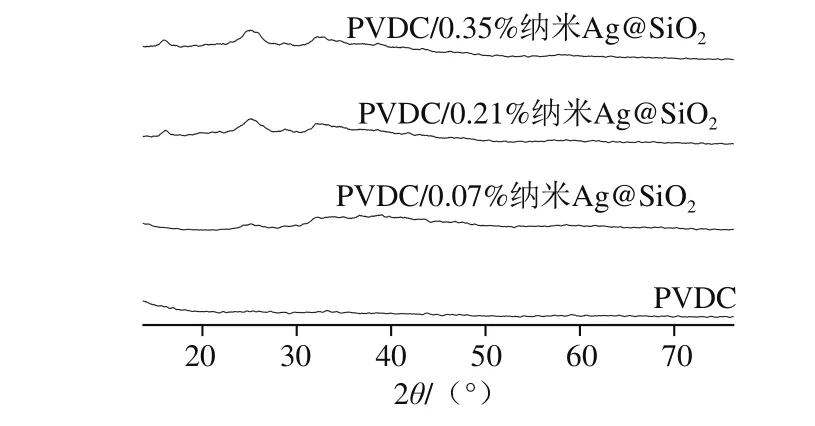
图5 PVDC复合膜材料XRD图谱分析Fig.5 XRD patterns of PVDC and composite packaging material
为了研究不同纳米Ag@SiO2与PVDC复合后其片层间距的变化,对复合膜材料进行XRD分析,结果如图5所示。当加入质量分数0.07%纳米Ag@SiO2后,在2θ为24.781°处出现衍射峰,根据Bragg方程λ=2dsin θ(λ为X射线入射光波长,此处为0.154 nm;d为片层间平均距离;θ为半衍射角)计算得出,对应的片层间距为0.359 nm。随着纳米Ag@SiO2质量分数的增加,复合膜的衍射峰发生了一定程度的位移,添加质量分数0.21%纳米Ag@SiO2和0.35%纳米Ag@SiO2的复合膜分别转移至25.081°、25.182°,峰高变高。对应的片层间距分别为0.355、0.353 nm。
2.3.2 成膜结构变化分析
2.2 节及2.3.1节结果表明纳米Ag@SiO2质量分数影响PVDC涂膜材料结构及性能。从图6中也可以看出,当未添加纳米Ag@SiO2时,PVDC成膜存在较多的空隙,影响了其阻隔性能;当添加适量纳米Ag@SiO2(质量分数0.07%)时,改性PVDC成膜空隙减小;当纳米Ag@SiO2质量分数为0.21%时,纳米Ag@SiO2可以有效地填充于PVDC材料的分子空隙中,从而提高其阻隔性能。但是,随着纳米Ag@SiO2质量分数的继续增加,在PVDC膜结构中明显存在纳米Ag@SiO2的结块现象。因此,采用质量分数0.21%纳米Ag@SiO2改性PVDC涂膜液,并研究其对清洁鸡蛋的贮藏保鲜效果。

图 6 纳米Ag@SiO2改性PVDC成膜SEM图Fig.6 Scanning electron microscopy (SEM) of nano-Ag@SiO2-modified PVDC coating
2.4 纳米Ag@SiO2改性PVDC涂膜材料成膜杀菌性分析
2.4.1 纳米Ag@SiO2改性PVDC涂膜材料对大肠杆菌杀菌作用分析
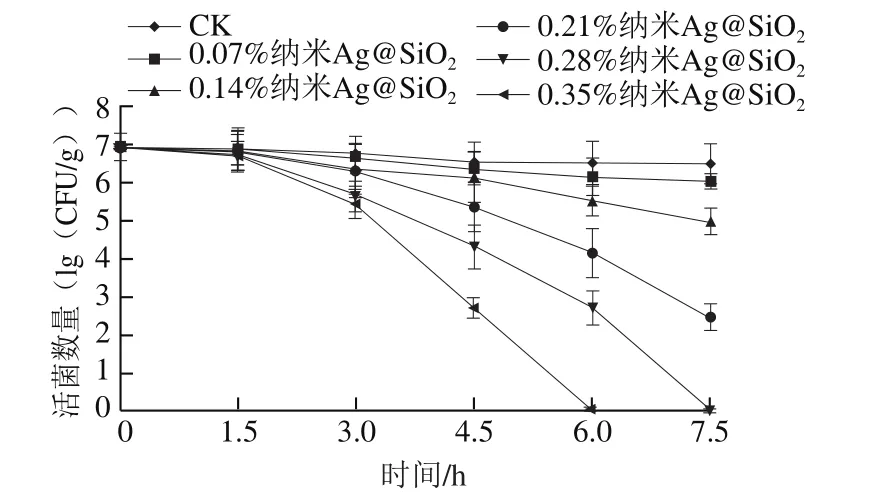
图7 改性PVDC对大肠杆菌的抑菌性能Fig.7 Bactericidal effect of modified PVDC on Escherichia coli
从图7可以看出,改性后的PVDC对大肠杆菌有极强的杀菌作用,并且随着纳米Ag@SiO2质量分数的增加及杀菌时间的延长,大肠杆菌活菌数明显降低。与CK组相比,当纳米Ag@SiO2质量分数为0.07%时,活菌数量无明显变化。当纳米Ag@SiO2质量分数大于0.07%时,大肠杆菌活菌数量随作用时间的延长急剧减少。当纳米Ag@SiO2质量分数为0.28%时,作用7.5 h后无法检测到活菌;当纳米Ag@SiO2质量分数为0.35%时,作用6.0 h时已无法检测到活菌。为了进一步分析纳米Ag@SiO2改性PVDC对致病菌的杀菌作用,以质量分数为0.21%的纳米Ag@SiO2改性PVDC乳液并成膜,通过SEM观察在抑菌6 h后大肠杆菌的形态。从图8中可以看出,正常大肠杆菌菌体形态大小基本一致,结构完整,细胞表面光滑规整。当与纳米Ag@SiO2改性PVDC作用后,菌体形态发生变化,细菌出现皱缩,部分细胞表面出现凹陷,细胞内容物泄漏。

图8 改性PVDC处理前后大肠杆菌SEM观察结果Fig.8 SEM of E. coli before and after treatment with modified PVDC
2.4.2 纳米Ag@SiO2改性PVDC涂膜材料对金黄色葡萄球菌杀菌作用
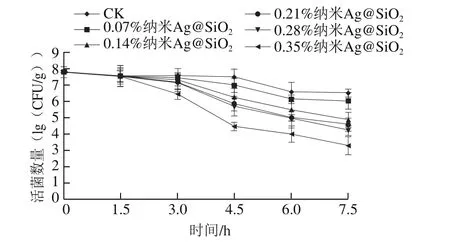
图9 改性PVDC对金黄色葡萄球菌的抑菌性能Fig.9 Bactericidal effect of modified PVDC on Staphylococcus aureus
从图9可以看出,随着纳米Ag@SiO2质量分数的增加,改性PVDC对金黄色葡萄球菌杀菌作用明显增强;随着杀菌时间的延长,金黄色葡萄球菌的活菌数明显降低。当纳米Ag@SiO2质量分数为0.28%时,作用7.5 h后活菌数降低至4.2(lg(CFU/g)),而对于大肠杆菌而言则无法检测到活菌。由此可见,纳米Ag@SiO2改性PVDC对大肠杆菌的杀菌作用明显优于金黄色葡萄球菌,这可能与细菌细胞壁的结构不同有关:革兰氏阴性细菌(大肠杆菌)的肽聚糖层较薄,强度和硬度较差;而革兰氏阳性菌(金黄色葡萄球菌)具有较厚且致密的肽聚糖层,纳米颗粒难以进入菌体内部与菌体DNA、蛋白质等内容物作用,从而表现出较强的抵抗力。从图10中可以看出,正常金黄色葡萄球菌形态大小基本一致,表面圆润规整,且细胞壁完整,细胞结构正常,但与纳米Ag@SiO2改性PVDC作用后可观察到菌体表面附着大量的纳米材料,细胞壁出现皱缩,部分菌体细胞壁出现破裂。
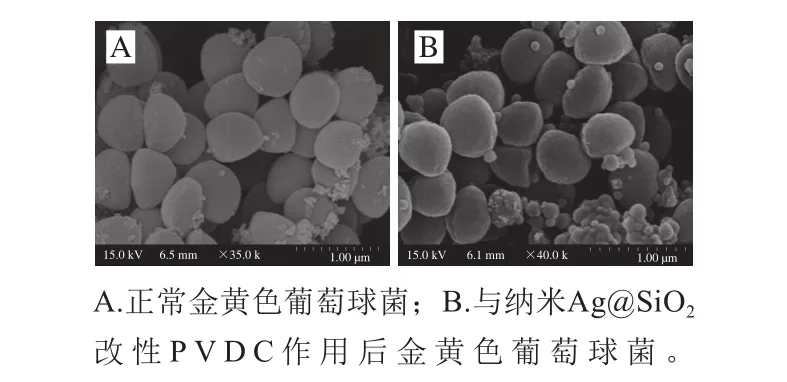
图10 改性PVDC处理前后金黄色葡萄球菌SEM观察结果Fig.10 SEM of S. aureus before and after treatment with modified PVDC
2.5 纳米Ag@SiO2改性PVDC涂膜材料对清洁鸡蛋贮藏保鲜效果分析
2.5.1 菌落总数变化分析

图11 不同处理组清洁鸡蛋菌落总数变化Fig.11 Total number of colonies in different treatment groups
从图11中可以看出,与其他3 组相比,纳米Ag@SiO2改性PVDC涂膜材料(T3)能明显抑制清洁鸡蛋内微生物的增长。主要表现为对照组(CK)清洁鸡蛋在贮藏3~4 周时菌落总数大于4(lg(CFU/g)),而对于纳米Ag@SiO2改性PVDC涂膜处理组,清洁鸡蛋在贮藏6~7 周时微生物开始生长,在贮藏8 周时该组菌落总数仅为2.99(lg(CFU/g)),明显优于其余3 组。说明纳米Ag@SiO2改性PVDC涂膜材料能明显提高其对清洁鸡蛋的贮藏保鲜效果。
2.5.2 质量损失率变化分析
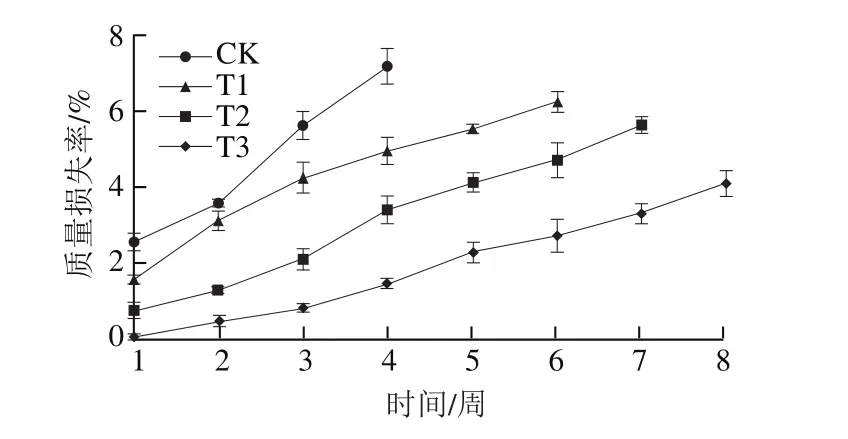
图12 不同处理组质量损失率变化Fig.12 Change in mass loss in different treatment groups during storage
新鲜鸡蛋在贮藏过程中会因水分散失、内外气体的交换及呼吸作用等造成质量下降,表现为质量损失率的增加;随着贮藏时间的延长,质量损失率会持续增加。从图12中可以看出,与对照组(CK)清洁鸡蛋相比,不同的涂膜保鲜材料均能明显减缓其在贮藏过程中的质量损失,这主要是因为不同的涂膜材料都能减少鸡蛋内外水分及气体的交换过程,维持清洁鸡蛋质量的稳定。在3 种不同的涂膜材料中,纳米Ag@SiO2改性PVDC涂膜材料(T3)能最有效地减小清洁鸡蛋在贮藏过程中的质量损失,在贮藏8 周时质量损失率仅为4.09%,明显低于其他3 组。
2.5.3 哈夫单位变化分析
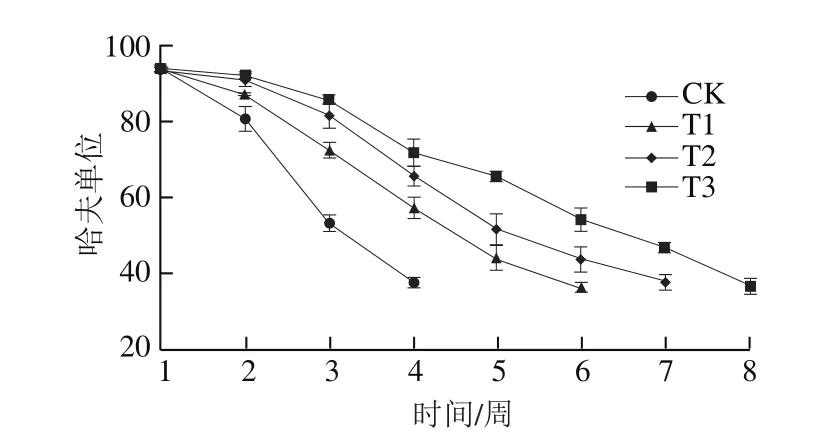
图13 不同处理组哈夫单位变化Fig.13 Change in Haugh unit indifferent treatment groups during storage
从图13中可以看出,新鲜鸡蛋的哈夫单位为93.42,随着贮藏时间的延长,不同处理组鸡蛋的哈夫单位均逐渐降低。这主要是因为在贮藏过程中,蛋内水分散失,浓厚蛋白与稀蛋白比例发生变化,浓厚蛋白逐渐减少,稀蛋白逐渐增加。与其他3 组相比,纳米Ag@SiO2改性的PVDC涂膜材料能够明显延缓鸡蛋贮藏过程中哈夫单位下降,延缓鸡蛋变质,延长其保质期。CK组在贮藏4 周时哈夫单位为37.61,T1组在贮藏6 周时为36.12,T2组在贮藏7 周时为37.62,均发生变质;而T3组在贮藏8 周时发生变质,哈夫单位为36.52。
2.5.4 蛋黄指数变化分析
蛋黄指数是评价鸡蛋新鲜度的重要指标之一,新鲜蛋的蛋黄指数在0.3以上,合格蛋的蛋黄指数应该大于0.2[28]。从图14中可以看出,新鲜鸡蛋的蛋黄指数为0.483,随着贮藏时间的延长,不同处理组的蛋黄指数均出现明显的降低趋势。在贮藏过程中,对照组(CK)蛋黄指数大幅度下降,在贮藏4 周时蛋黄指数下降至0.153,发生变质。而纳米Ag@SiO2改性PVDC涂膜处理组(T3)能够明显保持贮藏过程中鸡蛋的新鲜度,延缓变质,延长其保质期,在贮藏8 周时其蛋黄指数为0.206,明显高于改性PVA涂膜处理组(T2)和PVDC涂膜处理组(T1)。
2.5.5 纳米银的渗透量变化
对纳米Ag@SiO2改性PVDC涂膜处理组贮藏过程中蛋壳膜、蛋清中银元素含量进行测定,贮藏至第8周时,蛋壳膜及蛋清中仍未检测到银元素,说明在贮藏过程中纳米Ag@SiO2没有渗透入蛋壳内部。
3 结 论
在PVDC乳液中,分子长链通过不同的分子间作用力无序组合,增加了分子间的孔隙,一定程度上降低了其阻隔性能。从本研究中SEM观察结果可以看出,在PVDC乳液成膜后表面会存在不平整现象。为了进一步提高其阻隔性能,通过稳定的纳米Ag@SiO2水分散体系改性PVDC基乳液,纳米粒子通过其巨大的比表面积结合在PVDC表面,增加其成膜的平整度。纳米Ag@SiO2改性PVDC乳液显著降低了乳液黏度、增加其流动性。由于纳米Ag@SiO2粒子可以与PVDC长链进行物理性结合,可以阻塞部分高分子材料中的分子间隙,从而提高其致密度,明显提高PVDC成膜的阻水性,明显降低其透湿率,并且随着纳米Ag@SiO2质量分数的增加,成膜透湿率持续减小。
当纳米Ag@SiO2质量分数为0.21%时对PVDC材料有最适的改性效果,并且可以明显抑制清洁鸡蛋在贮藏过程中的质量损失及微生物的生长,保持鸡蛋的新鲜度,延缓蛋黄指数及哈夫单位的下降。纳米Ag@SiO2改性PVDC涂膜材料可延长清洁鸡蛋保质期至7 周。

