瞬时kVp切换单源双能CT物质分离技术定量反映肝脏铁沉积的体模研究
谢婷婷, 刘龙平, 单慧明, 石桥, 胡小红, 成官迅, 郭英
铁是人体必需的微量元素,健康成年男性和女性的体内铁含量分别为50和35 mg/kg,总量为3~4 g。当机体铁含量超过正常值的上限即称为铁过载,超过7~15 g时可对组织器官产生毒性,称为病理意义上的铁过载[1],临床常见于长期输血、肝血色病及慢性肝病患者[2]。人体内过量的铁首先沉积于肝脏、也主要贮存于肝脏,可导致肝纤维化、肝硬化甚至肝癌,少数可引起心脏、垂体和胰腺等重要脏器结构的损害和功能障碍[1,3]。
肝脏铁含量(liver iron content,LIC)的精确测量是评估体内铁总量的主要手段,对铁沉积严重程度的评价、治疗方案的制订和疗效评估具有重要的临床意义。MRI及双能CT可无创性评估人体内的铁总量,MRI通过测量T2*值或R2*值来反映肝脏的铁含量,可作为无创性评估肝脏铁含量的金标准,但是其也存在肝左叶感兴趣区易受心脏搏动伪影的影响、检查时间较长可能导致呼吸伪影较重等缺点;最重要的是,对于重度铁沉积患者(LIC>30 g/kg),由于大量铁元素导致肝脏信号快速衰减,使得MRI扫描时难以采集到肝脏信号衰减的过程,导致MRI对重度铁过载无法评估[4]。本研究中采用双能CT对肝脏铁沉积体模进行扫描,探讨双能CT物质分离技术定量评估肝脏铁沉积的可行性,旨在为临床无创性评估肝脏铁沉积严重程度及疗效监测提供新思路。
材料与方法
1.体外模型的制作
选取20只健康SD大鼠,解剖并分离大鼠肝脏,冲洗后剪碎、分装,置于容量为4 mL的聚氯乙烯(polyvinychlorid,PVC)管中(内径为10 mm),置于匀浆机中匀浆,直至肝组织全部制备成匀浆液后备用。将右旋糖酐铁溶液(丹麦Pharmacosmos公司,含铁浓度为100 mgFe/2 mL)与一定量的蒸馏水混合,配比为铁浓度分别为50.000、25.000、12.500、6.250、3.125和0 mg/mL的6种溶液各2 mL,然后与2 mL的肝组织匀浆液混合,得到铁浓度依次为25.000、12.500、6.250、3.125、1.563和0 mg/mL的肝组织匀浆液各4 mL,分别置于6个规格为4 mL的PVC管中,然后使用悬浮震荡仪对PVC管进行充分震荡、使样本呈均匀外观、静置6 h以上无分层改变则认为模拟肝脏铁沉积的模型制作成功。
2.扫描方案
使用GE公司标准体模(高116 mm、内径138 mm的圆柱体,其内有9个凹槽,外周8个中央1个,每个凹槽内均配有高97.8 mm、内径为25 mm的圆柱形PP管),将充满肝脏匀浆-右旋糖酐铁混合液的PVC管按顺时针方向、铁浓度从高到低的顺序依次放入体模内位于外周的8个PP管内(即管套管的形式)。
使用GE Revolution 256排MDCT扫描仪。在三组管电流条件下分别对体模进行扫描,共得到3组原始图像(图1)。扫描参数:80/140 kVp瞬时切换,管电流分别取200、320和485 mA,球管转速0.5 r/s,螺距0.984 mm,视野250 mm×250 mm,重建层厚和间距均为1.25 mm,标准算法重建,50%全模型迭代重建算法V(adaptive statistical iterative reconstruction-V,ASiR-V)。
3.数据测量
将所有原始数据传输至ADW 4.6工作站,利用GSI general MD analysis软件进行后处理分析,分别获得铁/水为基物质对的图像,沿PVC管自上向下依次选取3个层面进行测量,在每个层面上沿着PVC管内缘勾画直径6 mm、面积28.26 mm2的圆形感兴趣区(region of interest,ROI),尽量保证各管选取的ROI的位置一致,每个PVC管以3个层面ROI测量值的平均值作为该管的虚拟铁浓度值(virtual iron concentration, VIC)。
4.数据分析
使用SPSS 20.0软件进行数据分析,先对3组管电流下各PVC管测量的VIC进行单因素方差(ANOVA)分析,再对VIC与肝实际铁浓度(LIC)的相关性行Pearson分析,并采用回归分析拟合线性方程。以P<0.05为差异有统计学意义。
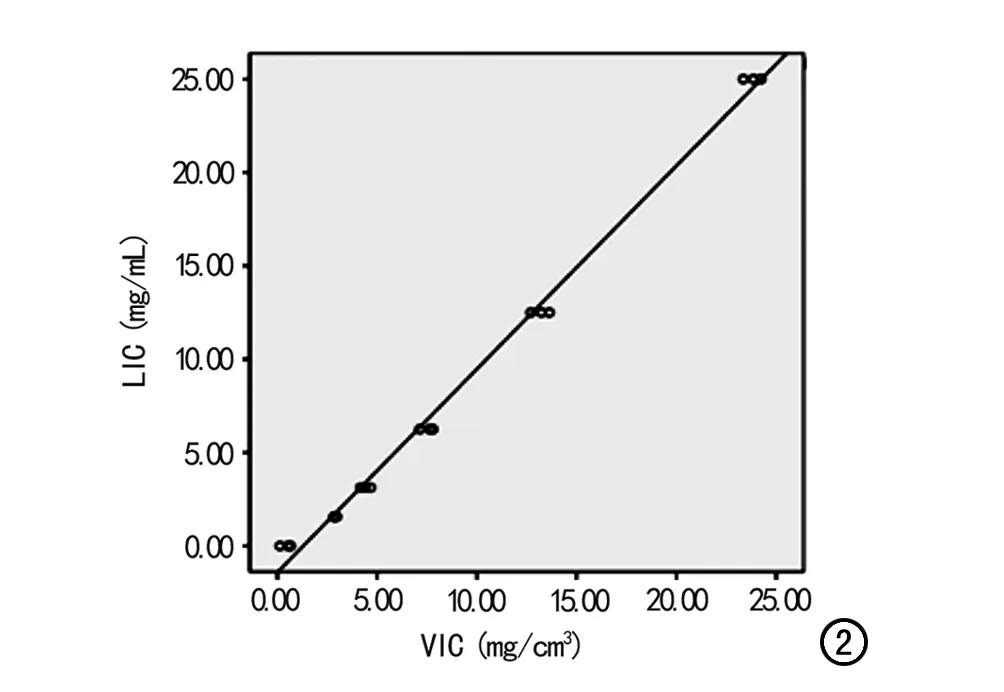
图2 肝实际铁浓度(LIC)与虚拟铁浓度(VIC)相关性分析散点图,显示三种管电流条件下LIC与VIC均呈线性相关关系。

图1 为三种管电流条件下GSI viwer视图下标准体模的铁(水)基物质对图像,体模内1~6号试管内为肝脏匀浆-右旋糖酐铁混合液,含铁浓度(LIC)依次为25.0000、12.5000、6.2500、3.1250、1.5625和0mg/mL,3帧图像对比,同一试管内的信号强度无明显差异。a) 200mA; b) 320 mA; c) 485 mA。
结 果
ANOVA分析结果显示,三种管电流条件下测量的VIC值的组间差异无统计学意义(F=0.001,P=0.999>0.05)。
不同管电流条件下VIC与LIC的相关和回归分析结果见表1。Pearson分析结果显示,不同管电流条件下VIC与LIC均呈高度正相关,相关系数(r)值均为0.998(P<0.001)。散点图显示VIC与LIC呈线性相关关系(图2),运用回归分析可获得相应的线性方程。

表1 不同管电流下肝脏铁沉积LIC与VIC相关与回归分析
讨 论
铁是生物体内必需的微量元素之一,是氧转运蛋白及众多代谢、氧化还原反应酶的重要组成部分[5],肝脏通过分泌铁调素(Hepcidin)调节铁浓度,以保持体内铁的稳态,当铁调节通路破坏后,铁稳态被打破,导致铁在体内过度沉积,即铁过载[1,3]。临床上常见于地中海贫血、溶血性贫血、铁粒幼细胞性贫血、长期输血、慢性肝病等,其机制是获得性红细胞生成障碍或无效造血、导致肠道铁吸收过多,或需要长期输血而摄入大量铁、导致体内铁过载[3]。1997年美国血液病协会去铁治疗指南中指出,LIC>3.2 mgFe/g可开始去铁治疗,而LIC>15 mgFe/g则是需进行强化去铁治疗的阈值[6]。2002-2008年美国国家癌症综合网(National Comprehensive Cancer Network,NCCN)公布多个国家和地区关于长期输血后铁过载的处置指南,建议指出:对依赖于长期输血的患者,在输注压积红细胞达到120 mL/kg、血清铁蛋白(serum ferritin,SF)水平持续超过1000 ng/mL时应开始去铁治疗[7]。因此精确评估铁过载患者体内的铁浓度是指导去铁治疗的关键,能避免去铁不充分或过度去铁。
目前,诊断铁过载主要有以下方法:①SF,能间接反映体内储存铁的水平,具有简单便宜、可重复检查的优点,在临床上被广泛应用;但SF极易受酗酒、炎症、肝病、肿瘤和溶血等因素的影响,特异性不高,不能准确定量评估脏器铁过载情况[8]。②肝穿刺活检标本铁染色检查,是获得肝组织内铁浓度的最直接方式,优点在于能半定量地反映肝脏铁含量,而且可以了解铁过载所造成的肝组织损伤程度;但其为有创检查,因穿刺部位的不同而可能导致检测结果波动较大,可重复性差、难以用于纵向随访观察和评估疗效,更重要的是铁过载患者往往合并血小板减少、具有出血倾向,肝穿刺活检为其禁忌证。③超导量子干涉仪(superconduc-ting quantum interference device,SQUID),是一种无创性评估肝组织内铁含量的影像学方法,主要通过测量肝脏的磁化率来评估肝组织的铁浓度,其测量结果与穿刺活检获取的LIC之间具有非常好的相关性;但此方法的费用昂贵,而且对肥胖患者难以检测,到目前为止,世界上仅数家机构具有该设备,难以在临床上推广[9]。④MRI测量肝组织的R2/T2、R2*/T2*值来评估肝内铁含量。基于R2值测量肝内铁含量的方法是以St Pierre建立的FerriScan MR铁定量分析软件为代表,他采用SSE序列进行肝脏铁定量测量的临床研究后建立了基于R2值测量LIC的曲线方程[10],并以商业付费模式提供服务,其缺点主要是后处理费用昂贵、图像采集时间较长(10~20 min)和报告时间相对较长。此后其他学者通过CPMG回波链序列进行肝脏铁含量的定量研究[11]。基于R2*弛豫肝铁定量的方法是基于梯度回波序列设计的,能够一次屏气完成全肝扫描,R2*与LIC呈线性相关,且基于R2*肝脏铁定量测量中受到扫描参数设定的影响和脂肪因素干扰等混杂因素的影响,但都能被矫正[12],但其局限性在于重度铁过载(LIC>30 mg Fe/g)时信号快速衰减、难以采集到信号衰减的过程,而导致其对重度铁过载患者的LIC评估精确性下降[4]。但基于肝脏R2弛豫测量LIC的方法仍然存在共同的局限性:在较高LIC时肝脏R2值增加的程度相对较少,使得对重度铁过载患者的评估精确性明显下降[4];且SSE序列扫描时间较长,因此受到运动伪影的影响较大。⑤磁敏感加权成像(susceptibility weighted imaging,SWI)、定量磁敏感图(quantitative susceptibility mapping,QSM)和增强梯度回波T2*加权血管成像序列(enhanced gradient echo T2star weighted angiography,ESWAN)均为磁敏感技术逐步发展衍生而来的磁共振成像技术,ESWAN序列相较于SWI有更高的图像信噪比,QSM序列利用预处理后的局部场图相位信息, 并通过进一步反演计算得出每一个体素内的内在磁化率,从而反映组织内铁含量[13-15]。它们在颅脑的运用比较成熟, 但在肝脏的应用仍处于实验阶段,仅见少量研究报道并认为SWI相位值可对LIC进行评估[16],但没有得到临床研究证实。
CT作为肝脏常用影像学检查方法,已经在临床上广泛使用。铁为原子序数较高的物质,当铁沉积于肝脏时,导致肝脏的CT值升高,当CT平扫显示肝脏CT值>72 HU时应怀疑铁过载的存在[17],但CT值的增加并不是铁过载的特异性表现,肝脏铜沉积也可导致其CT值增加,且通过CT值增加来反映铁沉积并不准确,因为易受脂肪变性、糖原沉积和贫血等因素的影响[18]。双能CT被研究者誉为近年来放射学史最令人激动和最有发展前途的技术。经典的双能CT基于高低两种不同能量(80 kVp和140 kVp)同时或几乎同时的采集,利用物质在不同X线能量下吸收能力的不同来提供比常规CT更多的成像参数和信息,既显示形态学改变,又能量化反映组织在能量学范畴的差异,提供诸多反映病灶本质特征的量化指标[19],进而实现对不同组织和器官中物质的分离和鉴别。
目前投入临床使用的双能CT机,包括双球管的双源双能CT、单球管高低电压快速瞬时切换的能谱CT以及双层探测器的光子CT。本研究中采用80/140 kVp管电压快速瞬时切换的单球管能谱CT,管电流分别设置为200、320和485 mA,对标准体模进行扫描。此标准体模内不同试管中分别充满铁浓度(LIC)为50.000、25.000、12.500、6.250、3.125和0 mg/mL的正常大鼠肝脏组织匀浆与右旋糖苷铁的混合溶液。本组研究结果显示,不同管电流(200、320、485 mA)条件下测量的VIC与LIC均呈高度正相关,且不同管电流条件下测量的VIC的差异无统计学意义(P=0.999,F=0.001),散点图显示VIC与LIC呈线性相关关系,并拟合线性方程。本组结果证实采用双能CT物质分离技术可以特异性反映肝脏铁含量,实现铁含量的准确测量。其原因在于:在80和140 kVp两种能量下,不同物质的X线衰减系数各不相同,衰减曲线也不同,理论上讲,任意物质的衰减曲线可用另外两种其它物质的衰减来表达,当这另外两种物质成为基物质对,通过这两种基物质的组合来产生相同的衰减效应,从而可将不同的物质分离。基物质对不代表确定物质的真实物理组成,不是确定某种物质,只是对所需检查物质的成分的一种相对的表达[20-21]。最早Goldberg等[22]对血色病狗模型的肝脏进行双能CT(80/120 kVp)扫描,同时设计一系列梯度浓度的右旋糖酐铁溶液模型,获得铁浓度与双能量CT差值的线性关系,结果显示狗模型的肝脏铁含量测量值与肝穿刺活检结果一致性很好。此后,双能CT作为一种新型、无创性定量测量肝脏铁含量的方法引起了广泛关注。Fischer等[23]的离体研究证明,应用双能CT物质分离法,测量伴不同比例脂肪沉积的含铁溶液体模中的铁含量,结果显示该方法可以特异性反映肝脏的铁含量,实现对铁含量的准确测量。
综上所述,本研究通过制作正常大鼠肝脏铁沉积模型(其肝铁浓度涵盖了临床上不同程度的铁过载状态),得出了双能量CT物质分离技术可用于定量评估不同程度的肝脏铁沉积的结论,相应线性方程在重度铁过载患者中也同样适用,为临床无创性评估铁沉积的严重程度、长期输血患者铁过载的诊断及指导去铁治疗和疗效评估奠定基础。