扩散张量成像鉴别子宫肉瘤和变性子宫肌瘤初探
牛淼, 刘爱连, 田士峰, 徐明哲, 张钦和, 宋清伟
注:#数据符合正态分布,采用均数±标准差表示;△表示数据不符合正态,采用中位数±四分位间距表示。
子宫肉瘤(uterine sarcoma,US)和变性子宫肌瘤(degenerative uterine fibroids,DUF)是两种预后完全不同的女性生殖系统肿瘤,由于二者的MRI表现十分相似,鉴别诊断相对困难。扩散张量成像(diffusion tensor imaging,DTI)技术不仅可以反映水分子自由扩散速率,还可以描述水分子扩散运动的方向。目前,DTI技术已经在很多疾病中得到广泛应用[1-6],但对US和DUF的鉴别还未有相关报道,故本文对DTI定量参数在两种疾病中的鉴别诊断价值进行了初步分析,旨在进一步提高对子宫肿瘤性病变的影像诊断水平。
材料与方法
1.研究对象
回顾性分析本院2008年9月-2017年2月经手术病理证实的14例US和30例DUF患者的病例资料。44例患者的年龄28~85岁,平均(51.9±13.5)岁。14例US中癌肉瘤9例、平滑肌肉瘤4例、间质肉瘤1例;30例DUF中透明变性28例、黏液变性1例、非典型平滑肌瘤1例。
2.扫描方法及参数
使用GE 1.5T Signa HDXT MR扫描仪及体部8通道相控阵线圈。所有患者行T1WI、T2WI、DWI、DTI和LAVA序列多期增强扫描,各序列扫描参数如下。①横轴面T1WI:TR 680 ms,TE 10 ms,激励次数2.0,矩阵320×192,扫描时间1 min 37 s;②横轴面T2WI:TR 5660 ms,TE 88.4 ms,矩阵288×224,激励次数3.0,扫描时间3 min 13 s;③矢状面T2WI:TR 3980 ms,TE 91.8 ms,矩阵256×224,激励次数3.0,扫描时间2 min 55 s;④横轴面DWI:b值取0和600 s/mm2,TR 3725 ms,TE 71.1 ms,矩阵128×128,激励次数6.0,扫描时间约1 min 15 s;⑤矢状面DWI:b值取0和600 s/mm2,TR 3800 ms,TE 70.9 ms,矩阵128×128,激励次数6.0,扫描时间约1 min 15 s;⑥横轴面平面回波序列DTI:在6个正交方向施加扩散梯度,b=0、600 s/mm2,TR 4400 ms,TE 84.8 ms,矩阵128×128,激励次数4.0,扫描时间约2 min 8 s。以上所有序列的扫描层厚5 mm,层间隔1.0 mm,视野30 cm×30 cm。⑦矢状面LAVA多期增强扫描:TR 3.2 ms,TE 1.5 ms,层厚3.6 mm,层间隔0.0 mm,矩阵256×192,视野35 cm×28 cm,激励次数0.69,对比剂为Gd-DTPA,经肘前静脉注射,剂量0.1 mmol/kg,注射流率2.5 mL/s。分别于注射药物后16、32、48和64 s各进行1次扫描,最后于注药300 s后行延迟扫描。
3.图像分析和测量
由两位观察者(分别具有5年和2年MR影像诊断经验的放射科医师)采用双盲法对图像进行分析和测量。将DTI和DWI图像传至ADW4.6工作站,应用Functool软件对图像进行后处理,生成DTI的ADC(ADCT)和FA图及DWI的ADC图。在ADCT、FA和ADC图中选取相同层面、相同位置在US及DUF病灶的实质部分勾画相同大小的感兴趣区(region of interest,ROI),注意避开T1WI、T2WI及LAVA增强序列上所示的坏死、囊变和出血区,ROI面积大于病灶实质部分的1/3,分别测量3个ROI的ADCT、FA和ADC值(图1~2)。
4.统计学分析
使用SPSS 17.0软件进行统计学分析。使用Spearman相关性分析比较两位观察者测量值间的一致性,相关性>0.75为良好,达到这一标准时则采用两位观察者测量数据的平均值进行后续的分析。符合正态分布的数据用均值±标准差的形式表示,并进行独立样本t检验;不符合正态分布的数据采用中位数±四分位间距来表示,并进行Mann-Whitney U检验。使用受试者工作特征(ROC)曲线分析ADCT、FA和ADC值对鉴别US与DUF的诊断效能。
结 果
1.一般情况的比较
14例US患者的年龄为49~85岁,平均(67.4±9.5)岁;30例DH患者的年龄为28~61岁,平均(44.7±7.8)岁。两组患者年龄的差异有统计学意义(P<0.001),子宫肉瘤患者的平均年龄大于变性子宫肌瘤患者。
2.两位观察者测量数据的一致性
两位观察者所测得的ADCT、FA和ADC值及相关性检验结果见表1。两位观察者间各参数测得值的相关性良好(相关性均>0.75),故采用两位观察者测量数据的平均值进行后续的分析。

图1 患者,女,65岁,子宫癌肉瘤。a) FSE T2WI示子宫内类圆形病灶呈稍高信号(箭); b) DWI示病灶呈明显高信号; c) ADC伪彩图,显示病灶的ADC值较低(大部分区域呈绿色); d) DTI示病灶呈高低混杂信号; e) ADCT伪彩图,显示病灶的ADCT值较低(呈蓝绿色); f) FA伪彩图,显示病灶的FA值较低(大部分区域呈蓝绿色)。
3.两组病灶ADCT、FA和ADC值的比较
两组病灶的ADCT、FA和ADC值的测量值及统计分析结果见表2。US的ADCT、FA及ADC值均低于DUF,差异均有统计学意义(P<0.05)。

表2 两组病灶ADCT值、FA值、ADC值的比较
注:#数据符合正态分布,采用均数±标准差表示。ADCT单位为×10-9mm2/s,ADC的单位为×10-3mm2/s;△表示数据不符合正态,采用中位数±四分位间距表示。
4.ADCT、FA和ADC值的诊断效能
ADCT、FA和ADC值诊断US与DUF的ROC曲线分析结果见表3、图3。ADCT值的曲线下面积(area under curve,AUC)以及诊断敏感度和特异度均大于ADC值,ADCT值较ADC值具有更高的诊断效能。

表3 ADCT、FA和ADC的诊断效能指标值
注:#单位为×10-9mm2/s,△单位为×10-3mm2/s。
讨 论
在女性生殖系统恶性肿瘤中,US较少见,约占1%,在子宫恶性肿瘤中占3%~9%,好发年龄的中位数为50岁[7]。US的组织学分类主要包括癌肉瘤、平滑肌肉瘤、内膜间质肉瘤和未分类肉瘤,其中癌肉瘤是最常见的亚型,其次是平滑肌肉瘤[8]。由于不同组织学分类的肿瘤成分不同,因此在MR图像上表现各异[9-12],这可能与肿瘤是否分泌黏液以及出血、坏死和囊变有关,肿瘤血供丰富,因此增强扫描时多呈明显不均匀强化。子宫肌瘤是最常见的一种女性生殖器官良性肿瘤,发生于育龄期妇女较多,发生率为20%~30%[7-8],发病年龄多为30~50岁。当肌瘤发生变性时,其组织学分类主要包括透明变性、黏液变性、囊性变性、红色变性、钙化以及肉瘤样变性[13],其中最常见的是透明变性[14],肉瘤样变性的恶变率为0.4%~0.8%[15]。不同分类的病变在影像表现上略有差别[16],因黏液变和透明变导致肿瘤内含有粘多糖和蛋白质,故这两类病变的MR信号表现多样。
由于US和DUF的组织学分类多样,故两者的鉴别诊断存在一定的难度,尤其是对于早期无特异症状的US患者,临床上常常发生误诊,术前诊断符合率仅为30%~39%[13],既往也有将DUF误诊为US的文献报道[17]。在病理学上,几种分类的DUF也常常被误诊为US[14],但两种病变的治疗及预后完全不同,因此鉴别诊断极为重要。
常规DWI序列的ADC值可以用来鉴别这两种疾病,其中US的ADC值均小于DUF[18-23]。在本研究中,US和DUF的ADC值分别为(1.118±0.238)和(1.522±0.189)×10-3mm2/s,US的ADC值低于DUF,与以往研究中的测量结果一致。DTI是在DWI基础上改进和发展的一项新的功能成像技术,能反映活体组织中不同结构导致的水分子自由扩散速率以及方向的变化,并通过计算机处理转变为图像和多个定量参数[24]。DTI的多个量化指标中,常用的参数包括ADCT及FA值。其中,ADCT值反映水分子扩散运动状况的改变,描述水分子的运动速度,与水分子受限程度呈负相关。ADCT值不仅受细胞大小、数目、排列方式及细胞外间隙的影响,还与核浆比、细胞器数目及微循环有关。根据以往的研究结果,恶性肿瘤由于细胞密集、细胞外间质少、细胞核大、深染和异形性高,细胞内和细胞外的水分子扩散空间减小,ADCT值降低。而良性病变内细胞相对稀疏,水分子扩散空间大,故其ADCT值较高。US在组织学上可见细胞密集,细胞外间隙少,核浆的比例高;而DUF内含有较多囊变、出血成分,导致水分子扩散受限程度低,故其ADCT值高于US。
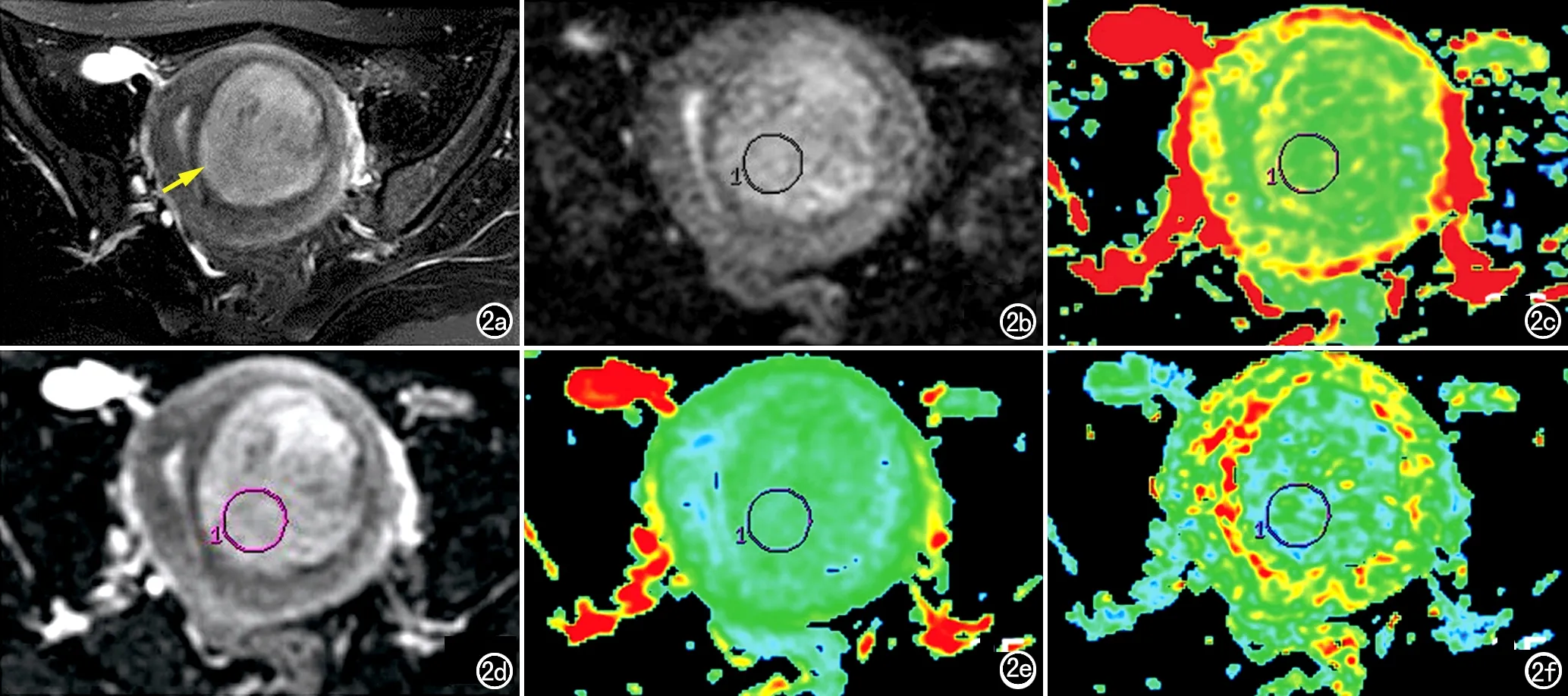
图2 患者,女,27岁,子宫肌瘤透明变性。a) FSE T2WI显示病灶呈稍高混杂信号(箭); b) DWI示病灶呈稍高信号; c) ADC伪彩图,显示病灶内呈混杂信号,图中红色、黄色代表高ADC值,绿色、蓝色代表低ADC值; d) DTI显示病灶呈高低混杂信号; e) ADCT伪彩图,显示病灶内呈混杂信号,图中红色、黄色代表高ADC值,绿色、蓝色代表低ADC值; f) FA伪彩图,显示病灶内呈混杂信号,图中红色、黄色代表高ADC值,绿色、蓝色代表低ADC值。

图3 ADCT、FA和ADC值鉴别,US与DUF的ROC曲线图,ADCT值的AUC最大,提示其诊断效能最高。
FA值代表水分子扩散的各向异性,反映水分子运动的方向性,能够描述水分子在三维空间的扩散方式。FA值的大小与扩散方向的异性程度呈正相关(FA=0~1)[25],FA值趋于0表示扩散趋于各向同性,而FA值趋于1表示扩散趋于各向异性。当病变组织结构、细胞密度或细胞内核/浆比例发生改变时,水分子的扩散运动就会发生变化。因此,可利用DTI测量组织内水分子的扩散运动情况,进而反映病变组织与正常组织的差异,为疾病的诊断提供更多信息。本研究中US的FA值(0.168±0.063)低于DUF(0.254±0.111)。可能是由于子宫肌瘤是由平滑肌细胞和胶原纤维构成,剖面上肌瘤呈旋涡状或编织状结构,DUF内虽然发生了变性改变,但大部分组织内仍保持旋涡状或编织状结构,水分子会沿着旋涡状或编织状结构走行,因此水分子扩散运动的各向异性较大[26],即FA值较大。而对于US,细胞密集,水分子运动大多沿着细胞间隙走行,具有较一致的方向性,因此FA值会偏低。DTI和DWI定量参数中,ADC值都是反映水分子的扩散情况,但DTI中的FA值是DWI没有的,其代表水分子在三维空间运动的方向性,因此DTI的ADC值是三维空间的向量和,而DWI中的ADC值是平面向量和,故DTI中的ADC值能更准确的反映水分子的扩散情况[27]。对定量参数鉴别US与DUF的诊断效能进行ROC曲线分析,结果亦显示DTI的ADCT值的敏感度和特异度(分别为96.7%、92.9%)较DWI的ADC值(分别为78.6%、90.0%)要高,AUC更大,诊断效能更高。
本研究存在的不足之处:①病例数较少,有待增加样本量进行更深入的分析,提高统计分析结果的可靠性;②不同病理类型的子宫肉瘤和变性子宫肌瘤混合讨论,对结果也许有一定影响;③对DTI和DWI数据的分析采用的是不同的后处理软件,不能保证ROI完全在同一位置。
综上所述,对于US和DUF的鉴别诊断,DTI及DWI扫描序列有重要作用,两种方法都能够在无需应用对比剂的条件下,利用重建图像得出的定量参数值ADCT、FA和ADC来有效鉴别US与DUF,而其中DTI的ADCT值较DWI的ADC值具有更高的诊断效能,说明DTI扫描技术具有更好的诊断准确性,为鉴别两者提供了一种安全可行的评估方法,具有很好的研究及临床应用前景。