肾上皮样血管平滑肌脂肪瘤(长径≤3 cm)的影像诊断
罗敏, 蔡文超, 张玮, 包强
肾上皮样血管平滑肌脂肪瘤(renal epithelioid angiomyolipoma,EAML)是血管平滑肌脂肪瘤(angiomyolipoma,AML)的一种罕见亚型,主要由增生的上皮样细胞构成,同时具有经典型AML的三种成分[1-2],可呈浸润性破坏性生长,具有恶性潜能。大部分肾脏 EAML缺乏脂肪成分,影像学表现不典型,术前常被误诊为肾癌、肉瘤或乏脂肪型AML等,尤其是长径≤3 cm的EAML,因其内畸形血管较小、脂肪成分较少,在影像学上不容易显示 ,且液化、坏死及囊变少见,更增加了术前诊断的难度。本文回顾性分析了23 例肾脏 EAML患者(27个病灶,长径≤3 cm)的影像及临床病理资料,总结其影像表现和鉴别诊断要点,旨在提高对EAML的早期诊断准确性。
材料与方法
1.临床资料
搜集2009年7月-2017年12月在本院经手术病理证实为肾脏 EAML(长径≤3 cm)的23 例患者(共27个病灶)的影像及临床病理资料。其中,男11例,女12例,年龄20~80岁,平均43.5岁,中位年龄45.0岁。3例因腰痛、1例因血尿就诊,其余19例患者均无明显临床症状,为体检或因其它疾病就诊而偶然发现。23例患者均行超声及CT平扫和增强检查,6例行MRI平扫及多期增强扫描。所有病例均经手术病理证实,19例为单发病灶,3例为单肾2个小病灶,1例为结节性硬化患者,同侧肾有2个较小的及1个较大的EAML;3例合并较大的经典型AML,1例合并同侧肾透明细胞癌(2个小病灶),1例合并同侧肾透明细胞癌及小囊肿(各1个病灶),2例合并同侧肾脏多发结石。
2.检查方法
MRI检查:使用Siemens Verio 3.0T 或Aera 1.5T MR扫描仪。患者取仰卧位,扫描范围自膈面至肾下极下方2 cm水平,扫描序列包括横轴面平扫屏气双回波T1WI、脂肪抑制序列T2WI和呼吸导航DWI以及冠状面FSE T2WI,层厚4 mm,间隔0.8 mm。动态增强扫描采用脂肪抑制序列T1WI(层厚3 mm,间隔0.6 mm),对比剂为Gd-DTPA,剂量0.2 mmol/kg,总量15~20 mL,采用高压注射器以3.5 mL/s的流率注射,随后用0.9%氯化钠溶液20 mL冲管,分别在注射开始后15、35、55和90 s及3和5 min进行皮质早期、皮质晚期、皮髓质交界期、实质期、肾盂期和延迟期扫描。
CT检查:23例患者均行MDCT平扫及四期增强检查。使用Siemens sensation 64、Definition 双源或 Somatom ForceCT机和后处理工作站。扫描参数:120 kV,200~350 mA,层厚3 mm,0.5 s/r,螺距1.2,床速为50.0 mm/s,标准重建算法,在屏气状态下自肝门水平至肾下极下方2 cm水平进行容积扫描。先进行CT平扫,然后使用高压注射器经肘静脉注射碘对比剂(碘海醇)50~60 mL,注射流率3~4 mL/s,分别在注射后25、50~70、300和600 s进行肾皮质期、实质期、肾盂期及延迟期扫描。将扫描数据按1.0 mm层厚重建后传输至工作站进行后处理和分析。
B超检查:使用Philips IU22彩色多普勒超声诊断仪和C5-2探头,造影技术为脉冲多序列成像技术,造影剂为SonoVue(Bracco公司)。实时灰阶超声造影方法:常规超声扫查患者双肾,发现可疑病灶后转换为造影制式,经前臂浅静脉团注造影剂,总量为2~4 mL,浓度为5 mg/mL,随后注射5 mL生理盐水冲洗套管。参数测量由一位有经验的超声科副主任医师进行。
3.影像分析
由2位有多年腹部疾病诊断经验的放射科副主任及以上医师对所有患者的影像学资料进行双盲法分析,主要分析病灶的具体部位、形态、大小、密度/信号、强化方式和程度(包括时间-信号强度曲线)等,最后将诊断结果与手术病理结果进行对照,分析误诊病例的影像学征象并形成一致意见。
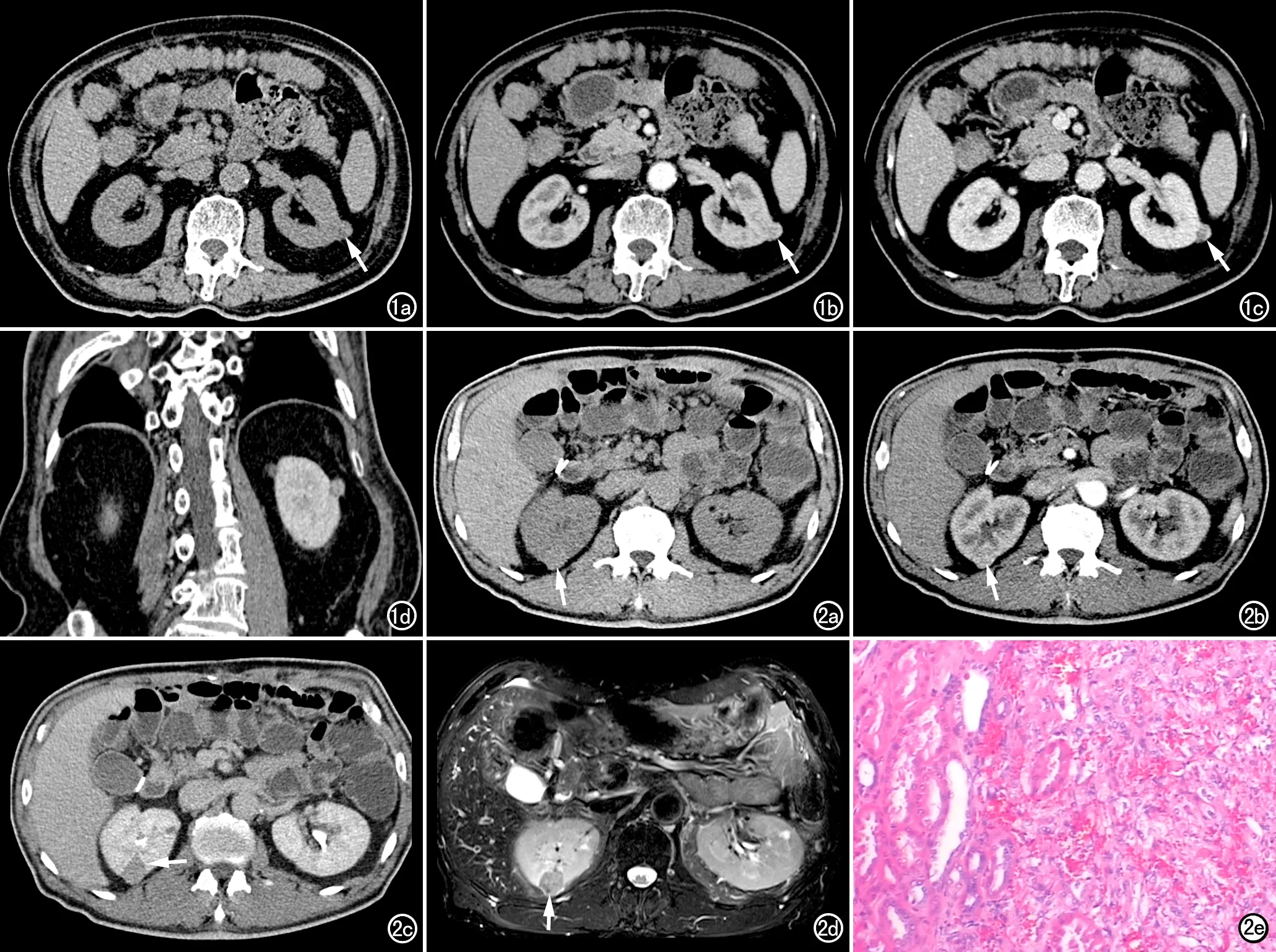
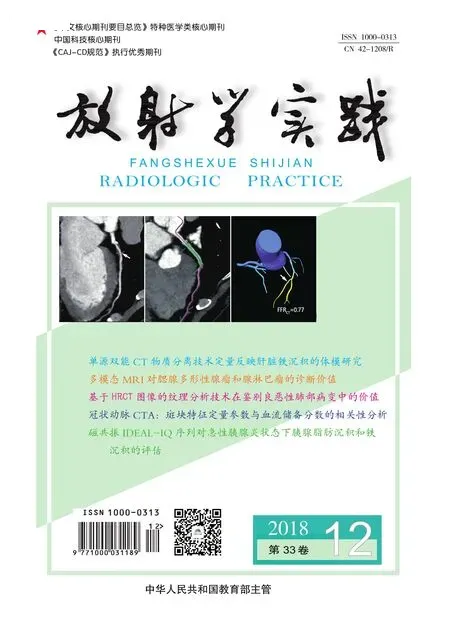
图1 男,78岁,左肾乏脂肪型EAML。a) CT 平扫示左肾皮质内类圆形等低密度肿块(箭),大部分突出于肾轮廓外; b) 增强扫描肾皮质期,肿块边缘明显强化,可见“皮质掀起征”及“边缘强化征”(箭); c) 增强扫描肾实质期,示肿块不均匀强化(箭),边缘呈等密度,其内呈相对低密度,呈流出型强化; d) 增强扫描肾实质期冠状面重组图像,肿块内可见“条索征”及“黑星征”(箭)。图2 男,62岁,乏脂肪EAML。a) CT 平扫示右肾包膜下肾皮质内肿块呈等或稍高密度(箭),病灶主体位于肾轮廓内; b) 增强扫描肾皮质期,示肿块不均匀明显强化(箭); c) 增强扫描肾盂期,示肿块的密度明显低于肾实质,呈流出型强化,并可见“劈裂征”(箭); d) T2WI示右质期冠状面重组图像,示肿块内可见“条索征”(箭); e) MR脂肪抑制序列肾皮质期T1WI,显示病灶位于右肾髓质,呈明显不均匀强化(箭) 。
4.统计学分析
以正常肾皮质的信号强度/密度为参照,采用目测法、CT值测量或时间-密度/信号强度曲线来评估各病例的影像学表现。计数资料的描述采用频率及百分比。
结 果
1.影像学表现
23例患者共27个病灶中,位于包膜下肾皮质19个,其中16个病灶的主体位于肾轮廓外(图1),3个病灶的主体在肾轮廓内(图2);位于肾实质邻近包膜及肾窦旁4个(图3),肾髓质2个(图4),肾窦旁2个(图5)。病灶大小:2个病灶的长径<1.0 cm,15个病灶的长径为1.0~2.0 cm,10个病灶的长径为2.0~3.0 cm。形态:4个病灶呈不规则形、与肾实质分界欠清晰, 23个病灶呈类圆形或类椭圆形、与肾实质的分界清晰。
超声表现:27个病灶中,表现为高低混杂回声18个,等回声2个,低回声3个,高回声4个。超声造影显示25个病灶表现为流出型强化,2个呈流入型强化。
CT表现:平扫显示6个病灶内有明显的脂肪密度,21个病灶内无明显脂肪成分,其中呈等及稍高密度20个、等密度1个;增强扫描显示呈流出型强化24个,平台型1个,流入型2个;病灶内可见“皮质掀起征”(图1b)16个,“黑星征”(图3b)9个,“劈裂征”(图2c)10个,“条索征”(图4d)19个,“边缘强化征”(皮质期)16个,出血灶1个,粗大血管2个,侵犯肾被膜1个。
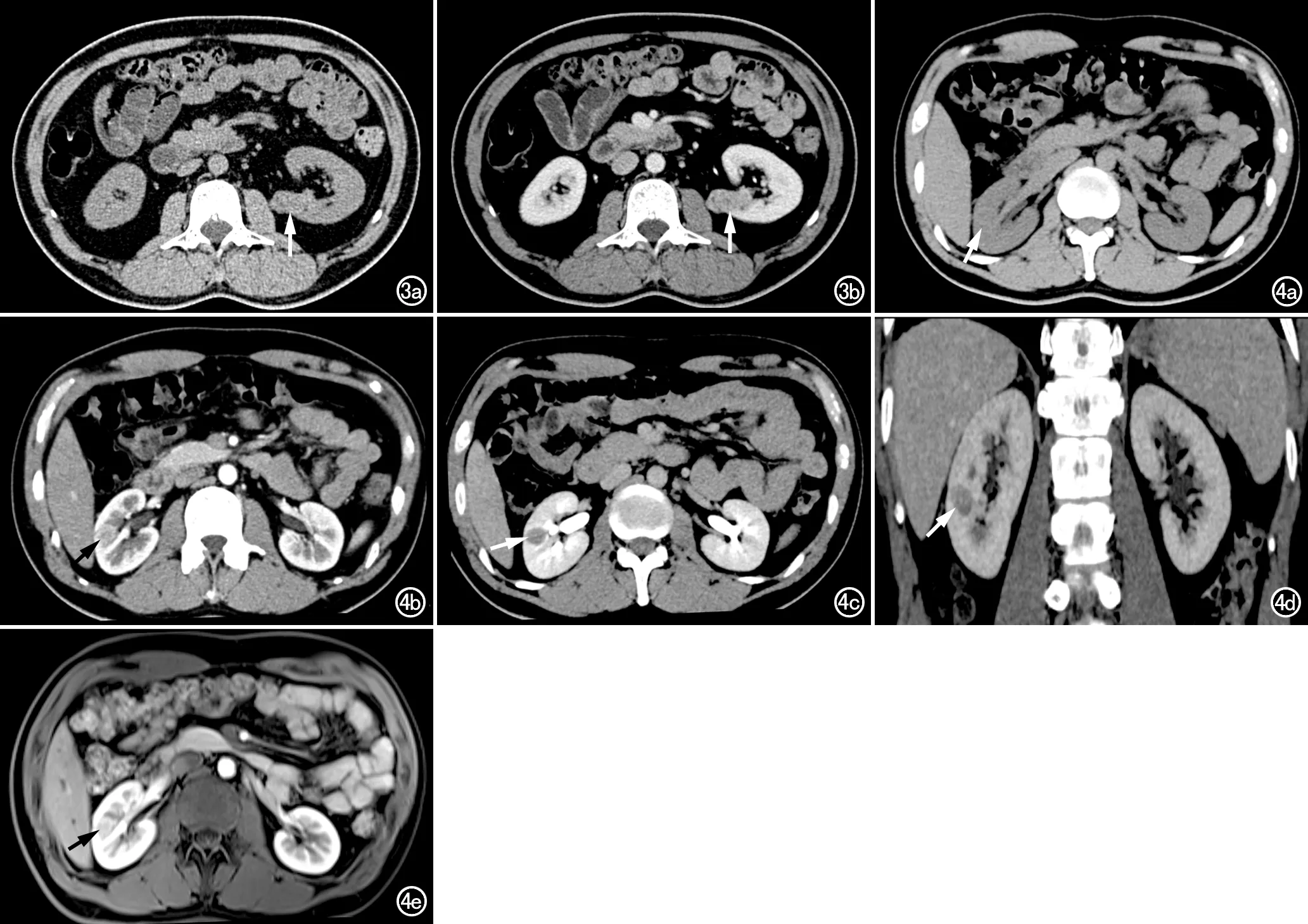
图3 女,45岁,左肾乏脂肪型EAML。a) CT平扫示左肾实质内不规则形等~低密度肿块(箭),部分突向肾轮廓外,部分向肾窦生长; b) 增强扫描肾实质期,示肿块不均匀明显强化,可见“黑星征”(箭)。图4 男,33岁,右肾髓质内乏脂肪型EAML。a) CT平扫示右肾髓质内等密度肿块(箭); b) CT增强扫描肾皮质期,示肿块呈明显不均匀强化(箭); c) CT增强扫描肾盂期,示右肾肿块(箭)的密度明显低于肾实质,呈流出型强化; d) CT肾皮肾皮质区肿块呈高低混杂信号(箭); e) 病理片镜下示肿瘤细胞呈上皮样, 圆形或多边形,胞浆丰富,核仁明显(×200,HE)。
MRI表现(6例):病灶在T1WI 上呈等低混杂信号3个,呈高低混杂信号3个,反相位上1个病灶边缘信号较同相位减低。T2WI上呈等低信号5个,等高信号1个。增强扫描显示5个病灶在皮质期有明显强化(低于或接近于肾皮质),实质期强化减退,肾盂期低于肾实质信号,呈流出型强化方式(图2);1个病灶在皮质期、实质期呈轻度强化,肾盂期仍持续强化,呈平台型强化方式(图5);6个病灶的内部或周边均未见粗大的畸形血管,可见边缘包膜样或中央条索样强化4个。
2.病理表现
大体标本可见肿瘤边界较清晰,无包膜,切面呈黄色或红褐色。镜下可见肿瘤由厚壁扭曲血管、平滑肌细胞及不同比例的成熟脂肪细胞构成,6个病灶以脂肪成分为主,21个病灶内脂肪成分较少;肿瘤细胞呈上皮样,圆形或多边形,胞浆丰富,核仁明显,1例可见核分裂像,22例有轻度核异形性,1例的核异形性明显,1例有少量出血,1例有肾静脉瘤栓。16例行免疫组织化学检测,显示15例的HMB45 和 Melan-A阳性, CK及EMA阴性, 12例SMA阳性, 16例的Ki67均呈低表达。
3.3种检查的术前诊断情况
病灶长径<1.0 cm组(2个):B超检查均漏诊;CT检查将1个病灶误诊为肾癌,1个病灶诊断为AML;其中仅1个病灶进行了MRI检查,被误诊为肾癌。病灶长径为1~2 cm组(15个):B超诊断为AML6个,误诊为肾癌9个;CT检查误诊为肾癌2个,2例误诊为复杂性肾囊肿,诊断为AML 11个(其中2个诊断为EAML);MRI检查3个病灶,均诊断为AML(其中2个诊断为EAML)。术前B超、CT及MRI诊断符合率依次为40%(6/15)、73.33%(11/15)及100%(3/3)。病灶长径>2.0 cm组(10个):B超检查诊断为AML 6个,误诊为肾癌4个;CT检查诊断为AML 8个,误诊为肾癌2个;MR检查了2个病灶,均诊断为AML(其中1个诊断为EAML)。术前B超、CT及MRI诊断为AML的符合率依次为 60%(6/10)、80%(8/10)及100%(2/2)。
讨 论
1.肾EAML的病理学特点和临床特征
2004年版WHO泌尿系统肿瘤分类中将AML分为经典型和EAML[3]。经典型AML是由增生的厚壁血管、成熟的脂肪组织和平滑肌细胞三种成分按不同比例构成,EAML是以增生的上皮样平滑肌细胞为主,可同时具有经典型AML的3种成分,属于具有血管周上皮样细胞分化特点的肿瘤(perivascular epithelioid cell neoplasm,PEComa)中的一种,具有恶性潜能,可浸润生长和转移,但恶性少见,缺乏明确的诊断标准[4]。 EAML大体标本:肿瘤多质软、质中、边界清楚,无包膜,淡黄色或红褐色,切面可见局灶性脂肪组织,部分病灶可见囊变、钙化、出血和坏死。镜下可见瘤组织主要为上皮样细胞、厚壁血管、平滑肌细胞和脂肪细胞,上皮样细胞呈梭形或多边形,沿血管周围生长,部分细胞有异形性。2005年,Folpe等[5]首次提出关于恶性PEComa的诊断标准:①肿瘤直径大于5 cm;②呈浸润性的生长方式;③高核级及细胞密度丰富,可见非典型性核分裂象;④核分裂象大于1/50高倍镜视野;⑤可见凝固性坏死和血管、淋巴管侵犯。新版WHO(2013年)软组织与骨肿瘤分类中明确了恶性病变的诊断标准,即核分裂活跃、坏死和异形性明显、多形性,符合以上3项或以上者则可判定为恶性PEComa[6]。肿瘤的免疫组织化学特点为黑色素细胞标记物HMB45、Melan-A和平滑肌标记物 SMA阳性,Ki67低表达,而上皮细胞标记物CK、EMA阴性[4], 本组病理表现部分与文献报道一致, 15例(15/16)的 HMB45及Melan A为阳性,上皮细胞标记物CK和EMA均为阴性,SMA阳性12例,16例Ki67均为低表达。但本组病例中仅有1例发现有肿瘤出血,未见瘤内发生坏死、囊变及钙化的病例,且畸形血管较小,与文献报道不相符。笔者分析原因认为,可能因本组患者的肿瘤较小,均为3 cm以下,且多数病例以上皮样增生的平滑肌细胞为主,血管较细小,不容易发生缺血、坏死、囊变及钙化。本组23例中只有1例显示细胞核明显异形性并伴有肾静脉瘤栓,可见恶性EAML少见,与文献报道相符合。
强化为主,其信号强度与肾皮质相似; d) 增强扫描肾实质早期,显示肿块强化程度减退; e) 肾实质晚期,显示肿块强化程度明显减退,信号低于肾实质,呈流出型强化。
图5 男,40岁,左肾窦旁乏脂肪型EAML。a) 冠状面T2WI示左肾窦区不规则形肿块,呈等低混杂信号(箭); b) 脂肪抑制序列平扫T1WI,显示示左肾窦区肿块呈等~低信号(箭); c) 增强扫描肾皮质期,示肿块不均匀明显强化,以边缘
EAML主要发生于肾脏,约占肾AML的7.7%,其次是肝脏、盆腔和卵巢,也可见于淋巴结及腹膜后[7-8],患者通常无特异性临床表现,大多为偶然发现,临床上以女性患者、单发病灶多见。本组23例EAML(长径≤3 cm)中19例无明显症状而为体检发现,4例因合并结石、肾癌及较大AML压迫肾被膜出现相应症状而就诊时;以女性多见(12/23),单肾单发多见(15/23),良性多见(26/27),这些特点与文献报道基本相符。肾EAML合并结节性硬化的概率要比经典型AML高[9],临床上以癫痫发作、智力发育障碍和面部血管痣为其三大特征,常双侧多发,病灶一般较小,国内文献报道中此种类型比较少,本组病例中仅1例(同侧肾2个小EAML及1个大EAML)合并结节性硬化,这可能与本组病例数较少有关。
2.影像学表现与病理特点的对照分析
近年来关于EAML影像表现的文献报道逐渐增多,但这些文献中报道的EAML体积较大,影像特点较容易观察,如粗大的肿瘤血管、肿瘤内缺血性坏死和囊变及边缘钙化等,而对于影像表现不典型、尤其是长径≤3 cm的肿瘤报道较少。综合分析本组EAML(长径≤3 cm)的23例(共27个病灶)的影像及病理征象并结合文献,笔者总结EAML的主要特点如下。①病灶部位、形态及生长方式:多呈圆形或类圆形(23/27),多位于肾皮质(19/27),以向肾轮廓外膨胀性生长为主(16/27),分析原因可能为肾脏肿瘤容易向阻力较小的肾轮廓外间隙生长而较少向肾实质浸润。② CT和MRI平扫表现:以乏脂肪型EAML多见(21/27),CT平扫密度稍高于或等于肾实质(21/27);MR T2WI上病灶以低信号为主,其内夹杂条索状高信号(5/6),T1WI上多呈等低混杂信号,反相位图像上部分脂肪信号较同相位减低,有学者认为与多个因素有关,主要为上皮样增生的平滑肌细胞和黑色素细胞团排列紧密所致[10],病理检查提示肿瘤组织主要由上皮样或梭形平滑肌细胞及少量厚壁血管构成,可以与经典型AML相鉴别。③强化方式:以流出型强化为多见(24/27),基本与文献报道相符合[11],其病理基础可能是肿瘤以上皮样平滑肌细胞为主要成分。 ④可见"皮质掀起征"(16/27)、“黑星征”(9/27)、肿瘤内条索征(19/27)、皮质期边缘强化征(16/27)及“劈裂征”(10/27)等,这些征象有助于明确诊断。有研究者[12]认为“皮质掀起征”和“黑星征”在EAML的诊断中具有特征性,其中“皮质掀起征”为肿瘤边缘肾皮质呈拱状高于肾轮廓线外而类似于杯口状改变或肾皮质被明显掀起,与肾癌侵犯肾被膜的表现不同;“黑星征”为肿瘤内无序排列的脂肪细胞局限性分布于肿瘤的边缘所致,皮质期及实质期较容易观察,可与脂肪丰富的经典型AML相鉴别;肿瘤内条索征病理上指瘤内的梭形平滑肌细胞及厚壁血管混合而成;皮质期边缘强化征是指被肿瘤掀起的肾皮质呈明显线样强化;劈裂征是指病灶肾内部分与肾脏交界平直, 呈尖端指向肾门的楔形改变。⑤其它征象:坏死、囊变、钙化、出血少见,恶性少见,本组27个病灶中只有1灶伴出血,术前CT漏诊,1灶侵犯肾静脉并瘤栓形成,术前CT及MR均漏诊,可能与病灶本身较小,出血及瘤栓较少,重叠所致有关,MRI肾静脉瘤栓漏诊可能与血流信号复杂有关;1例侵犯肾被膜,2例出现粗大血管,术前均明确诊断。⑥彩色多普勒超声表现:乏脂肪型EAML病灶多表现为不均匀高低混杂回声,边界较清;富脂肪型病灶多表现为高回声,边缘稍模糊,超声造影多呈流出型强化。
3.肾EAML(长径≤3 cm)的鉴别诊断
肾EAML(长径≤3 cm)主要需要与以下疾病相鉴别。①经典型AML:当EAML富含脂肪时,影像学上与经典型较难鉴别,而当EAML乏脂肪时增强皮质期或实质期仔细观察“黑星征”有利于鉴别[13-14],当EAML侵犯肾被膜、实质或静脉时则较容易鉴别。②典型或富细胞型肾透明细胞癌:典型的透明细胞癌较小时即可发生坏死、囊变,在T2WI上呈高信号,周围可见低信号假包膜,鉴别不难;但富细胞型透明细胞癌的位置多位于肾髓质,位置较深,密度或信号较均匀,T2WI上多呈均匀稍高信号,可见低信号假包膜,增强后较均匀强化,呈明显流出型强化;而EAML多呈不均匀强化,延迟期肿瘤内可见条索征,鉴别较难,需仔细多方位观察病灶的内部强化特征。③平滑肌瘤和黑色素瘤:当EAML以梭形平滑肌成分为主时,在T2WI上呈低信号,鉴别较难。但平滑肌瘤和黑色素瘤较EAML更罕见,确诊主要依赖于病理诊断。④嗜酸细胞腺瘤和嫌色细胞癌:嗜酸细胞腺瘤多位于近包膜下肾皮质,包膜较完整,病灶内信号较均匀,为富血供肿瘤,节段性强化反转有助于鉴别;较小的嫌色细胞癌与乏脂肪型EAML在CT平扫图像上较难鉴别,但增强扫描皮质期其强化程度较EAML低,延迟期其内的中央瘢痕强化程度较EAML高,无“黑星征”、“皮质掀起征”和“及边缘强化征”,T2WI上病灶多呈稍高信号,常可见低信号假包膜,鉴别不难。
4.影像学方法的选择
MDCT平扫能清楚地显示肾EAML内有无脂肪、钙化或出血,有助于与经典型AML、钙化性转移瘤和肾癌鉴别,且较小EAML内钙化、出血少见。MR T2WI上肿瘤以低信号为主,其内夹杂条索状高信号,反相(位较同相位)病灶边缘可见局灶性信号减低,流出型或平台型强化方式、CT皮质期或实质期可见“黑星征”及彩色多普勒显示肿瘤内为高低混杂信号,以上特征有助于乏脂肪EAML的诊断,高回声有助于富脂型AML的诊断。本组资料显示,影像学检查无论是B超、CT或MRI均较容易误诊或漏诊长径小于1 cm的病灶,对长径为1.0~3.0 cm的病灶,CT平扫结合多期增强扫描对多发性EAML或富脂肪型EAML的诊断符合率较高,但对单发的乏脂肪型肾EAML(长径1.0~3.0 cm)的术前诊断符合率较低,所以对于较小的肾肿瘤CT诊断和鉴别困难时,需进行MRI平扫及增强检查,仔细分析肿瘤内部的结构和信号特点、尤其是T2WI及多期强化特点,有助于提高术前诊断准确性,必要时可结合超声检查进行随访复查。