脊髓损伤患者康复过程中监测下肢深静脉血栓形成的策略研究
刘亚梅,刘 岩,毛淑芳,徐振奇
(1.承德医学院附属医院康复科,河北承德 067000;2.承德医学院附属医院神经外科,河北承德 067000;3.承德医学院基础部,河北承德 067000)
下肢深静脉血栓(deep venous thrombosi,DVT)形成是脊髓损伤(SCI)一种非常严重的并发症,当DVT在没有与周围血管发生机化而脱落时,将会发生致命性后果即肺动脉栓塞。下肢DVT的高峰期为SCI发生后第2~3周[1],此时大多SCI患者正在接受肢体康复治疗,如果康复医师忽视下肢DVT而对患者进行肢体康复锻炼,将会增加发生肺动脉栓塞的概率,威胁患者生命[2]。对于下肢DVT的检查手段有很多,包括体格检查、超声学检查和D-二聚体(D-Dimer)测定等,但国内外尚未建立公认的下肢DVT监测方法和策略[3]。本研究将D-Dimer测定与下肢深静脉彩超相结合,以期发现一种适合SCI患者在康复过程中进行下肢DVT监测的方法。
1 资料与方法
1.1 一般资料 2014年5月至2015年12月于承德医学院附属医院康复科就诊的早期SCI患者共196例,纳入标准:急性SCI患者,病程小于1周即接受住院治疗。排除标准:(1)确诊已经存在下肢DVT者;(2)住院治疗时间低于28 d者;(3)相关实验室检查结果及下肢深静脉彩超等临床资料不完整者。其中男153例,女43例;年龄15~82岁,平均(45.3±15.5)岁;颈椎损伤102例,胸椎损伤53例,腰椎损伤41例;美国脊髓损伤学会(ASIA)损伤程度分级:A级49例,B级62例,C级52例,D级33例;接受手术治疗者170例,未接受手术治疗者26例,所有患者均签署知情同意书。
1.2 方法
1.2.1 康复治疗 所有患者尽早开始下肢自主活动。给予无法进行自主活动的患者以下肢被动运动及下肢肌肉按摩。同时,佩戴颈托或者胸腰椎矫形器,进行电动起立床训练,缩短卧床时间。训练间歇期抬高下肢20°~30°,给予患者双下肢间歇性充气加压泵治疗,每次20 min,2次/天。
1.2.2 D-Dimer检测 标本采集均采用真空采血管,于清晨空腹采血,3 000 r/min离心10 min,分离血浆采用免疫比浊法测定,使用日立8180全自动生化仪及配套试剂,测定的正常参考值为小于500 μg/L。
1.2.3 DVT超声检测 所有患者每周行D-Dimer检查。如发现D-Dimer水平大于500 μg/L或出现相关临床症状(患肢疼痛、肿胀等),则立即行下肢深静脉彩超检查,下肢DVT的超声诊断标准[3]:(1)下肢静脉血管腔内有强或弱的实性回声;(2)探头加压后静脉血管腔不能被压闭或者被部分压闭;(3)血栓处脉冲和彩色多普勒超声缺乏自主性或激惹性血流;(4)血流频谱不随呼吸改变;(5)侧支静脉血流增多而管径增宽。
1.2.4 下肢DVT的监测策略 入院时对所有患者采用Autar量表评分,对所有入组患者每周行D-Dimer检查。如D-Dimer水平大于500 μg/L,则立即行下肢深静脉彩超检查,明确是否发生下肢DVT;如发现下肢DVT,则立即给予患者患肢制动,皮下注射低分子肝素 5 000 U,每天1次,并根据患者情况行其他外科治疗;如发现D-Dimer水平大于500 μg/L,而彩超检查未发现下肢DVT者,将不做特殊治疗,继续监测D-Dimer水平并密切观察患者腿部情况,且每周行下肢深静脉彩超检查;如未发现D-Dimer检查异常,患者暂不行下肢深静脉彩超检查。上述检测持续到受伤后第4周,然后D-Dimer检查改为每2周1次。所有患者入院、出院时,常规复查下肢深静脉彩超。
2 结 果
2.1 SCI患者康复过程中监测下肢DVT的策略 Autar量表评分低危组102例,中、高危组94例,共有112例患者出现D-Dimer水平大于500 μg/L,行下肢深静脉彩超示,其中55例患者下肢DVT;未发现下肢DVT的57例患者在之后的D-Dimer监测中,有29例患者D-Dimer水平呈下降趋势,20例患者D-Dimer水平出现波动,8例患者D-Dimer水平呈上升趋势,其中1例患者出现下肢DVT,SCI患者下肢DVT的发病率为28.6%(56/196)。56例下肢DVT的患者在接受正规治疗后均未发生肺动脉栓塞。在其后的复查中,有21例患者血栓消失,35例患者血栓体积不同程度减小并机化。84例D-Dimer水平小于500 μg/L的患者在出院时均行下肢深静脉彩超检查,未发现下肢DVT(图1)。D-Dimer监测假阳性率为40.0%(56/140),而阳性预测值为50.0%(56/112)。
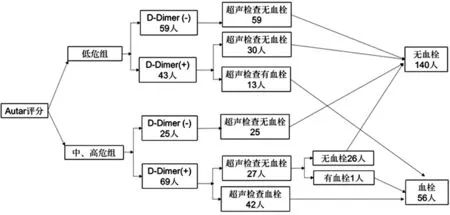
图1 SCI患者康复过程中监测下肢DVT的策略
2.2 Autar量表评分不同危险组别术后DVT发生情况比较 中、高危组Autar评分联合D-Dimer阳性患者共69例,其中43例有DVT,DVT的发生率为62.3%;低危组Autar评分联合D-Dimer阳性患者共43例,其中13例有DVT,DVT的发生率为30.2%,两组DVT发生率比较,差异有统计学意义(χ2=10.909,P=0.001),见表1。
3 讨 论
虽然目前SCI后发生DVT的形成机制还没有完全阐明,血液的停滞、血液的高凝状态和血管内皮细胞损伤在血栓的形成过程中起到重要作用[4]。SCI后,长期卧床、脊髓休克及不同程度地出现自主神经功能紊乱,出现体位性低血压、胸内负压状态改变,使血流速度缓慢,上述因素会导致下肢静脉的血液淤积[5]。同时,SCI后血小板抑制凝血酶产生和释放前列腺素的功能下降,将加重血液的高凝状态[6],穿刺操作、甘露醇等高渗性药物的使用及静脉凝血块和血管壁的炎症细胞聚集,均会引起血管内壁的损伤[7]。
可见,SCI患者极易发生下肢DVT,依据不同的报道其发病率为14%~100%[8],受患者种族、研究样本规模及是否使用抗凝药物的影响。目前普遍认为黄种人SCI后下肢DVT的发病率要低于白种人[9]。研究报道,使用与未使用抗凝药物的SCI患者,其下肢DVT的发病率分别为27.6%和5.4%[8,10]。目前,对于我国SCI患者下肢DVT的发病率尚缺乏大样本的系统研究。马玉娟等[11]报道,SCI患者下肢DVT的发病率为18.3%(9/49)。本研究中SCI患者下肢DVT的发病率为28.6%,高于以往的国内报道而更接近于其他亚洲国家,这可能与文献报道入选患者的SCI平面、基础疾病和监测方法不同有关。
SCI患者在康复过程中必须对下肢DVT进行监测,因为其可引起肺动脉栓塞而导致患者猝死[2]。下肢深静脉造影被认为是检测下肢DVT的“金标准”,但是其造价高、耗时长,有创并且往往不能重复检查[12],临床应用受到限制。下肢深静脉超声是当前临床中应用最为广泛的检查手段,其克服了下肢深静脉造影的上述缺点[13]。但是其结果的准确性很大程度上取决于检查者的技巧和经验,此外检查耗时长[14]。并且,患者在检查过程中的搬动等操作增加了下肢血栓脱落的风险。可见,下肢深静脉超声虽然对下肢DVT具有一定的诊断价值,但是其不适合作为一种可反复进行的监测手段。
D-Dimer是一种蛋白水解产物,其反映了血清中纤溶酶超活化后纤维蛋白溶解的水平,只要血管内纤维溶解异常活动及血栓形成,D-Dimer水平就会升高,被认为是检测有无血栓形成的敏感指标[15]。本研究中,196例SCI患者中112例检出D-Dimer水平异常,其中56例患者彩超检查确诊为下肢DVT,而其余84例D-Dimer在正常范围的患者在出院时均未发现下肢DVT。可见D-Dimer检查对于下肢DVT具有排除意义,但本研究中其假阳性率高达40.0%,而阳性预测值仅50.0%,故单纯进行D-Dimer检查并不能有效监测下肢DVT的形成,这一结论也被一些报道证实[16-17]。所以,笔者将血清D-Dimer监测与下肢深静脉彩超相结合,通过D-Dimer进行筛选,对疑似下肢DVT的患者进行反复彩超检查,既保证了检查的有效性,也节省了医疗资源和住院费用。57例D-Dimer水平大于 500 μg/L而下肢深静脉彩超检查阴性的患者在其后的监测中,又发现1例血栓新发病例,所以对于此类患者的监测是必要的。但笔者发现,该例患者D-Dimer水平一直大于500 μg/L并且有逐步上升的趋势。所以笔者认为,D-Dimer水平较高并且有上升趋势的患者将是监测重点。BERNARDI等[18]报道,利用彩超排除了下肢DVT的高D-Dimer水平患者,在之后的观察中其发生血栓的概率仅为0.2%,在本研究中为1.8%(1/57)。D-Dimer水平受到很多因素的影响,包括溶栓治疗、手术、创伤、怀孕、肿瘤、肝肾疾病、革兰阴性菌感染、心肌缺血及周围动脉血管病等[16],所以对于外伤性SCI患者如果出现血清D-Dimer水平大于 500 μg/L时,应该进行综合分析,排除上述疾病的影响。
Autar评分量表对于DVT风险预测具有较强的针对性,低风险(≤10分)DVT发生率小于10%,中等风险(11~14分)DVT发生率10%~40%,高风险(≥15分)DVT 发生率大于40%[19]。本研究采用Autar评分量表联合D-Dimer监测DVT,Autar评分联合D-Dimer阳性患者DVT发生率在低危组为30.2%,在中、高危组为62.3%。因此,D-Dimer联合Autar评分量表更有助于识别患者DVT的形成。
综上所述,D-Dimer监测对于下肢DVT具有排除作用,D-Dimer联合Autar评分与下肢深静脉彩超结合应用是对下肢DVT行之有效的监测手段。该方法不仅能够防止漏诊,又避免了反复进行下肢深静脉彩超导致的医疗资源浪费。

