高WBC的初治原发AML患者临床特征分析
姜艳红
(郑州大学附属肿瘤医院检验科,郑州 450008)
急性髓细胞白血病(AML)患者外周血象中白细胞(WBC)计数超过100×109/L 时称为高WBC急性髓系白血病(HL-AML)[1]。由于HL-AML复杂的病理生理学基础,常常合并中枢神经系统和肺部浸润等髓外浸润表现,HL-AML 患者外周血WBC异常增高,导致血液黏滞度增加,造成小血管内微血栓或血凝块的形成,容易发生颅内出血、弥散性血管内凝血、急性呼吸窘迫综合征和肿瘤溶解综合征等严重并发症,病情凶险,早期病死率高,临床治疗诱导缓解率低,复发及耐药率较高,预后极差,属于高危难治型性急性白血病。以往的文献大多是对HL-AML由于高WBC所引起的特殊并发症及临床症状和体征的阐述,关于HL-AML与非HL-AML(NHL-AML)患者的非特殊临床特征差异的研究较少。本文通过对比分析HL-AML与NHL-AML常见临床特征的差异,为AML的诊断分型、治疗选择、随访监测、预后评估及发病机制的探讨提供参考数据。
1 资料与方法
1.1 一般资料
选择2015年1月至2016年12月本院血液科所有初治原发AML住院患者232例,所有患者经细胞形态学、免疫学、遗传学、分子生物学分析,张之南主编的《血液病诊断及疗效标准》[2];排除骨髓增生异常综合征转化型AML、治疗相关AML及其他类型非原发AML和非初治AML患者,最终选出144例资料完备的AML患者纳入本研究,其中男76例,女68例,中位年龄41.5岁,年龄四分位间距为25.25~53.75岁。按照FAB分型标准,M1型11例。M2a型38例,M2b型26例,M3型21例,M4型2例,M5型45例,M6型1例。根据患者血常规WBC高低,以100×109/L为临界值分为高WBC组(HL-AML组)和非高WBC组(NHL-AML组)。本研究患者均知情同意,并经本院医学伦理委员会批准。
1.2 方法
1.2.1血常规检查 抽取患者外周静脉血2 mL并用乙二胺四乙酸二钾(EDTA-K2)抗凝,采用SYSMEX-3000血常规分析仪进行血常规检查。
1.2.2细胞形态学检查 抽取骨髓液制涂片,快速干燥后进行瑞氏染色,根据需要进行特殊细胞化学染色,包括过氧化物酶、碱性磷酸酶、特异性酯酶、非特异性酯酶及糖原染色等,进行形态学分型。
1.2.3免疫学分型检查 抽取骨髓液2 mL用肝素抗凝,应用流式细胞仪和荧光标记的单克隆抗体检测白血病细胞的表面抗原,并通过计算幼稚细胞抗原的表达比例来确定阳性细胞数;以细胞膜抗原表达比例大于或等于20%,细胞质抗原表达比例大于或等于10%为标准,计算抗原的阳性率。
1.2.4细胞遗传学检查 本文根据美国西南肿瘤协作组(SWOG)和东部肿瘤协作组(ECOG)细胞遗传学预后分层标准把AML患者分为预后良好、预后中等、预后不良、复杂核型和单体型核型组。通过骨髓细胞直接法和(或)24 h培养法,按照常规制备染色体,正常核型至少要分析20个分裂象,异常核型至少要分析10个分裂象。核型异常描述依据《人类细胞遗传学国际命名体制(ISCN 2013)》的规定进行[3]。
1.2.5分子生物学检查 通过荧光定量PCR检测AML1-ETO、PML-RARα、CBFβ/MYH11等13种AML相关融合基因,采用2代测序方法检测NPM1、FLT3-ITD、FLT3-TKD等53种AML相关基因突变。
1.3 统计学处理

2 结 果
2.1 一般临床特点分析
144例初治AML患者,正常核型59例(40.97%),异常核型85例(59.03%);既往病史包括高血压5例,糖尿病2例,皮肤病1例,胃炎1例,前列腺炎1例,乳腺炎1例,乳腺癌1例,肝炎1例,痛风1列,脑梗死1例,过敏性哮喘1例。一般临床特点见表1,性别、年龄、既往病史和常见临床症状分组在HL-AML和NHL-AML组中差异均无统计学意义(P>0.05)。

表1 两组患者一般临床特征[n(%)]
a:通过连续校正法计算得出的P值

表2 两组患者血细胞常规和骨髓细胞形态分析
2.2 血细胞常规和骨髓细胞形态分析
在144例AML患者中,骨髓中原始细胞比例,外周血中红细胞(RBC)、血红蛋白(HGB)和血小板(PLT)在HL-AML和NHL-AML组间的差异均无统计学意义(P>0.05),见表2。
2.3 FAB分型分析
按FAB分型,纳入研究的144例患者在M1、M2a、M2b、M3、M4和M6组所占比例在HL-AML和NHL-AML组间的差异均无统计学意义(P>0.05);HL-AML患者中M5型AML所占比例明显高于NHL-AML组(P<0.05),见表3。
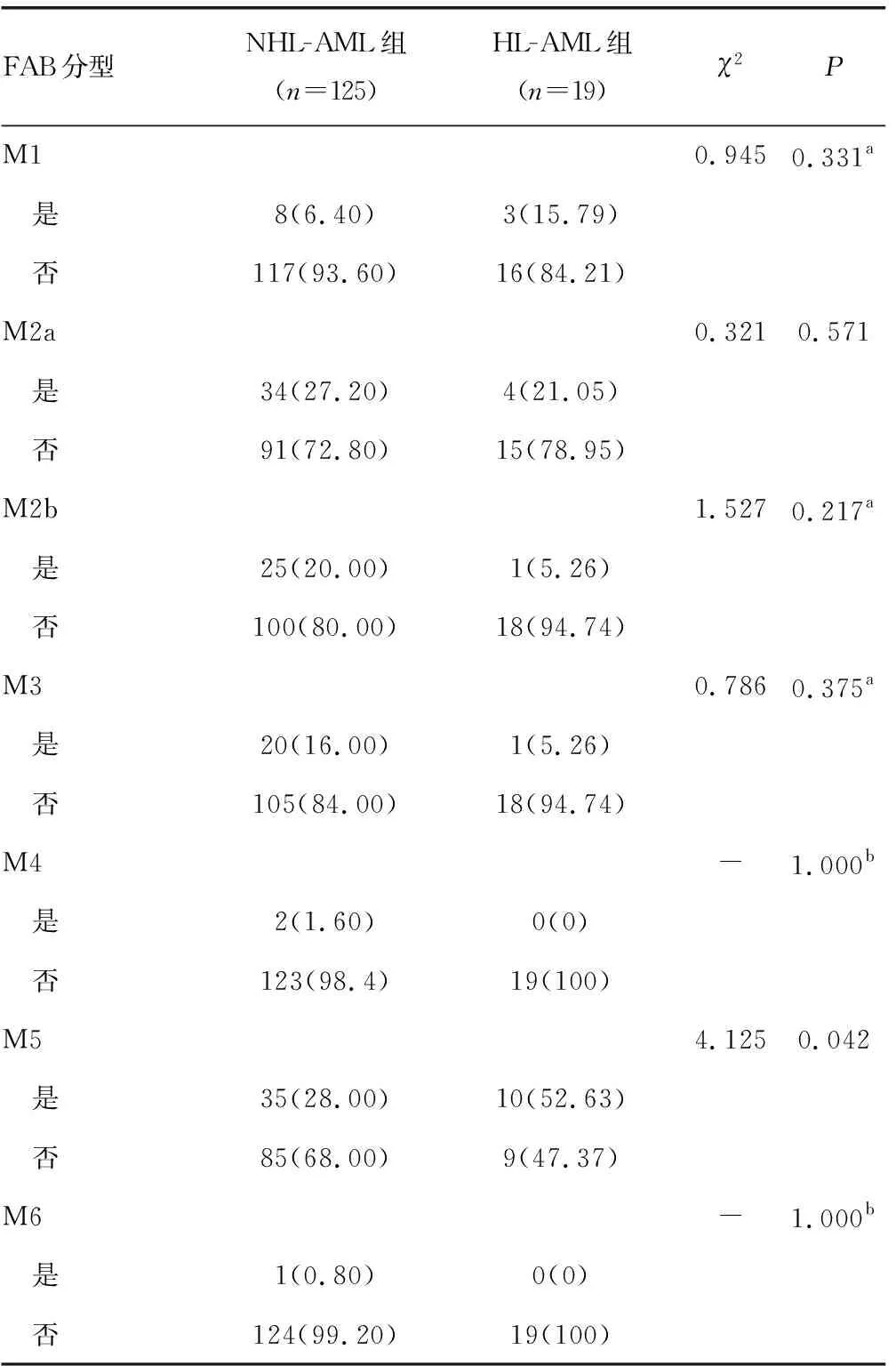
表3 两组患者FAB分型分析[n(%)]
a:通过连续校正法计算得出的P值;b:表示通过确切概率法直接计算得出的P值;-:无数据
2.4 细胞遗传学分析
染色体核型按对预后影响进行分组,分为预后良好、预后中等和预后不良组,预后不良组按复杂核型和单体核型的有无分组,预后良好组和单体核型组在HL-AML和NHL-AML组间的差异均有统计学意义(P<0.05);而预后中等、预后不良和复杂核型组,在HL-AML和NHL-AML组间的差异无统计学意义(P>0.05),见表4。
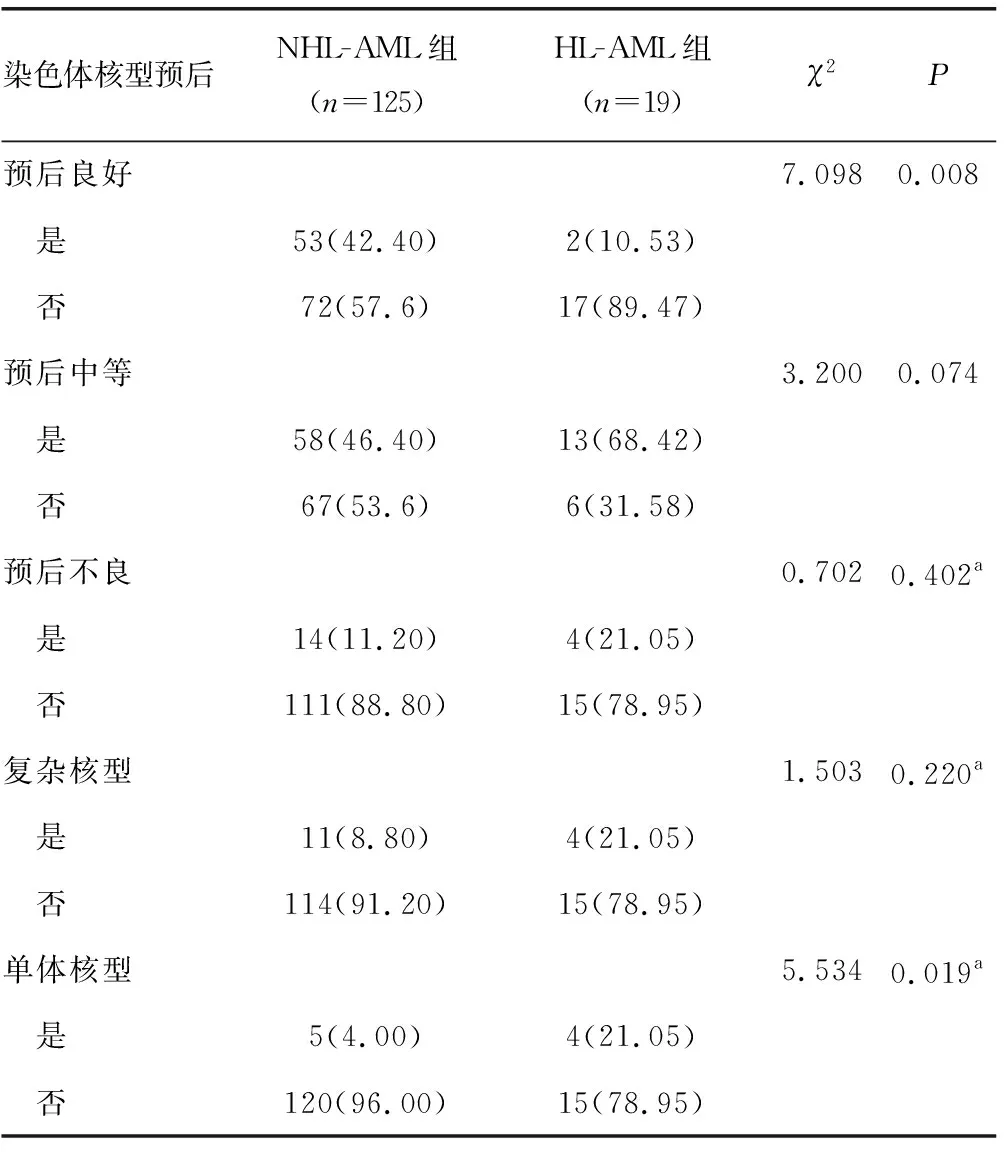
表4 两组患者细胞遗传学分析[n(%)]
a:通过连续校正法计算得出的P值
2.5 融合基因分析
纳入研究的144例患者,检测到的常见融合基因有AML-ETO、PML-RARA、CBFβ-MYH11和MLL-ELL,在HL-AML和NHL-AML组间差异均无统计学意义(P>0.05),见表5。
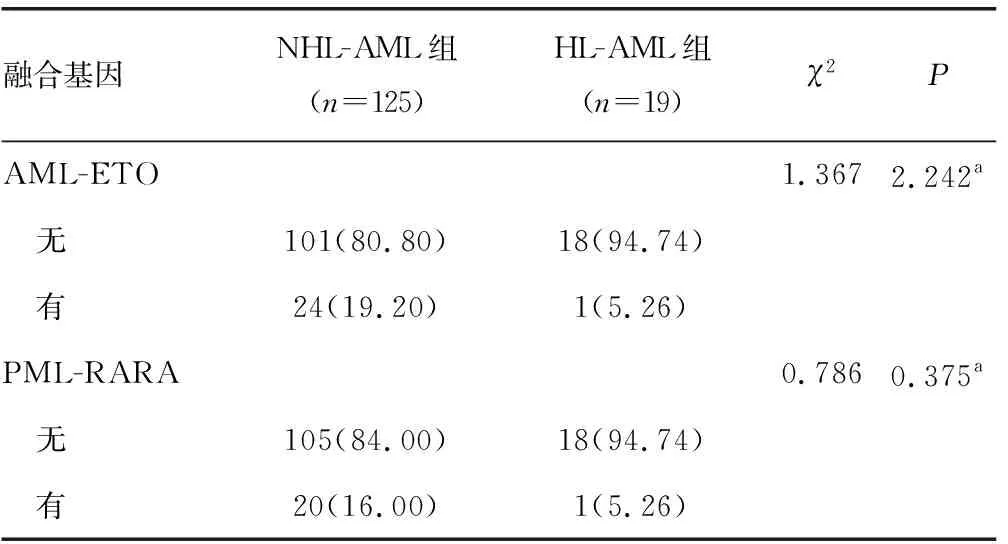
表5 两组患者融合基因分析[n(%)]
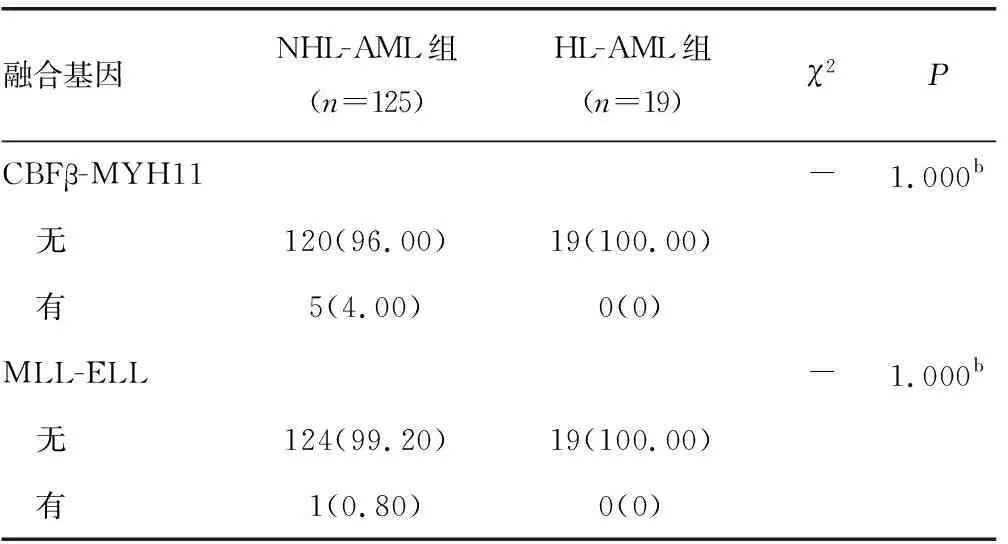
续表5 两组患者融合基因分析[n(%)]
a:通过连续校正法计算得出的P值;b:通过确切概率法直接计算得出的P值;-:无数据
2.6 基因突变分析
对144例入选患者进行基因突变检测,共检测到33种突变基因,HL-AML中FLT3-ITD占12例(63.16%)、NPM1占7例(36.84%)明显高于NHL-AML组的19例(15.20%)和13例(10.40%)(P<0.05);除去以上2种突变基因,其他31种突变基因在HL-AML和NHL-AML组间的差异均无统计学意义(P>0.05),见表6。

表6 两组患者基因突变分析(+/-,n/n)
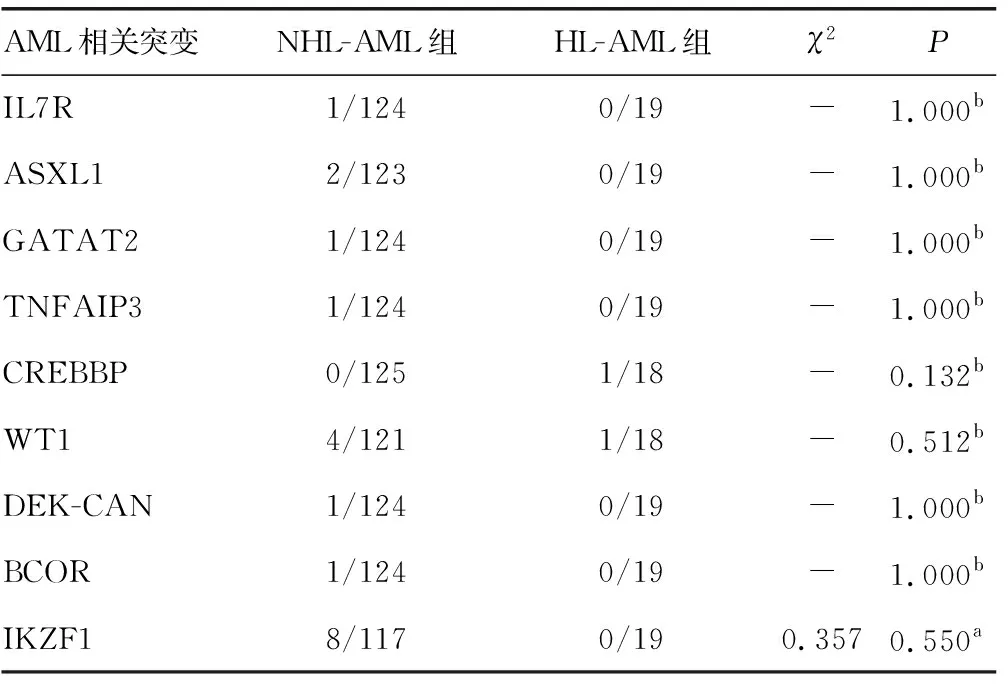
续表6 两组患者基因突变分析(+/-,n/n)
a:通过连续校正法计算得出的P值;b:通过确切概率法直接计算得出的P值;-:无数据
3 讨 论
由于AML异质性较大,所以影响预后的因素也较多,2016年美国国立综合癌症网络(NCCN)指南预后分层主要依据细胞遗传学与分子突变划分,年龄则被作为独立高危因素;然而一些研究证实一些临床因素如初次诱导强度和效果、初诊时外周血WBC及血清乳酸脱氢酶水平等也影响到AML 的长期生存[4-5]。2017年版成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南[1]把高WBC计数(WBC≥100×109/L)作为 AML不良预后因素。本文主要目的是通对比分析HL-AML与NHL-AML的差异,从而发现与HL-AML关系紧密的临床特征,为AML的准确诊治和预后判断提供参考数据。
本研究144例AML患者,其中HL-AML患者19例(13.19%),高于中美联合上海市白血病协作组报道的HL-AML约占AML患者总数的7%[6]。从分析的数据可以看出,HL-AML和NHL-AML患者中不同性别和不同年龄的构成差异无统计学意义(P>0.05);而且像常见病如高血压、糖尿病、肝炎等在两组中的分布也无明显的差异,可见这些不是影响AML患者外周血WBC的高低的直接因素,而更主要是细胞遗传学和分子生物学变化的影响。对于HL-AML和NHL-AML患者,他们的常见临床症状如发热、乏力、出血等在两组间并无明显不同,而进一步说明这些只是白血病患者共有的常见症状,与WBC的高低没太大关系。
AML患者外周血WBC升高,主要原因是骨髓中原始和幼稚WBC进入外周血造成的,直观上来讲,骨髓中原始细胞比例越高,外周血的WBC也会越高,而研究结果显示,HL-AML和NHL-AML组患者骨髓原始细胞比例的高低并无明显差异,可见外周血中WBC高低不仅仅取决于骨髓原始细胞比例的高低,还要受骨髓增生程度、骨髓腔内压力、骨髓屏障受破坏程度等因素的影响。从外周血常规可以看出,正常人外周血中RBC大约是WBC的100倍,而PLT大约是WBC的30倍。本研究结果发现,HL-AML和NHL-AML组患者外周血RBC、HGB和PLT的中位数和四分位间距均低于正常参考范围,但两组间的差异无统计学意义(P>0.05),究其原因:(1)白血病患者骨髓白血病细胞恶性增殖,导致正常造血受抑制,基本上都会有贫血和低PLT;(2)RBC和PLT本来就比WBC高得多,有一定的稀释效应,WBC升高十几倍对RBC和PLT影响不大。
有学者对HL-AML进行FAB 分型统计及细胞遗传学研究,发现HL-AML 在FAB 分型中 M4和 M5 型较多见,常见的染色体异常为染色体11q23 重排、染色体16q23 重排、±6 及 inv(16) (p13;q22)[7]。本研究结果显示,根据AML的FAB分型,HL-AML组19例患者中有10例(52.63%)为M5型,而NHL-AML组中125例患者中仅有35例(28.00%)为M5型,可见HL-AML组AML-M5型患者所占比例明显高于NHL-AML组(P<0.05),但在这10例AML患者中均没有出现上述文献中所说染色体异常,而两组间M1、M2a、M2b、M3和M4型患者所占比例差异无统计学意义(P>0.05);再结合常见融合基因分析,本文没有发现两组间AML-ETO、PML-RARA、CBFβ-MYH11和MLL-ELL所占比例有明显的不同(P>0.05),所以本研究数据分析结果与上述文献不完全相符。依据本文数据,可以推测,HL-AML患者多为WHO急性髓系白血病分型中AML非特定类型(AML-NO3)中M5[8]。
近年来随着分子生物学的发展,越来越多的与AML预后相关的细胞遗传学因素、分子生物学因素被认识并运用到危险度分组中去。有文献报道恶性肿瘤的发生、发展通常与基因突变有关[9];也有研究发现有半数以上白血病缺乏特征性的细胞遗传学变化,每一个白血病细胞都是多种基因突变积累的结果,全面了解白血病的基因突变情况,有助于更精确的诊断分型、评估预后和制订个体化治疗方案[10]。HL-AML组患者预后良好组所占比例明显低于NHL-AML组(P<0.05);在单体核型组,HL-AML组患者所占比例明显高于NHL-AML组(P<0.05);在预后中等、预后不良、复杂核型组中,虽然HL-AML组患者所占比例高于NHL-AML组,但两组间的差异无统计学意义(P>0.05)。并且从本研究结果可以看出,HL-AML组19例患者中有4例预后不良,且这4例患者既是复杂核型又是单体核型,这说明HL-AML患者一旦被归预后不良组,其染色体核型是很复杂的,然而本研究HL-AML患者例数太少,有待于大样本研究来证实。通过以上分析,按照细胞遗传学预后分层,HL-AML组整体上是比NHL-AML组预后差的。符合英国MRC AML12 方案研究表明初诊WBC计数越高,长期预后越差[11]。本文对144例入选患者进行基因突变检测,共检测到33种突变基因,HL-AML中FLT3-ITD和NPM1突变患者所占比例明显高于NHL-AML组(P<0.05);除去以上2种突变基因,其他31种突变基因在HL-AML和NHL-AML组间的差异均无统计学意义(P>0.05)。本研究中19例HL-AML患者中有12例(63.16%)发生FLT3-ITD突变,7例(36.84%)发生NPM1突变,其中有4例同时伴有FLT3-ITD和NPM1突变,也就是7例NPM1突变患者中有4例(57.14%)伴有FLT3-ITD突变,略高于既往文献大约40%的NPMl突变病例伴发FLT3-D突变[12];也有文献报道FLT3-ITD突变AML 患者易合并其他白血病相关分子标志共同存在,最为常见的是合并NPM1 突变的共同表达[13]。有相关文献报道,NPMl基因突变阳性AML患者的临床表现多为初诊时外周血白细胞升高[14];也有文献报道在AML中,FLT3-ITD 突变后,该受体无需与其配体结合即可引发酪氨酸激酶的持续激活,并进一步激活其下游细胞增殖与分化信号转导通路(如JAK-2/STAT5、MAPK/AKT 等)的异常激活,从而引发细胞发生非配体依赖性的级联反应,如STAT5可激活细胞周期蛋白D1、原癌基因和抗凋亡基因,从促进细胞增殖和抑制细胞凋亡两方面发挥作用,使细胞增殖活性增强[15],造成该突变患者外周血WBC 计数极度增高。
综上所述,与NHL-AML患者相比,HL-AML患者多为WHO急性髓系白血病分型中AML-NOS中的M5型,常见单体核型,易伴FLT3-ITD和NPM1基因突变。

