从临床出发,以信号通路为靶标的复方新药研发策略、途径与实践
——六论创建新医药学*
罗国安,王义明,范雪梅,谢媛媛
(清华大学/教育部中医药现代化网上合作研究中心 北京 100084)
1 前言
1.1 中医药现代化简要回顾
大健康产业。中医药研究在临床和基础研究领域取得了飞跃发展,国际影响日益扩大。
1996 年科技部会同国家中医药管理局等部门提出了中药现代化发展的整体战略构想[1],1997年启动了中药现代化科技产业行动,1998年中药现代化科技产业基地建设启动,出台了《中药现代化发展纲要》、《中医药创新发展规划纲要》等指引性文件。1999年由王永炎院士领衔的“中药方剂的关键科学问题基础研究”获得国内科技界的一致赞同,成为第一个中药973项目。20余年来中药工业产值占据我国生物医药工业总产值的1/3,带动形成了超过万亿元规模的中药
1.2 现代医学快速发展
现代医药在经历了反思、自我否定之后,提出了转化医学、精准医学、个体化治疗、谷歌公司的“医学大脑”在AI方面获得长足进步等一系列创新发展,正面临取得重大突破的前夜[2]。
1.3 二种倾向
中医药现代化发展20余年了,在取得重大进展之际,出现了二种倾向。一种是否定中医药现代化取得的成绩,质疑中医药现代化是全盘西化;另一种是鱼龙混杂,泥砂俱下,不讲科学,打着中医药旗号,包治百病的神医、神药不断出现,令人担忧。质疑中医药浪潮时起彼伏。中医药发展出现了种种边缘化现象:如中药注射剂在二级甲等以下级别的医院中不可使用,而三级甲等医院不用,导致中药注射剂销售大幅下降;中成药在疾病诊治方案中不作为主治药物,只是辅助治疗用药;在大健康、治未病的说法下,弱化中药作为治疗药物的作用,下降到保健品地位;人工智能的“中医大脑”、“中药大脑”无人探索,等等。如此场景,不禁令人发问:中医药往何处去,中医药现代化之路朝向何方?!我们的回答是:中医药亟需拓展国际视野,提升科学高度,与时俱进,不忘初心,为实现中医药现代化再出发,踏上新征程,奔向新目标!
1.4 应对措施
产生目前状况的原因在于:缺乏明确的战略目标,只强调中医药现代化是个过程;缺乏全球视野,满足于自我欣赏;缺乏自我否定、革命性创新意识,满足于追风跟踪。针对不利于中医药事业发展的倾向,笔者认为①坚持中医药现代化之路不动摇;②要有更多的创新,更多融合中医药,现代医学,生命科学新进展;③要有全球视野,走出自己的路,实现四个创新:理论(观念)创新,方法(体系)创新,技术创新和集成创新[3]。
习主席在2018年两院院士大会讲话中指出:“我们坚持走中国特色自主创新道路,坚持创新是第一动力,坚持抓创新就是抓发展,谋创新就是谋未来”。面对中医药往何处去的方向问题,我们应该旗帜鲜明地认识到传承中医药是责任,坚持创新是我们时代的使命。
本文试图从整体系统医学(新医药学,Holistic Sys⁃tems Medicine,HSM)理念[2-6]出发,从药学(新药)研发角度,探讨能实现医药融合,临床和实验室研究融合,适用于复方新药(中药复方、西药复方乃至中西药复方)的研发策略、途径和实践。
2 几点思考
2.1 新药研发重点将从新化学实体(NCE)转向复方新药
新药研发是一个耗时、耗资都非常庞大的系统工程,主要包括实验室开发(候选药物研发和临床前研究)、申报临床、临床试验、申报生产、上市等。目前创新药物在国际上是指含有新化学实体(NCE)的药物。随着现代医学的高速发展,人类疾病谱和医疗模式发生重大变革,发生率高和危害重大的疾病已由感染性的单因素性疾病,转向机体自身代谢和调控失常为主要谱群的慢性、复杂、多因素性疾病,如心脑血管疾病、神经退行性疾病、恶性肿瘤、免疫性疾病和代谢性疾病等。以单靶点直接对抗治疗为代表的西方医学思想在处理感染性等单因素性疾病方面取得了成功,但在面对慢性、复杂性、多因素性疾病时却苦无良策。目前,治疗理念的变革(如免疫治疗等),临床联合用药的实践及美国FDA批准越来越多的复方西药,是启示性标志。以NCE为重点的新药研发将逐步转变为复方新药的新药研发模式,这是一个新趋势。目前存在的问题,在于新药复方新药的研发策略和途径仍然遵循NCE的“靶点确定-模型建立-先导化合物发现-先导化合物优化”的新药研发模式。不同之处在于多是针对疾病发生发展过程中几个关键靶点的药物的简单组合,从机理上看是1+1≥2。然而,复杂疾病的发生发展涉及到多个病理环节,这种针对一个或多个靶点的药物组合缺乏整体观指导,难于做到多种治疗理念(如标本兼治等)的整体系统研发。中药复方新药基于中医药传统宝库,得到了快速发展(如组分中药等[7]),但仍存在缺乏整体观、系统论指导下的“两个基本讲清”(基本讲清药效物质基础,基本讲清药效及作用机理[8-10])的现代科学数据支撑。
2.2 NCE新药研发模式的缺陷
新药研发中候选药物的确定是新药研发的关键环节,候选药物的合理性一定程度上决定了新药研发的成败。目前NCE新药研发以西方医学思想为指导,“靶点确定-模型建立-先导化合物发现-先导化合物优化”的模式存在明显的缺陷。由于伦理、医药分工、简化复杂研究难度及技术上时代局限等原因,NCE新药研发模式作了2个重要的简化替代:用动物模型等取代了临床病人;用靶点(或组合)取代了疾病。由此必然给药物的有效性和安全性带来重大的不确定性。目前大量临床用的药物都是NCE研发的成功范例,但背后隐藏的是巨大的失败率和高额的研发成本。
2.3 从动物模型出发的新药研发的局限性
用动物模型(包括细胞模型等其它生物模型)来模拟病人是一种不得已的简化、替代办法,其缺陷在于:多种治疗理念(如标本兼治、祛邪扶正、异病同治等)无法体现;病人的心理、情感、饮食及环境等因素无法表征等等。其本质在于将医生和药学家的分工合作变成了药学家的单一研究。中医药传统体现了医药不分家的理念,但现在因药学研发的复杂性使之有所降低。西医药分家由来已久,但何大一的鸡尾酒疗法成功研发为复方新药,开辟了由医生临床联合用药研发复方新药的新途径。我们提出了临床系统生物学[11]途径探索实现医药融合,以临床病例为出发点研发新药。
2.4 从靶点出发的新药研发的局限性
从靶点出发的新药研发取得了极大的成功,今后乃至相当长时间内仍是新药研发的主要途径,其原因在于简单明了,抓住了疾病的关键,提供并建立了一整套完善、可操作、可复制的技术和方法体系。针对单因素性疾病,确定明确的靶点,采用高通量筛选,筛选出候选药物,进行进一步药效、药理及临床研究,形成了一种惯性思维,这是一种“点-点”(1个小分子化合物针对1个靶点)的模式。但对于慢性、复杂、多因素性疾病,“点-点”模式就有很大局限性,无法表征疾病的全面性,阶段性及其本质。笔者深感“点-点”模式(Point to Point,P2P)不足以描述表征中医药的深刻科学内涵,也无法推动中医药现代化和创新使命,在本世纪初出现的系统生物学理念启迪下,于2006年初提出了用化学物质组学(Chemomics)来表征中药复杂体系,用整合化学物质组学的整体系统生物学(Chemo⁃mics-integrated global systems biology)来阐述外部干预系统(中药复方系统)与生物应答系统(人体复杂系统)之间“系统-系统”模式(System to System,S2S)的相互作用[10,12]。从P2P到S2S是1个根本的转变,“系统-系统”的新药研发模式将对疾病(包括亚健康等)及治疗、中医的证、方等都会有新的认识,发现新的策略和途径。
2.5 病(西医)和证(中医)都是有同一的生物学意义
自从系统生物学提出以来[13,14],人体复杂系统的生物应答可归纳为基因、蛋白质、代谢物3个基础层面正在逐步成为共识。中医和西医从不同理念和体系,用不同的表征方法来体现对人的疾病的认识和治疗,但对同一病人的中西医不同表征,在物质基础(基因、蛋白质、代谢物3个基本层面)上是有可能找到同一的生物学意义。新医药学是有可能在同一物质基础3个层面上实现结合,整合,融合而发展。在复方新药研发上则会产生基于临床出发,同一理念推动研究策略和途径的中药复方新药、西药复方新药和中西药复方新药[15,16]。
现在习惯上所讲的中药复方作用是多成分、多靶点的说法,实际上体现了从西药靶点出发,缺乏中医药整体观、系统论的理念。中医药整体观、系统论精髓指导下,应是有君臣佐使之分的药材组分和成分逐步递进的复方,针对的有主次之分的靶点和通路的系统作用。常用多组学来描述也有不妥。现在有100多种组学,但其生物学意义根本上是3大类组学(基因组学、蛋白质组学和代谢组学),用系统生物学或整体系统生物学能克服碎片化,体现了整体观和系统论理念。笔者所提出的整体系统生物学(Global Systems Biolo⁃gy)[17-19]作了有益的探索。
2.6 网络药理学的优缺点
2007年10 月提出的网络药理学[20]在复方药物研发中得到了广泛的应用,它是用单成分药物作为扰动(点),采用系统生物学描述其活性,即P2S模式(Point to System,P2S)。通常用来预测推断小分子和基因、蛋白质、代谢物等靶点和网络的相关性,取得了有益的结果。如李梢等提出了网络靶标(network target)[21];王忠等提出了模块药理学(Modular Pharmacology)等[22]。
网络药理学是一种有益、必要的技术,适宜作预测、推断等辅助作用,不宜夸大所起作用。因为①网络药理学的依据是各种数据库,数据库中各数据可靠性不同,部分数据准确性有待证实,对预测结果有极大影响。真实结果须在网络药理学预测结果基础上进行验证,再结合其它来源实验研究结果予以修订、补充、完善而得。②网络药理学是从统计学和生物信息学角度出发,预测工具有很多不同算法,各算法出发点不同,采用方法不同导致所得结论各不相同,须经实验验证。③数据库实验数据来源于1个小分子药物对整个网络(基因网络、蛋白质作用网络、代谢途径网络等)的作用(P2S),未考虑多个化合物(复方药物)对整个网络的同时作用(S2S),即未考虑药物之间的相互作用及和整体网络的相关性。④更扎实的途径是从临床病例的整体网络(基因、蛋白质和代谢物等)出发,从疾病的症状、影像、生化指标和整体网络出发,结合网络药理学手段进行整体研究。⑤大数据、云计算等将为从临床出发的整体网络药理学(Holistic Network Pharmacol⁃ogy)提供更多手段和更好前景。⑥期盼定量网络药理学(Quantitative Network Pharmacology)和毒性(副作用)网络药理学(Toxicity Network Pharmacology)的出现和研究。网络药理学是复方新药研发必须且重要的技术之一,须明确其优缺点,才能克服短处,更好应用这一工具来发展复方新药。
2.7 复方药物的定义和特点
基于“系统-系统”(S2S)模式的复方药物[15,16]定义如下:复方药物是指为了实现整体最佳(而不是单靶点最佳)的疗效目标,综合多种治疗原则和多种作用机理导向下所开发的由多个化合物或化合物群配伍组成的治疗药物。复方药物一般具有以下特点:①复方药物是由多个成分(化合物)或多个组分(化合物类)所组成的化合物群;②组成复方药物的多个成分(或多个组分)具有一定的配伍和配比关系;③复方药物往往包含多种治疗原则和多种作用机理达到整体疗效最佳;④复方药物必须能够体现复合组方的必要性,即必须体现多成分(或多组分)配伍之后增效或减毒方面的综合优势;⑤复方药物的质控标准应能保证药物质量的稳定和均一。在此原则下既可以开发中药复方药物,也可以开发西药复方药物和中西药结合的复方药物[15]。
复方药物研发创新体系的特点为:①治疗的对象是生病(或亚健康状态)的人(而不只是病);②充分体现“医生参与,医药融合”的特色;③研发途径应体现“临床-动物-临床”的特点;④具有独特的临床疗效综合评价体系;⑤具有体现其作用模式(机理)的药物综合筛选模式(“系统-系统”相互作用模式);⑥具有体现其化合物群的整体表征和局部特征的综合表达形式[16]。
中药复方新药的来源为传统的中药方剂(古方,经方),已上市的中成药,确有疗效的院内制剂和临床有效验方,组分中药和由单体或组分按中医药理论和/或现代理论配伍组成的复方等。西药复方新药主要来源于临床联合用药的实践或针对疾病的临床系统生物学研究,以信号通路为靶标研发而成复方新药。
2.8 从临床出发,以信号通路为靶标的研发策略
网络药理学是从数据库和P2S模式出发,而本文所提出的复方新药研发是基于临床实践取得的系统生物学数据和S2S模型进行的。如何能吸取NCE以靶点为靶标研发模式的优点,结合“系统-系统”模式理念,从长期和临床相结合的实验研究中,我们于2017年总结提出了以通路(signaling pathway,包括基因、蛋白质、代谢物3个层面)为主,靶点为辅来表征整体药效和相互作用的研发模式[6]。
从临床出发,以信号通路为靶标的复方新药研发策略大致如下:
①对复方药物进行整体系统研究:采用化学物质组学对中药复方进行药材、组分和成分群3个层次,有君臣佐使之分,逐步递进的深入研究。针对不同类型的复方药物,确定重点研究的化学层次,结合用动物模型开展的整体系统生物学研究,基本搞清复方药物的化学物质基础;②针对所研究的疾病和中医的辨证治疗,制定临床研究方案。从流行病学研究开始,根据不同的研究问题,研究目的,可采用不同的研究设计和方法。在各种临床研究类型中,随机对照临床试验内在真实性高,可以判断干预措施真实的疗效,能够证明因果关系,是学术界广泛接受和认可的疗效评价方法,其研究结果被认为是最高等级的临床证据[23]。确定临床病人入组条件后,入组病人0天的整体系统生物学及其它信息(病、证、生化指标、影像学等)可作为疾病(证)分型横断面依据,治疗各阶段的所有信息作为整体疗效评价和候选复方新药的依据和来源;③临床整体系统生物学研究:对临床病人的血清(血浆)、尿液等样品,根据疾病的特性确定所需开展的整体系统生物学的各种组学类型,进行实验研究。采用生物信息学方法,确定和疾病相关的靶点,信号通路和相应的网络,特别聚焦和疾病分型相关的整合生物标志物体系(Intergrated Biomarker System,IBS)[11];④网络药理学搜寻预测候选复方新药:根据临床数据和生物信息学所确定的靶点、通路和相应网络,采用网络药理学方法确定复方药物化学物质组学数据和其相关性,以通路为主要靶标,靶点辅助,聚焦得出候选复方药物初步的化学成分,组分的配伍及配比;⑤生物学实验优化和验证:采用动物模型(包括模式生物,如线虫、斑马鱼等),细胞模型和分子生物学技术对网络药理学得出的候选复方药物的组成、配伍和配比进行优化和验证;⑥传统新药研究开发中的药效、药理和安全性评价。
从临床出发,以通路为靶标的复方新药研发策略能有效克服目前中医药研究中存在“方-病-证”割裂(违背中医药整体观)和“基因-蛋白质-代谢物分离”(缺乏系统性)的弊病,避免了单靶点、多靶点(缺乏有主次的整体表征)的不足,既可以发现针对疾病(证)多种治疗理念集合的复方新药,也可以发现对疾病的各病理阶段的针对性强的复方新药。
从临床出发,基于信号通路的复方新药研发途径如图1所示。本文以和中日友好医院李平教授团队合作开展的糖肾方治疗糖尿病肾病(DN)的临床数据为基础,开展的候选复方新药研究实践为实例进行阐述。
3 糖肾方治疗DN研发候选复方新药的途径与实践
经过随机双盲安慰剂对照的临床试验验证了糖肾方是治疗DN的有效方剂;采用基因组学、蛋白质组学和代谢组学研究发现糖肾方干预DN疗效相关的通路;采用液相色谱-质谱联用技术对糖肾方整体化学物质组的化学成分进行分析鉴定,确定糖肾方化学物质基础;采用网络药理学分析预测糖肾方中主要活性成分潜在的作用靶点和通路;整合临床系统生物学和网络药理学预测的相关通路,锁定糖肾方干预DN的关键通路,并通过溯源分析,预测“有效化学成份群”,作为糖肾方干预DN组分新药的候选药物,进一步通过细胞模型和动物模型进行验证。
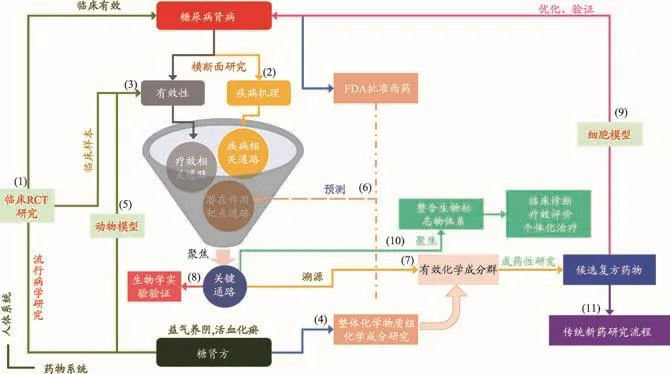
图1 从临床出发、以通路为靶标的复方新药发现途径
基本途径(图1)可分为11个方面:(1)糖肾方治疗DN的随机双盲安慰剂对照试验;(2)DN横断面的临床系统生物学研究;(3)糖肾方治疗DN临床系统生物学研究;(4)糖肾方化学物质组学分层次整体研究;(5)糖肾方干预db/db小鼠的整体系统生物学研究;(6)基于网络药理学的糖肾方干预DN作用靶点和通路预测;(7)由关键作用通路溯源“有效化学成分群”;(8)网络药理学所得结果的分子生物学验证;(9)基于细胞模型的候选复方新药优化和验证;(10)由临床系统生物学聚焦而得整合生物标志物体系及作用;(11)传统新药研发过程(包括药学与临床前药理、药效学研究、急性毒性/长期毒性研究等临床前药学研究,临床试验阶段和上市后再评价)。
3.1 糖肾方治疗DN的随机双盲安慰剂对照临床研究
DN是糖尿病的严重微血管并发症,具有高患病率和高死亡率的特点。显性蛋白尿是DN疾病进展的重要危险因素,加速了DN进展至终末期肾病。
20世纪80年代,名老中医时振声教授提出“气阴两虚”是慢性肾脏病的发病关键[24]。中医药治疗DN的1464篇临床随机对照研究文献回顾性研究,发现DN患者中频次大于20%的证候依次为血瘀、气虚、阴虚、肾虚、肝郁、脾虚和湿浊[25,26]。
多中心流行病学横断面现场调查的方法,通过“病-证结合”的临床研究(横断面研究),阐释了DN中医证候特点、分布以及变化规律,以及中医证候与西医病理分期的相关性[27]。收集2型DN患者182例(注册号:ChiCTR-TRC-10000843),按照西医Mogensen分期标准分为糖尿病(33例)、DN III期(33例)、DN IV期(27例)和DN V期(39例)组,另有正常对照组(50例);将DN III期-V期患者按中医辨证分型为气阴两虚偏阴虚、气阴两虚偏阳虚和阴阳两虚。表1所示为西医Mogensen分期和中医辨证分型的相关性,虽然中西医对疾病诊断判别标准不同,但对疾病严重程度的判断基本类同,提示中西医可能具有同一生物学意义。
流行病学研究表明,从糖尿病发展到DN,以及DN的发展过程中(从III期逐步发展到V期),尿蛋白、血肌酐、尿素氮等3个表征肾功能的指标显著增加;肾小球滤过率显著降低。以34项中医症状的量化评分比较三个中医辨证分型8个单证素分布情况,证实了中医理论中认为DN的病机是气阴两虚,且贯穿始终,疾病后期阴损及阳、阴阳两虚的观点。在“气阴两虚→阴阳两虚”的发展进程中,临床生化指标显示了与Mo⁃gensen分期一致的变化趋势,提示中医辨证分型与西医病理分期具有相同的物质基础。
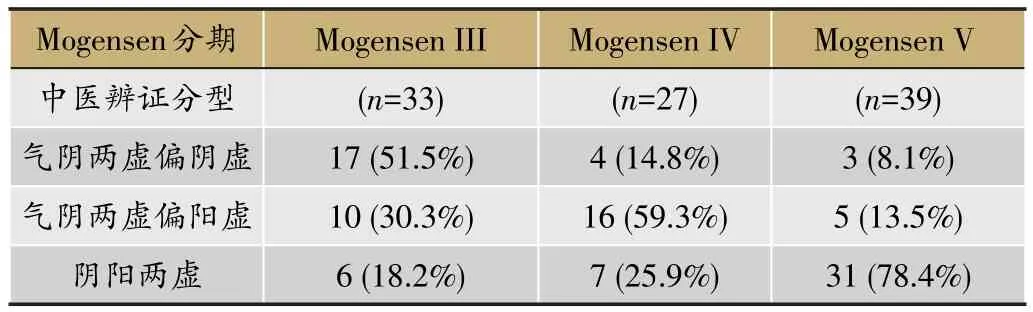
表1 中西医临床诊断相关性
糖肾方(TSF)由黄芪、生地黄、山萸肉等7味中药配伍而成,具有“益气柔肝,活血通络”的功效,是针对DN微量白蛋白尿期及显性蛋白尿期的临床经验方。两次糖肾方治疗DN的多中心、随机双盲、安慰剂对照临床试验(注册号:ChiCTR-TRC-10000843,ChiCTRTRC-13003566),证实糖肾方显著改善显性蛋白尿期患者倦怠乏力、肢体麻木等气虚血瘀相关症状。在微量白蛋白尿期,糖肾方在减少尿蛋白排泄和改善肾小球滤过率方面与肾素血管紧张素酶抑制剂/血管紧张素受体拮抗剂(ACEI/ARB)疗效一致,而在延缓肾功能损伤进展方面更具优势;在显性蛋白尿期,尿蛋白排泄增加,肾小球滤过率呈进行性下降,西药治疗无法阻止疾病发展,糖肾方可显著降低24 h尿蛋白含量,提高肾小球滤过率。此外,糖肾方可减少尿蛋白及尿液肝型脂肪酸结合蛋白水平,并降低DN微量白蛋白尿患者的尿液TGF-β水平[28-29]。RCT临床试验证实了糖肾方临床疗效确切,为深入开展糖肾方作用机制等研究提供了基础和支撑。
3.2 DN横断面的临床系统生物学研究
本研究建立了整合代谢轮廓谱分析(整体效应)、七大类百余种磷脂(细胞膜形成、脂质代谢异常、活性氧自由基)、15种脂肪酸(脂毒性、胰岛素分泌抑制)、21种嘌呤嘧啶(调节肾素释放、肾血流能量代谢异常)和8种硫醇氨基酸(机体氧化应激状态、糖代谢、肾脏功能)定量分析的定量代谢组学平台技术,以及14种DN相关基因PCR定量测定技术[30-37],针对“3.1节”多中心流行病学横断面研究病例开展了临床系统生物学研究。
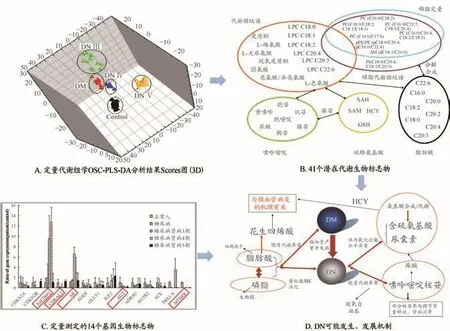
图2 基于西医分期的DN横断面研究结果
3.2.1 基于西医分期的DN横断面研究
西医分期研究结果(图2A)显示,患者血浆代谢状态随着疾病进展发生了显著改变,筛选得到了41个可表征DN发展进程的内源性潜在代谢物生物标志物(图2B)。基因定量结果显示(图2C),AR、AGT、CD⁃KAL1、IGF2BP2和MTHFR基因的表达与DN分期显著相关。上述结果表明,能量代谢与脂肪酸代谢异常引起糖脂代谢紊乱是DN发生发展的主要原因之一(图2D)。
3.2.2 基于中医分型的DN横断面研究
中医分型研究中,各组样本分布呈螺旋状,病情越严重,样本距离正常对照组越远(图3A)。其中,随着阴虚向阳虚的转化,磷脂类代谢物呈下降趋势,而嘌呤/嘧啶核苷类代谢物呈上升趋势(图3C),与其在DN西医分期中的变化趋势(图3D)基本一致,表明中医辨证分型与西医病理分期具有相同的物质基础。AR、AGT、AGER和IGF2BP2基因的差异表达与DN的中医分型显著相关(图3B)。特别是AR基因,推测其高表达与长期高血糖引起肾脏等结构变化产生微血管病变相关,高血糖会导致郁而化热,燔灼津液而为阴虚。
3.2.3 整合生物标志物体系的建立
本研究通过整合临床系统生物学研究结果与临床中西医诊断指标,建立了包括西医病理生化指标、生物标志物(基因、蛋白质和代谢物等)以及中医证候指标,可应用于DN诊断与治疗的整合生物标志物体系,并对其进行聚焦分析,获得可易于临床检测的最佳聚焦整合标志物群(图4)。
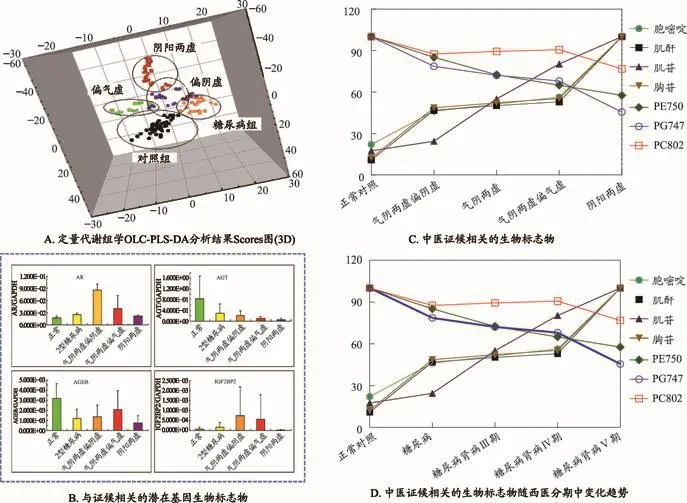
图3 基于中医分型的DN横断面研究结果
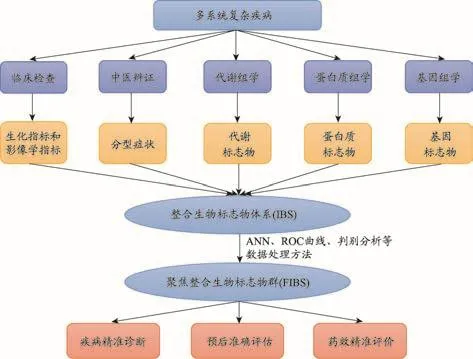
图4 整合生物标志物体系的发现途径
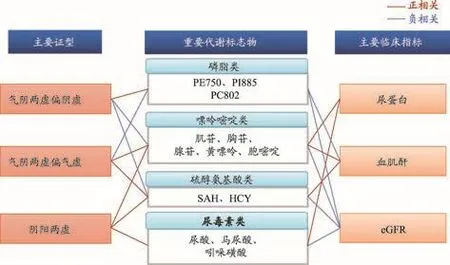
图5 DN中医分型对应的代谢标志物群[6]
基于西医分期研究,得到包括4个代谢物(肌苷、腺苷、腺苷同型半胱氨酸和亚油酸)以及4个临床生化指标(肾小球滤过率、尿蛋白、尿素氮和血肌酐)在内的指标群,可作为表征DN发生发展及治疗药物疗效评价的指标[6]。在不同层次的潜在生物标志物体系判别分析中,临床生化指标群的预测准确率为74.7%,以代谢指纹谱筛选的生物标志物及与DN发生发展密切相关的嘌呤嘧啶类代谢标志物和潜在基因生物标志物的预测准确率分别为74.5%、78%和37.7%,整合生物标志物体系的预测准确率最高(综合预测准确率为98.9%)。
基于中医辨证分型,发现了与不同证候显著相关的潜在代谢标志物群(图5),进一步聚焦得到包括4个代谢物(肌苷、腺苷、胞嘧啶、S-腺苷同型半胱氨酸)、4个临床生化指标(尿蛋白、肾小球滤过率、尿素氮、血肌酐)和5个中医症状指标(倦怠乏力、腰膝酸软、气短懒言、手足心热和浮肿)的DN中医证候诊断整合指标体系。
综上所述,通过对DN的西医分期和中医辨证分型进行的横断面临床系统生物学研究,初步探索了疾病的发展机制,建立的整合生物标志物体系为后期DN的早期诊断和疗效评价提供了潜在的指标。
3.3 糖肾方治疗DN的临床系统生物学研究
3.3.1 糖肾方临床系统生物学研究的多组学分析
本研究针对“3.1节”糖肾方治疗DN的循证医学临床研究病例开展了临床系统生物学研究,安慰剂组和糖肾方治疗组患者采用临床生化指标进行药效评价的同时,收集血浆进行了临床系统生物学研究。
通过建立血浆miRNAs表达谱筛选得到与糖肾方治疗作用相关的59个潜在miRNAs标志物(图6A);蛋白质组学研究发现了228个蛋白质的表达随糖肾方治疗发生显著变化(图6B);定量代谢组学研究发现糖肾方治疗后,患者血浆代谢状态趋向正常对照(图6C)。对上述临床系统生物学研究数据进行生物信息学分析,聚焦构建了糖肾方作用的关键调控网络图(图6D所示)。糖肾方通过调节PPAR信号通路、脂肪细胞因子信号通路、Jak-STAT、细胞因子-细胞因子受体相互作用通路、脂肪酸代谢等信号通路参与调控机体的免疫功能、炎症反应、代谢紊乱及细胞凋亡等功能,发挥其治疗DN的作用。
3.3.2 PPAR通路是糖肾方治疗DN的关键(君)通路之一
PPAR(过氧化物酶体增殖物激活受体)通路在脂肪细胞分化、脂肪酸代谢、胰岛素抵抗中起重要作用[38,39]。对富集到PPAR通路的潜在标志物进行定量测定,部分结果(图6E)所示。miR-7108-5p和miR-6833-3P分别负调控adiponectin和MMP-1蛋白质表达,从而有效控制了最终代谢产物饱和游离脂肪酸与游离脂肪酸的水平,给药6个月后,其总量均显著下降(P<0.05)。虽然安慰剂对照组通过基础治疗也可在一定程度上调控潜在标志物表达与脂肪酸水平,但整体疗效不如糖肾方,从代谢物水平证实了糖肾方对PPAR通路的调节作用[34,36]。
综上所述,糖肾方对延缓DN发展具有良好的疗效,PPAR通路是糖肾方发挥特有调控作用的关键(君)通路之一。
3.4 糖肾方化学物质组学分层次整体研究
化学物质组学把具有明确临床疗效的复方中药作为整体化学物质组,以生物活性为导向,层次化、逐层递进地逐步筛选出具有最小化学组成但仍保留其疗效的最优化学物质组,有自上而下和自下而上两种应用模式(图7)。糖肾方(TSF)由黄芪、生地黄、山萸肉、三七、大黄、鬼箭羽、枳壳等7味中药配伍而成。采用高效液相色谱-高分辨质谱技术对糖肾方(整体化学物质组)及各配伍药材(各子化学物质组的)的化学成分进行全息表征和解析鉴定,鉴定了糖肾方中9大类73个化学成分的结构(表2)。
进而整合网络药理学、糖肾方治疗DN临床系统生物学、动物模型系统生物学研究及分子生物学研究中发现的糖肾方调控的关键通路信息,筛选预测其治疗DN的有效组分群(表2),提示糖肾方中各味药材(子化学物质组)通过各自药效物质基础(有效化学物质组),各司其职,通过对肾组织纤维化、糖脂代谢紊乱、免疫调节、炎症反应和细胞凋亡等的调节发挥药效。
采用Luciferase reporter稳定转染细胞株技术,分析糖肾方系列方药对TGFβ1/Smad、AP-1、STAT3、NF-κB及NRF2等5个信号通路的影响。方中枳壳、鬼箭羽和大黄对TGFβ1/Smad通路(纤维化发生发展关键通路)和AP-1通路(体内重要的转录因子,高糖状态能上调TGFβ1、Fibronectin等基因)均具有抑制作用;黄芪对NRF2通路(调控氧化应激)具有明显上调作用,其有效成分为毛蕊异黄酮-7-β-O-D-葡萄糖苷[40]。后续研究中,将采用现代色谱分离技术靶向制备各有效组分群,深入探究各个配伍化学信息与药效信息的相关性,弄清各组分之间的相互关系,去粗存精,重新配伍构成有效化学物质组。并综合考虑各成分的口服生物利用度、吸收、分布、代谢和排泄等特征,发现和辨识有效成分群。
3.5 糖肾方干预动物模型的整体系统生物学研究
db/db小鼠是目前使用最广泛的2型糖尿病小鼠模型[41]。db/db小鼠8周龄血糖明显升高,出现白蛋白尿,12周起出现明显肾损伤,其病程进展与人类相似。故本研究采用db/db小鼠作为DN早期病变的动物模型,整合基因组学、蛋白质组学、代谢组学和网络药理学开展了糖肾方治疗DN的整体系统生物学研究,进一步验证并阐释其作用机制。
3.5.1 经典药理学评价
8周龄雄性db/db小鼠随机分为模型组、糖肾方组及阳性对照组(氯沙坦),db/m小鼠(C57/BL6)作为正常对照组,连续给药12周。相较于模型组,糖肾方干预可显著抑制db/db小鼠血糖升高和尿白蛋白排泄增加;改善DN发展所致胰岛形态不规则,胰岛内细胞数目变少且排列分布不均匀等胰岛组织病变;同时可减轻模型动物肾小球肥大和肾组织纤维化程度(图8),提示糖肾方减轻肾组织损伤,减缓DN发展[42,43]。
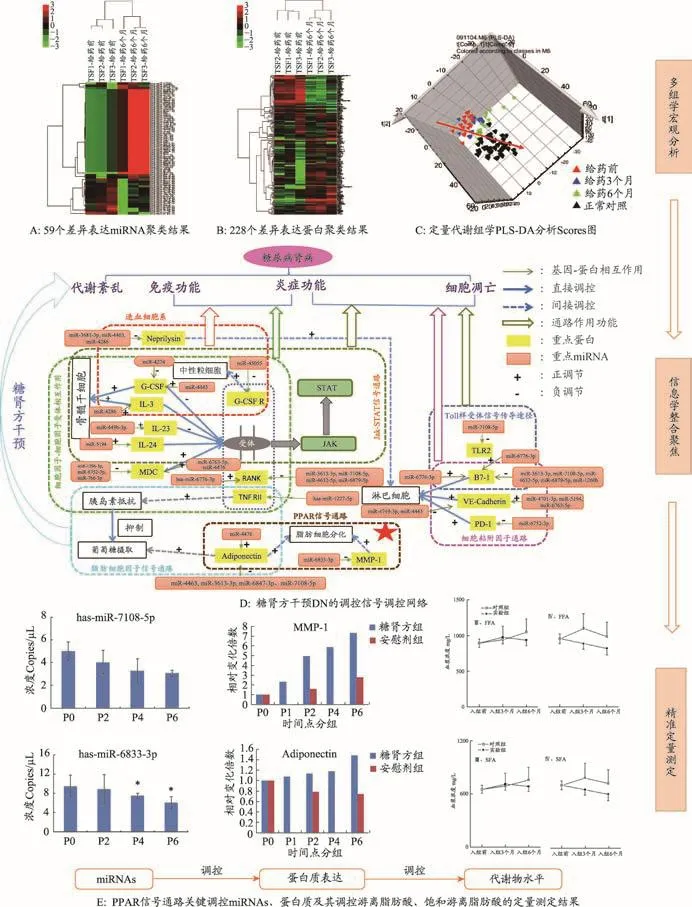
图6 基于临床系统生物学研究构建的糖肾方作用调控网络图
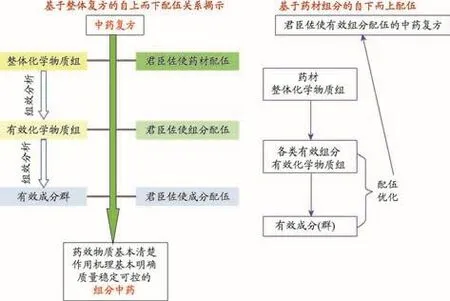
图7 中药化学物质组学的“自上而下”、“自下而上”两种分层次、逐层递进的应用模式[7]
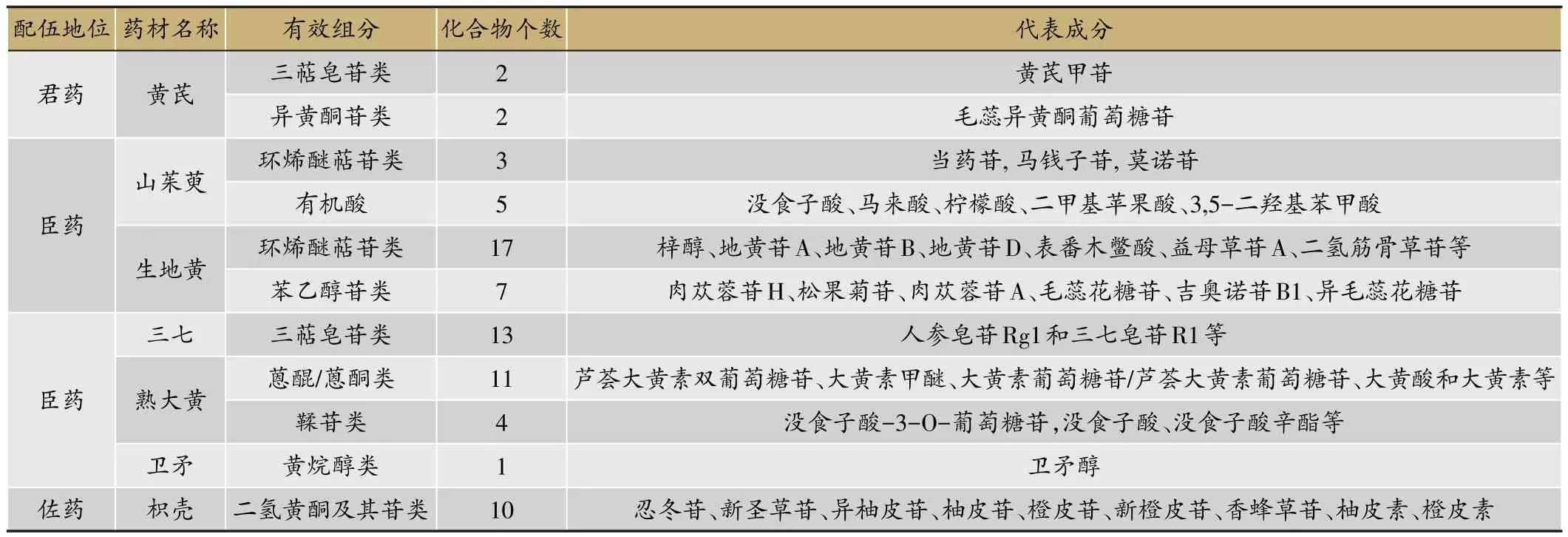
表2 糖肾方整体化学物质组化学成分
3.5.2 基因组学研究
建立给药0周和12周各实验组小鼠肾组织基因表达谱,通过与模型组比较,糖肾方组筛选得到1670个差异表达基因,其中上调1177个,下调127个。对其进行通路富集分析,发现糖肾方主要通过调控Jak-STAT、细胞因子-细胞因子受体相互作用、MAPK信号通路、嘌呤代谢、胰岛素、Wnt等14条通路发挥其对db/db小鼠的治疗作用。
3.5.3 蛋白质组学研究
细胞因子及其受体广泛参与了DN的肾脏微血管病理生理过程,可影响到细胞外基质成分的积聚、细胞肥大和细胞增生等诸多方面[44]。本研究从肾脏蛋白质表达水平探索了糖肾方的作用机制。采用蛋白质芯片建立肾脏组织中640个蛋白因子的表达谱,组间比较筛选得到275个差异表达蛋白质与糖肾方疗效相关。对其聚类分析发现,相较于安慰剂组,糖肾方组样本不仅聚为一类,而距离模型组更远,说明其对db/db小鼠的干预作用更为显著。对差异表达蛋白质进行通路富集发现,JAK-STAT和细胞因子-细胞因子受体相互作用是显著性最高的两条通路。
图8 基于db/db小鼠模型的整体系统生物学研究
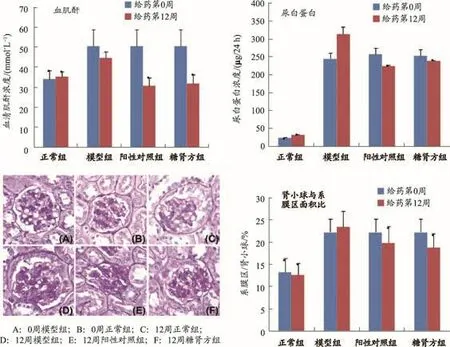
图8 -1基于db/db小鼠模型的整体系统生物学研究之“经典药理评价”
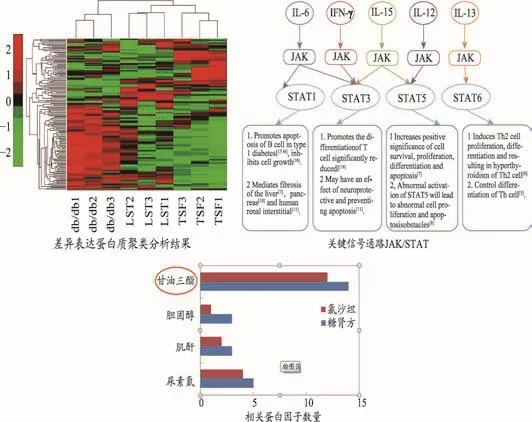
图8 -2基于db/db小鼠模型的整体系统生物学研究之“基因组学”
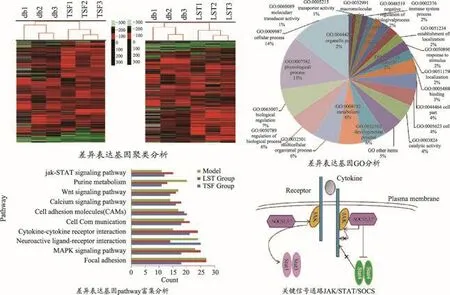
图8 -3基于db/db小鼠模型的整体系统生物学研究之“蛋白质组学”
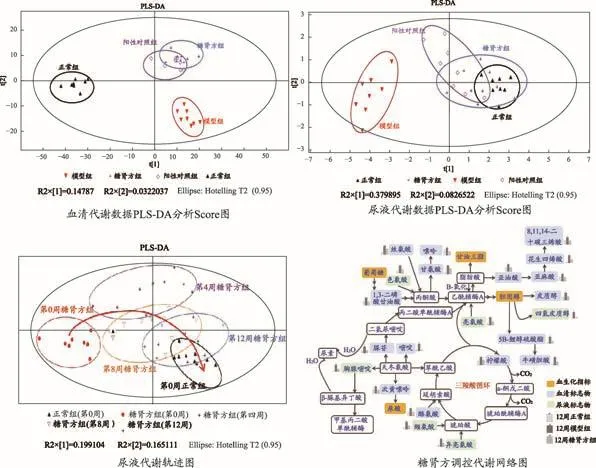
图8 -4基于db/db小鼠模型的整体系统生物学研究之“代谢组学”
整合分析基因组学和蛋白质组学研究结果,发现Jak-STAT信号通路是最关键的信号通路之一。对富集到Jak-STAT通路的5个蛋白因子IL-2、IL-6、IL-13、IL-15、IFNγ和 7 个 基 因 JAK1、JAK2、STAT3、STAT4、SOCS1、SOCS3、SOCS7进行了定量测定。糖肾方治疗12周,IL-2,IL-6,Il-15和IFNγ的表达增加,而IL-13表达下降,其通过竞争抑制Jak-STAT和炎症介质的生成抑制炎症反应,缓解脏纤维化;基因表达除Stat4被抑制外,其它6个均被激活,提示糖肾方可使SOCS家族过度表达,负反馈调节Stat4的表达,使得血糖水平得到控制,改善DN肾组织的生理病理特征,从而达到对DN的治疗作用。
3.5.4 代谢组学研究
本研究采用UPLC/TOF-MS对给药前后db/db小鼠的血清和尿液进行了代谢组学分析。血清代谢组学数据PLS-DA分析显示,糖肾方组和阳性对照组聚集在一起,与模型组及正常组达到较好分离,说明药物干预后db/db小鼠的代谢状态发生明显改善,趋向正常。组间对比筛选鉴定得到16个与糖肾方作用相关的潜在代谢生物标志物,涉及三羧酸循环、氨基酸、嘌呤嘧啶、胆汁酸合成以及α-亚麻酸和亚油酸循环等代谢途径。db/db小鼠给药前后尿液代谢轨迹图可以看出,随着给药时间的增加,小鼠尿液代谢状态偏离模型组,趋向正常,趋势较血清代谢更为明显。筛选鉴定的10个潜在代谢标志物主要涉及氨基酸代谢、嘧啶代谢和固醇类代谢。
综上所述,基于db/db小鼠模型的整体系统生物学研究证实糖肾方治疗DN确有疗效,其可能通过调节Jak-STAT、细胞因子-细胞因子相互作用通路、MAPK、嘌呤代谢、Wnt等信号通路,调控模型动物小鼠能量代谢、嘧啶代谢及固醇类代谢紊乱,这与临床研究发现的关键通路略有不同。临床研究显示糖肾方调节的关键通路是PPAR信号通路,其次为脂肪细胞因子、Jak-STAT等信号通路。其原因可能与db/db小鼠主要发病机制为脂代谢异常与炎症反应相关。由此可见,动物模型不能完全模拟临床疾病,在实际研究中,应建立不同诱导机制的多种模型,才能为临床疾病及研究提供更科学、全面的研究参考。
3.6 基于网络药理学的TSF干预DN作用靶点和信号通路预测
“网络药理学”[20]可通过分析药物对疾病网络的干预,构建“药物-靶点-疾病”网络,为阐释中药及其复方多成分、多途径、多靶点协同作用的原理提供了新的思路和视角。本研究采用网络药理学方法从整体性的角度对TSF干预DN的作用靶点和作用机制进行探讨。
3.6.1 潜在作用靶点和通路预测
采用PharmMapper反向药效团模型预测了TSF整体化学物质组中73个成分的206个潜在作用靶点。通过Drugbank数据库搜索已被FDA批准注册的用于治疗DN的西药及其对应的靶点信息,共得到治疗DN疾病的西药主要有31种,共有43个作用靶点。通过GeneCards数据库和OMIM数据库搜索已报道的、与DN相关的基因,去除重复基因和假阳性基因,结果显示共有174个基因参与调控DN的发生和发展。
采用Pharmmaper预测TSF中的化学成分有206个潜在作用靶点,与DN相关的靶点有21个,与FDA批准的西药共同作用的靶点有5个。其中ACE(血管紧张素转换酶)、CFTR(囊性纤维化跨膜传导调节蛋白)、HMGCR(3-羟基-3-甲基戊二酸单酰辅酶A还原酶)和INSR(胰岛素受体)等4个靶点为TSF和西药(FDA drugs)共同调控、与DN相关的基因靶点。
作用于CFTR和INSR靶点的西药分别为格列本脲和甘精胰岛素等,是临床上较为常用的控制血糖的药物。来源于山茱萸中的环烯醚萜类化合物当药苷(Sweroside)与格列本脲同作用于CFTR靶点。CFTR是葡萄糖依赖性的电活性和胰岛素分泌β细胞的调节器[45]。生地黄中的环烯醚萜苷类化合物乙酰基梓醇(Acetylcatalpol)、地黄苦苷元(Rehmapicrogenin),苯乙醇苷类化合物肉苁蓉苷A、肉苁蓉苷H和松果菊苷,以及枳壳中的柚皮苷(Narirutin)均作用于INSR靶点,该基因编码胰岛素受体不同亚型的两个转录变异体,与胰岛素具有特殊的亲和力,受体基因突变或缺失、合成减少或降解加速,亲和力降低、β亚单位酪氨酸激酶活性降低,均可导致胰岛素抵抗的发生,从而导致血糖升高。ACE可催化将血管紧张素I转化为具有生理活性的血管紧张素II。抑制ACE的活性可延缓DN的进展[46],肾ACE2的脱落介导DN的疾病机制,并且尿ACE2可以作为肾损伤的预警指标,抑制其活性有助于保护肾功能[47]。血管紧张素转换酶抑制剂类(ACEI)药物是目前公认的在预防和治疗DN、减少尿蛋白排泄最有效的药物,作用于ACE的西药为依那普利、苯那普利、卡托普利、福辛普利、培哚普利、西拉普利等ACEI类药物,山茱萸中的马来酸(Malic acid)作用于该靶点。脂代谢异常在糖尿病微血管病及DN的发病机制和进展中起到重要作用,调节脂代谢紊乱对控制糖尿病及其并发症、降低DN心血管病发生率和病死率具有重要意义,他汀类降脂药是最为常用的脂代谢紊乱调节剂;山茱萸中的环烯醚萜类化合物马钱子苷(Lo⁃ganin)与他汀类药物共同作用于HMGCR靶点,而该靶点是胆固醇合成的限速酶。
综上所述,TSF中主要化学成分具有与西药相同的作用靶点,一方面提示TSF具有控制血糖,调节脂代谢紊乱,调整血压和减少尿蛋白排泄等药理作用,另一方面揭示了中药多成分、多靶点、多途径的作用特性。
将TSF潜在作用靶点、DN相关靶点基因及DN的西药作用靶点基因分别导入DAVID数据库,进行GO分析和KEGG通路分析,TSF对DN的调控作用主要涉及73条通路,FDA批准的西药对DN的调控作用主要涉及20条通路,其中有14条通路为TSF和FDA批准的西药共同调控的通路。另有9条通路,为已经系统生物学研究验证的TSF调控通路,但在网络药理学研究中,并未预测到它们是DN疾病相关靶点基因注释通路。
3.6.2 关键通路
根据TSF中主要化学成分潜在作用通路、DN发生发展相关通路以及治疗DN西药的潜在作用通路,整合系统生物学研究结果,选择经系统生物学验证的TSF调控DN的关键通路,分别为磷脂酰肌醇-3-激酶-丝苏氨酸蛋白激酶信号通路(PI3K-Akt signaling path⁃way)、蛋白激酶信号传导信号通路(MAPK signaling pathway)、氧化物酶体增殖物激活受体信号通路(PPAR signaling pathway)、胰岛素抵抗通路(Insulin re⁃sistance)、胰岛素信号通路(Insulin signaling pathway)、肿瘤坏死因子信号通路(TNF signaling pathway)、FcεRI信号通路(Fc epsilon RI signaling pathway)、T细胞受体信号通路(T cell receptor signaling pathway)、核苷酸寡聚化域样受体信号通路(NOD-like receptor sig⁃naling pathway)、粘着斑(Focal adhesion)和血管内皮生长因子信号通路(VEGF signaling pathway)等11条通路。
图9所示为TSF中73个活性成分作用于206个靶点注释的11条关键通路及其对应的生物学功能,提示TSF通过对胰岛素抵抗和糖脂代谢紊乱的调控,以及免疫功能和炎症反应的调节作用,改善肾组织纤维化状态和细胞凋亡而治疗DN[48-55]。其中TSF对PPAR信号通路、PI3K-Akt信号通路的调控作用在其治疗DN的临床系统生物学研究和分子生物学研究中得到验证。但也有一些在整体系统生物学研究中发现的通路在网络药理学富集通路中未能找到,推测有两方面原因,一方面是由于网络药理学是建立在已有的西药小分子作用靶点数据库基础上的,其收录内容受数据库内容所限,影响预测结果;另一方面网络药理学预测工具所采用算法的局限性也会影响预测结果,这两点原因也是现在网络药理学研究亟待突破的问题。
3.7 由关键作用的通路溯源“有效化学成分群”
基于前述从临床出发,以通路为靶标的研发策略,以糖肾方为例,开展了基于信号通路的新药发现(图10),该新药发现策略可为后续新药研发提供药理机制比较明确、具有开发前景的候选新药。
整合糖肾方网络药理学预测和临床系统生物学研究结果,得到PPAR、2型DN、脂肪因子和淀粉和蔗糖代谢4条重要通路。其中,PPAR和脂肪因子信号通路所涉及的功能和靶点类似;2型DN涉及的西药主要是胰岛素和格列类降糖药,与胰岛素水平和机体对胰岛素的敏感性相关;淀粉和蔗糖代谢主要是阿卡波糖的靶点,其功效为配合饮食控制治疗2型糖尿病。考虑到DN患者已是糖尿病发展的中后期,出现严重并发病,通过合理控制饮食已很难控制或逆转疾病。因此,优选关键(君)信号通路PPAR和2型DN两条通路开展“有效化学成份群”溯源。通过富集在关键通路中的中药成分预测靶点,逆向寻找对应的有效化学成分,并确认药材归属,结果详见表3。
从表3可知,作用于PPAR信号通路的中药为:黄芪(2)、三七(6)、山茱萸(1)、熟大黄(3)、卫矛(1)、生地黄(2);作用于2型DN信号通路的中药为:枳壳(1)、生地黄(5)、熟大黄(1)。黄芪具有益气固表、利水消肿的功效,黄芪甲苷是黄芪的主要有效成分;三七具有活血化瘀的功效,人参皂苷Rg1和三七皂苷R1是三七的主要成分,它们作用于PDPK1、RXRA和RXRB3个靶点;山茱萸具有补益肝肾的功效,二甲基苹果酸酯对FABP5和RXRB具有潜在调控作用,但二甲基苹果酸酯是山茱萸中的微量成分,莫诺苷为山茱萸特征性指标成分,且对高糖致人脐静脉内皮细胞损伤有保护作用,可降低糖尿病大鼠血糖、尿蛋白、血清白蛋白和总蛋白水平。生地黄具有清热生津的功效,其中主要的环烯醚萜苷类成分潜在的作用靶点为PDPK1和IN⁃SR。综合药效预测、药材的功效、有效成分的含量及药理活性,进行后续验证的中药候选复方优选来自黄芪、三七、山茱萸和生地黄的5个药效成分:人参皂苷Rg1、三七皂苷R1、黄芪甲苷、莫诺苷、梓醇。
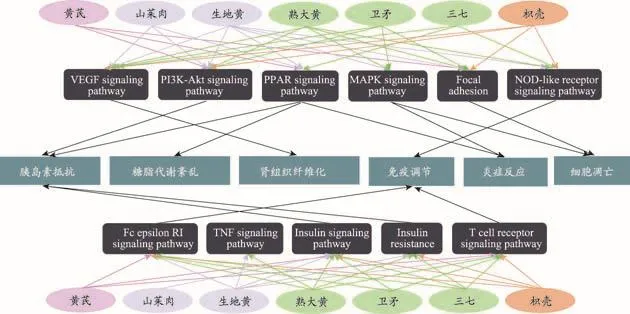
图9 “药材-通路-生物活性”关系网络图
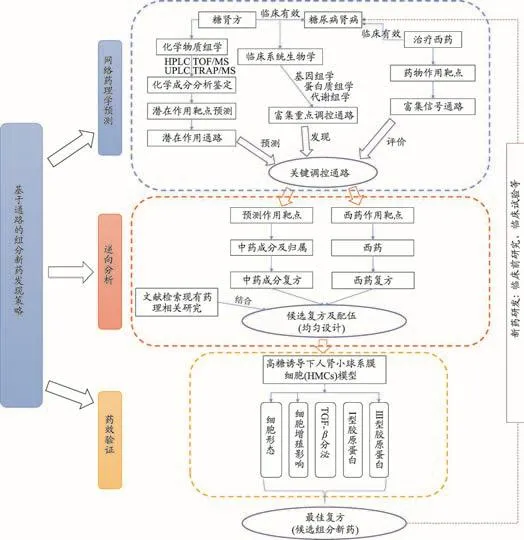
图10 基于信号通路的组分新药发现策略示意图
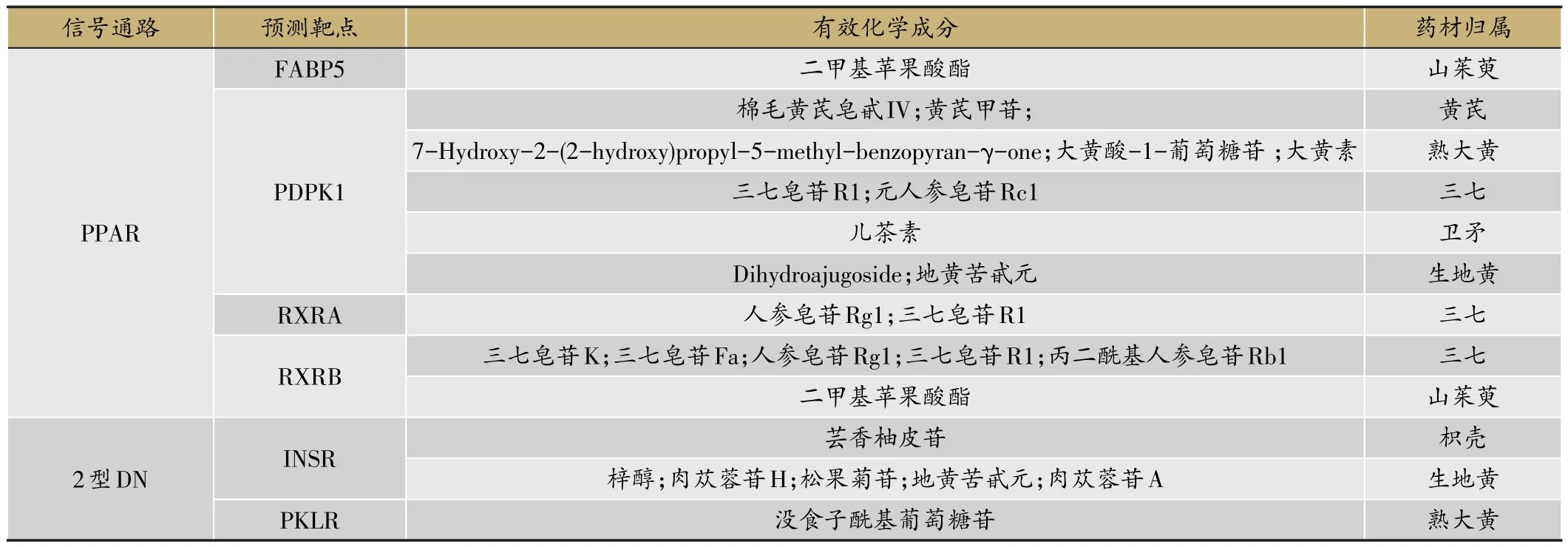
表3 PPAR信号通路中中药预测靶点对应的成分及药材归属
3.8 分子生物学验证
由3.6节所得11条重要通路,除了系统生物学研究得到的真实通路之外,需对网络药理学预测的通路进行了分子生物学验证。
3.8.1 NF-κB信号通路和TGF-β/Smad3通路
TSF可显著降低高脂饮食合并链尿佐菌素诱导的DN模型大鼠肾小球系膜基质百分比和肾小管损伤指数;显著降低模型大鼠微量白蛋白尿、血清甘油三酯、胆固醇和低密度脂蛋白水平。TSF可抑制Smurf2表达,减少smad7水解,从而一方面促进IκBα表达,抑制NF-κB驱动的炎症反应;另一方面降低Smad2/3磷酸化水平,减轻TGF-β/Smad3介导的肾脏纤维化[40]。TSF可改善db/db模型小鼠在DN发展所致胰岛形态不规则,胰岛内细胞数目变少且排列分布不均匀等胰岛组织病变;减轻模型动物肾小球肥大,减轻纤维化程度。该保护作用的机制可能是:TSF抑制NF-κB通路诱导的炎症因子异常升高,阻断miRNA21介导的TGF-β/Smad通路,减少纤维化I、IV型胶原积聚,通过调控JAK/STAT/SCOS通路同时改善了炎症与纤维化,减少其对肾小球滤过屏障及肾小管重吸收功能的损害,降低尿蛋白的排泄[56]。
此外,TSF可降低db/db小鼠体重和肝脏系数,抑制尿白蛋白排泄增加,降低血脂水平,显著改善模型小鼠脂质代谢紊乱和肝脏脂肪变;相关机制与TSF通过AMPK/SREBPs及其下游靶基因显著抑制db/db小鼠肝组织脂质生成、通过Sirt·PGC1α-1增加肝组织与骨骼肌脂肪酸氧化利用,调节PI3K/Akt/mTOR信号通路及巨噬细胞活化等代谢途径相关[57]。
3.8.2 TSF对2型糖尿病胰岛素抵抗的调节作用及机制研究
TSF可促进HepG2胰岛素抵抗细胞模型的葡萄糖消耗,降低细胞中甘油三酯的蓄积,改善细胞糖脂代谢,并增加细胞中超氧化物歧化酶(SOD)和降低丙二醛(MDA)含量,改善细胞氧化应激状态。TSF对HepG2胰岛素抵抗细胞模型中PI3K/AKT/SREBP-1c通路上6个重要功能基因的表达定量结果表明,与模型组相比,TSF可显著增加HepG2胰岛素抵抗细胞模型中PI3K p58、AKT1、GLUT4、PPARα基因表达水平,显著降低SREBP-1c和FASN基因表达水平,表明TSF可通过调节PI3K/AKT/SREBP-1c通路重要基因表达干预2型糖尿病胰岛素抵抗的作用。
3.9 基于细胞模型的候选复方新药优化和验证
DN特征性的病理改变为肾小球基底膜均匀肥厚伴有肾小球系膜细胞基质增多、肾小球囊和肾小球系膜细胞呈结节性肥厚及渗透性增加[58,59]。系膜细胞的生理特性决定了它是DN众多致病因子作用的主要靶细胞之一。采用高糖刺激下人肾小球系膜细胞(HMC)模型,对候选复方(人参皂苷Rg1、三七皂苷R1、黄芪甲苷、莫诺苷、梓醇)进行了初步处方优化及药效评价。
3.9.1 候选复方的处方优化
首先成功建立高糖刺激下HMC模型,确定高糖刺激48 h细胞增殖异常显著,且可持续至72 h,因此,确定高糖刺激造模时间为48 h。基于此模型,通过细胞活性考察确定了5种中药成分的浓度考察范围,发现复方作用优于单成分作用,其中,黄芪甲苷为1-10 μM;人参皂苷Rg1为25-60 μM;三七皂苷R1为1-10 μM;梓醇为1-10 μM;莫诺苷为1-10 μM。
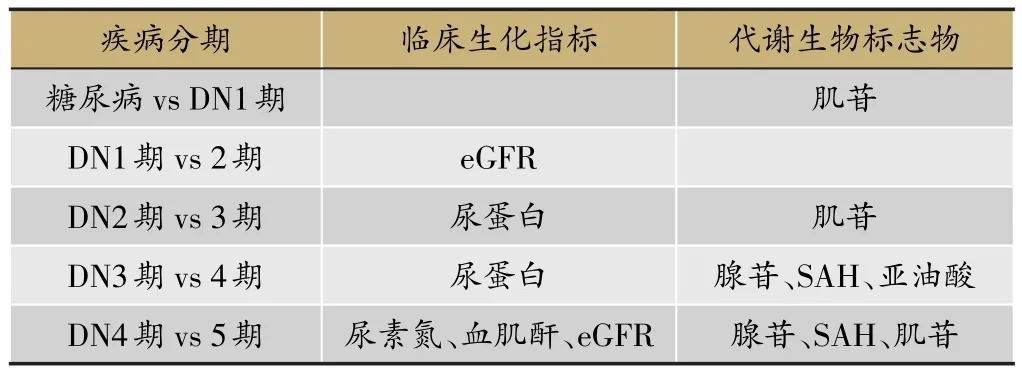
表4 糖尿病不同分期聚焦整合生物标志物群
其次,采用5因素10水平的均匀设计试验对复方组成的配伍比例进行优化,筛选确定水平3(黄芪甲苷3.0 μM、三七皂苷R1 56.1 μM、人参皂苷Rg1 1.0 μM、梓醇4.0 μM、莫诺苷5.0 μM)为最佳复方配伍,其对高糖导致的HMC的异常增殖抑制作用最为显著且作用稳定,且优于各单成分作用。
3.9.2 优化复方对细胞外基质TGF-β1、Col I和Col III分泌的影响
分泌转化生长因子β1(TGF-β1)和胶原蛋白在糖尿病肾脏疾病的发病机制中起重要的角色[60],持续高糖刺激能促进很多与DN发病相关的细胞因子(如TGF-β1、Col I和Col III、ANG II和VEGF等)的表达。本研究所建立的高糖刺激下HMC的TGF-β1、Col I和Col III外分泌均显著增加;而加入最佳配伍复方后,高糖刺激下HMC的TGF-β1、Col I和Col III的异常分泌均具有显著改善,蛋白表达水平均接近正常细胞(P>0.05),且优于各单体化合物的作用,体现了中药复方配伍增效的作用。
3.10 由临床系统生物学聚焦而得整合生物标志物体系和应用
基于DN横断面的临床生物学研究,构建了整合临床指标、代谢生物标志物和基因生物标志物的生物标志物体系。其中包括11种临床指标:血糖控制指标(空腹血糖、餐后2小时血糖、糖化血红蛋白)、肾功能指标(尿蛋白、血肌酐、尿素氮、肾小球滤过率估算值)和血脂指标(胆固醇、甘油三酯、高密度脂蛋白和低密度脂蛋白);41种代谢生物标志物(图2B);5种基因标志物:CDKAL1,IGF2BP2,AR,AGT和MTHFR。
3.1 0.1 整合生物标志物体系的临床应用评价
将整合生物标志物体系中各生物标志物含量与临床生化指标进行相关性分析,结果显示其与临床表征肾病的肾功能指标(尿蛋白、肾小球滤过率、尿素氮和血肌酐)和表征糖尿病的血糖控制指标(糖化血红蛋白和餐后血糖)具有显著相关性,表明将生物标志物用于临床诊断是可行的,但是该体系包含生物标志物数目众多,不适于临床实际检测。研究中发现不同类型的标志物在疾病进程中的作用并不相同,例如磷脂类代谢物主要与血糖控制指标相关,游离脂肪酸类代谢物主要与肾功能及肾损伤指标相关;前者在进行预测诊断时,较适合用于糖尿病的诊断,后者较适合用于DN不同分期的诊断。因此,有必要对所建立的整合生物标志物体系进行聚焦、评价,探索疾病早期诊断、风险评估和药物筛选的最佳生物标志物体系。
3.1 0.2 整合生物标志物体系聚焦分析及应用
(1)DN早期风险评估指标聚焦和评价
通过对DM和DN各期生物标志物的聚焦分析发现肌苷和eGFR水平结合对DN 1期和2期具有较高的分离能力,利用肌苷和eGFR水平经过PLS-DA聚类分析后,DM、DN 1期和2期患者可以实现较好分离。该研究为临床上缺乏DN的1期和2期准确诊断指标的问题提供了解决方法,并在国内外首次报告肌苷可以早期预测糖尿病肾病发生与进展[61]。加拿大卡尔加里大学Matthias教授以“代谢组学与2型糖尿病,从基础研究到临床应用”为题,给予了高度的评价[62]。
(2)DN治疗药物疗效评价指标聚焦和评价
应用建立的整合生物标志物体系,分别聚焦对DN各期具有诊断能力的生物标志物(表5)。将这3个阶段的指标进行整合,得到一个包含4个临床指标和4个代谢生物标志物的指标群,其对各个阶段的预测准确率均达到90%以上,可将其作为表征DN发生发展的重要指标,也可作为联合用药的疗效评价指标。
3.1 0.3 糖尿病肾病中医证候的可量化指标体系
整合生物标志物体系对气阴两虚偏阴虚、气阴两虚偏气虚和阴阳两虚患者的预测准确率接近100%。我们尝试用“整体表征”与“局部特征”结合的模式,聚焦建立了可量化中医证候的生物标志物群。通过对三种证候的8类34种症状进行分析,发现气阴两虚偏阴虚主要表现为阴虚内热、肾阴虚症状;偏气虚主要表现为肺气虚、肾阴虚症状;阴阳两虚主要表现为肾阳虚、肺气虚、肾阴虚及血瘀症状。并且通过相关性分析得到与这项症状显著相关的代谢生物标志物(表6),表明中医证候有其特定的物质基础,对其相关代谢物含量进行检测可实现证候的客观量化。
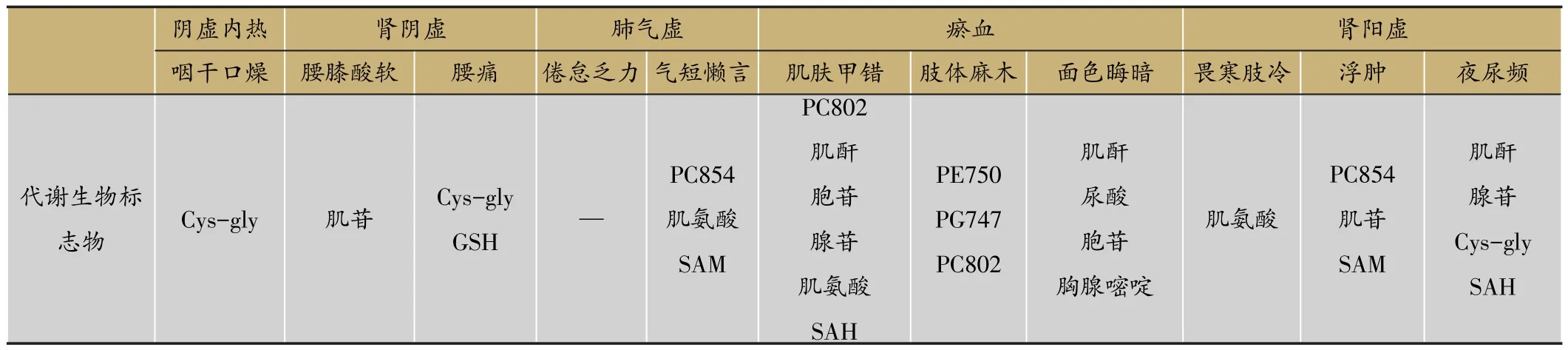
表5 与糖尿病肾病中医分型症状显著相关的代谢生物标志物
综上所述,基于临床系统生物学研究建立的整合生物标志物体系可以准确表征DN的发展进程,对其聚焦分析得到的不同生物标志物群,不仅可以分别用于DN早期风险评估、疾病精准分期及药效评价,而且大幅缩减标志物的数量,满足临床检验实际需求,使生物标志物检测进入临床应用成为可能。
3.11 传统新药研发过程
包括药学与临床前药理、药效学研究、急性毒性/长期毒性研究等临床前药学研究,临床试验阶段和上市后再评价。
4 展望
中国新药的研发模式基本上是遵循国际西药开发模式,缺乏科学理念(理论)的创新,局限在科学技术上的创新。如何将东方医学的精髓结合西方医学的优势,实现理念(理论)上突破,可能是中国现代药学发展中的卡脖子(瓶颈)科学问题。从2011年起,笔者从研究实践出发提出了新医药学的理念。新医药学或称整体系统医学(Holistic Systems Medicine,HSM),是以维护人体系统的整体健康为根本目标,融合现代医学药学,现代中医药学和现代生命科学,创立兼取所长,既高于现代的中医,也高于现代的西医,解决人类整体健康和疾病预防、治疗的整体系统医学[2]。迄今已连续发表五文[2-6],本文则是从整体系统医学中的新药研发出发,提出以复方新药为现代药学新的发展目标,并提出了相应策略、途径和我们的实践范例。
自1999年5月国家科技部启动实施“中药现代化”科技工作已经20年了,包括之后不久又调整为“中医药现代化”,中医药向何处去,发展的方向和目标究竟为何物,始终困扰着我们这一代学者。正如习近平主席在两院院士大会上指出的“我国科技在视野格局、创新能力、资源配置、体制改革等方面存在诸多不适应的地方。”解决的方法就是“发展科学技术必须具有全球视野。”“自主创新是我们攀登世界科技高峰的必由之路”。屠呦呦先生获诺贝尔奖后谈到:“中医药是宝库,但拿来就用还不够。”“如果死守着老祖宗的宝贝,固步自封,中药只能是‘一筐草’,无法变成‘一块宝’”。中医药是巨大宝库,但不能固步自封,传承是我们的责任,创新是我们的使命。中医药将和现代医学、生命科学融合,发展到毛泽东主席提出的“中国统一的新医学新药学”。我们强烈倡议设立中国“新医药学发展计划”,实现习近平主席提出的“主动发起全球性创新议题”。既促进中医学的发展,也促进西医学和生命科学的发展,为中国和全球老百姓健康福祉尽心尽力。

