高血压性脑出血微创治疗患者凝血功能与脑钠肽动态监测对治疗及预后的评估研究价值
周阳 邓永嘉 江美嫦 汤爱玲 关健明 张克胜
随着微创穿刺颅内血肿吸除方法在临床上的广泛应用,加上原有的内科处理, 让大多数HICH患者的血肿处理获得较满意的效果;然而一些患者的血肿尽管已经清除, 但预后仍较差, 这应归因于血肿周围的脑组织损害, 这种病灶周围的组织损害, 也称为HICH继发性损害[1-3]。凝血功能障碍是HICH常见的并发症, 另外脑损伤后BNP明显增高, 通过对两者的研究, 以期指导HICH微创术后的诊治及了解预后。
1 资料与方法
1.1 一般资料 选取2016年9月~2018年3月在本院住院并行微创手术治疗的92例HICH患者作为脑出血组, 其中男53例, 女39例;平均年龄(59.2±12.3)岁。纳入标准:均符合全国第四届脑血管病学术会议制定的诊断标准, 并由颅脑CT确诊, GCS 评分5~8分, 出血量>30 ml。排除标准:非HICH, 月经期妇女、合并急慢性炎症性感染、恶性肿瘤、严重肝肾病变、重症糖尿病、脑梗死或混合性脑卒中、自身免疫性疾病、长期服用抗凝药物、脑血管先天性畸形、外伤性颅脑损伤者。所有患者按照临床转归分为良好组(转归良好顺利出院, 75例)和恶化组(治疗过程病情恶化转手术治疗或死亡, 17例。)另选取同期本院体检的年龄、性别与HICH组相匹配的41例健康体检者作为对照组, 其中男22例, 女19例, 平均年龄(56.6±9.4)岁。两组研究对象的一般资料比较差异均无统计学意义(P>0.05), 具有可比性。
1.2 方法 健康体检者于体检当日清晨, 脑出血患者于入院时/术前、术后6 h、24 h、3 d、5 d、7 d、9 d、12 d、15 d抽肘正中静脉血检测APTT、PT、FIB、DDI及BNP水平。凝血指标检测采用日本Sysmex(原日本东亚公司)CS 5100型全自动血凝仪, 其中FIB与DDI通过免疫比浊法测定;血BNP测定应用电化学光法。脑出血患者于入院时行16排头颅CT检查, 根据公式计算血肿量:出血体积(ml)=1/2×长轴×短轴×层次高度;并于入院时及术后第3天行NIHSS评分。
1.3 统计学方法 采用SPSS19.0统计学软件对数据进行统计分析。计量资料以均数±标准差(±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。进一步两两比较应用LSD-t检验;采用Pearson相关因素分析脑出血患者血浆BNP、DDI水平与脑出血量及NIHSS评分的关系;应用受试者ROC分析血BNP、DDI在脑出血患者中的应用价值。P<0.05表示差异具有统计学意义。
2 结果
2.1 良好组、恶化组脑出血量及NIHSS评分比较 脑出血良好组入院时脑出血量明显少于恶化组, 且入院时及术后第3天的NIHSS评分均明显低于恶化组, 差异均有统计学意义(P<0.01)。见表 1。
表1 良好组、恶化组脑出血量及NIHSS评分比较( ±s)

表1 良好组、恶化组脑出血量及NIHSS评分比较( ±s)
注:与恶化组比较, aP<0.01
组别 例数 入院时脑出血量(ml) NIHSS评分(分)入院时 术后第3天良好组 75 42.9±8.9a 15.4±5.8a 17.9±7.1a恶化组 17 58.6±9.6 21.9±7.5 29.0±6.5 t 6.51 3.99 5.95 P<0.01 <0.01 <0.01
2.2 对照组及脑出血各组不同时间凝血功能、BNP水平比较 脑出血恶化组术后6 h、1 d、3 d、5 d、7 d的APTT明显高于对照组(P<0.05), 且1 d、3 d、5 d的APTT均高于良好组(P<0.05)。脑出血恶化组术后6 h、3 d、5 d的PT明显高于对照组(P<0.05), 且3 d、5 d的PT均高于良好组(P<0.05)。脑出血良好组FIB从术后第3天开始升高, 7 d达高峰, 然后开始下降, 6 h、1 d、3 d、5 d、7 d、9 d的FIB与对照组比较,差异均有统计学意义(P<0.05);脑出血恶化组FIB从术后第5天开始升高, 7 d达高峰, 峰值高于良好组;良好组术后3 d、9 d、12 d的FIB与恶化组比较, 差异均有统计学意义(P<0.05)。脑出血良好组术后6 h的DDI开始升高, 3 d达高峰, 其后下降, 6 h、1 d、3 d、5 d、7 d、9 d、12 d均明显高于对照组(P<0.05);脑出血恶化组术后6 h的DDI开始升高, 3 d达高峰, 其后仍维持高水平;恶化组术后3 d、5 d、7 d、9 d、12 d、15 d的DDI均明显高于对照组和良好组(P<0.05)。脑出血良好组、恶化组的术后6 h的BNP开始升高, 3 d达高峰, 良好组BNP高峰后开始下降, 恶化组仍维持高水平, 两组术后6 h、1 d、3 d、5 d、7 d、9 d、12 d、15 d的BNP比较差异均有统计学意义(P<0.05);且两组上述时间的BNP与对照组比较, 差异均有统计学意义(P<0.05)。见表2。
表2 对照组及脑出血各组不同时间凝血功能、BNP水平比较( ±s)

表2 对照组及脑出血各组不同时间凝血功能、BNP水平比较( ±s)
注:与对照组比较, aP<0.05;与恶化组比较, bP<0.05
组别 例数 时间 APTT(s) PT(s) FIB(g/L) DDI(mg/L) BNP(pg/ml)对照组 41 29.2±3.3 12.3±1.2 3.00±0.57 0.34±0.12 61.2±243.8良好组 75 0 h 29.9±3.7 12.5±1.1 3.05±0.70 0.31±0.14 61.6±30.4 6 h 31.6±5.0a 13.5±1.8a 2.67±0.70a 0.42±0.20a 101.8±38.1a 1 d 30.6±4.3 12.4±1.6 2.74±0.70a 2.45±1.79a 452.5±229.9a 3 d 28.9±4.4 11.9±1.4 4.20±1.10a 2.84±1.44a 673.2±264.7a 5 d 27.6±3.9a 12.0±1.7 4.48±1.40a 1.42±0.84a 318.7±214.6a 7 d 28.7±5.1 12.4±1.8 4.65±1.30a 1.04±0.95a 171.2±105.1a 9 d 29.1±4.5 11.9±1.6 3.31±1.00a 0.63±0.84a 129.2±74.3a 12 d 28.3±5.1 11.9±1.3 2.82±0.67 0.47±0.31a 101.3±39.3a 15 d 29.2±3.9 12.2±1.3 2.97±0.70 0.68±1.23 90.2±29.5a恶化组 17 0 h 30.8±3.8 12.6±1.2 3.01±0.60 0.32±0.16 59.1±25.4 6 h 33.3±5.0a 14.0±2.1a 2.38±0.70a 0.57±0.40a 151.1±55.4ab 1 d 33.4±4.3ab 12.9±1.6 2.49±0.60a 2.96±2.05a 797.3±444.6ab 3 d 35.4±8.4ab 14.2±2.3ab 3.00±0.70b 3.62±1.38ab 1325.1±856.0ab 5 d 31.2±5.3ab 13.1±1.8ab 4.10±1.00a 3.54±1.03ab 1283.5±898.2ab 7 d 31.2±3.8a 12.6±1.6 5.02±1.10a 3.51±1.69ab 882.0±426.9ab 9 d 29.5±3.8 12.2±1.3 4.43±0.62ab 2.65±1.34ab 453.9±202.3ab 12 d 28.7±3.5 12.4±1.3 3.63±0.82ab 2.03±1.00ab 402.9±187.8ab 15 d 29.5±3.6 12.5±1.3 3.35±0.80 2.73±1.14ab 442.2±258.9ab
2.3 BNP、DDI与脑出血量、NIHSS评分的相关性分析 脑出血患者DDI、BNP与对照组有明显差异, 且DDI、BNP均在第3天达高峰, 故选取术后第3天的 DDI、脑钠肽、NIHSS评分进行相关性分析, 结果显示, 脑出血患者血BNP与脑出血量及NIHSS评分呈正相关(P<0.05);而DDI与脑出血量及NIHSS评分相关性不明显(P>0.05)。见表3。
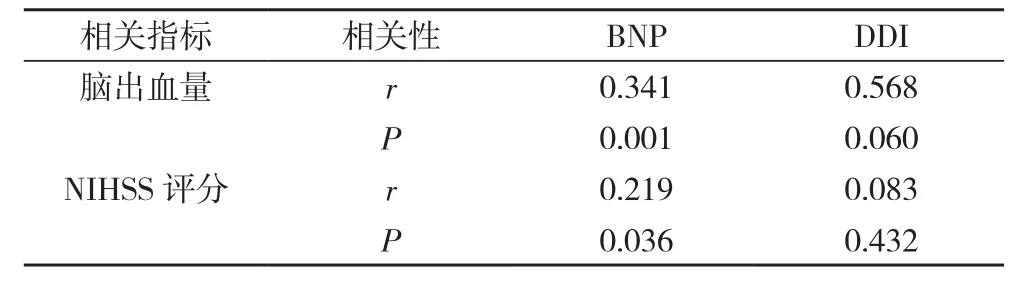
表3 BNP、DDI与脑出血量、NIHSS评分的相关性分析
2.4 血BNP、DDI峰值在脑出血不良预后中的应用价值 脑出血患者BNP、DDI峰值出现在术后第3天, 经ROC分析可知,BNP峰值诊断脑出血不良预后的AUC=0.753, P=0.001<0.05,95%CI(0.583, 0.923), 最佳临界值为784.5 pg/ml;DDI峰值诊断脑出血不良预后的AUC=0.677, P=0.023<0.05, 95%CI(0.537,0.817), 最佳临界值为4.205 mg/L。见图1。

图1 血BNP、DDI在脑出血恶化组患者中ROC曲线图
3 讨论
创伤性颅脑损伤可能激活凝血系统, 并继发纤溶亢进,导致消耗性凝血功能障碍, 引起进行性出血性损伤, 最终导致不良预后[4]。本研究HICH患者恶化组在术后5 d内APTT、PT要长于良好组, 提示术后凝血功能障碍, 主要表现为高凝后的消耗性低凝状态, 可能与血肿扩大、神经功能恶化、预后不良相关;与谢嵘等[5]报道相符。
本次研究结果显示, 良好组、恶化组术后6 h、1 d的FIB均明显低于对照组(P<0.05), 且恶化组FIB下降更明显,这可能与HICH患者早期激活凝血系统后消耗FIB所致。良好组FIB术后3 d开始升高, 恶化组FIB术后5 d开始升高,两组均在术后7 d达高峰, 高峰后下降, 但恶化组下降缓慢,两组术后9 d、12 d的FIB比较差异均有统计学意义(P<0.05)。有研究指出, 脑出血急性期FIB水平升高是应激性反应, 有利于脑出血后局部止血作用[6];而恶化组本身脑出血量大,机体应激反应更明显, 故FIB持续升高时间更长。
DDI是纤维蛋白单体活化交联后经纤溶酶水解后的最小片段, 是体内高凝状态后继发纤溶亢进的标志物之一。急性脑出血早期存在短暂的高凝状态, 高凝状态消耗大量凝血因子及血小板, 继发纤溶亢进, 导致DDI明显升高。王秀娟等[7]、范筱等[8]报道均指出, 脑出血急性期DDI水平越高,神经功能缺损越严重, 预后越差。本研究显示, HICH患者急性期DDI明显高于对照组, 恶化组显著高于良好组(P<0.05),与参考文献[7, 8]的研究结果基本相符。
BNP是一种肽类激素, 可以促进排钠、排尿, 具有较强的舒张血管作用, 对抗肾素-血管紧张素-醛固酮系统的缩血管作用, 临床上主要是评价充血性心力衰竭的一项指标[9-11]。多项研究表明[12-15], BNP水平可作为脑出血患者病情评价及预后的良好指标。
本研究中, HICH患者微创术后BNP水平明显高于对照组, 同时, 恶化组也显著高于良好组(P<0.05);随着脑出血量增加, 血BNP水平也明显升高, 经Pearson分析提示, BNP与脑出血量、NIHSS评分呈正相关(P<0.05)。本研究通过ROC分析, 血BNP、DDI峰值诊断脑出血不良预后有一定应用价值(P<0.05), BNP最佳临界值为784.5 pg/ml;DDI最佳临界值为4.205 mg/l。
综上所述, 血APTT、PT、FIB、DDI、BNP水平变化对判断HICH微创治疗患者病情进展及预后有重要意义, 其中BNP、DDI水平升高提示着更大的参考意义。

