类泛素蛋白FAT10在肺鳞癌中的表达及生物学作用
郝术安,王 钧
肺癌是一种常见的恶性肿瘤,治愈率低,严重影响人类的健康。随着社会经济的发展,大气污染的加重,呼吸系统疾病发病率增加的同时,肺癌的发病率、死亡率较前也明显增高,不仅增加了患者家庭的经济负担,也为社会带来了沉重的经济负担[1-3],因此备受社会关注。因其发病机制复杂,临床治疗效果参差不齐,对其发病机制及治疗的相关探索从未停止。按照发生部位、组织学特点可将肺癌细分为不同类型,其中肺鳞癌是肺癌中最为常见的一种类型,男性患者多于女性,因其发病与吸烟相关,其治疗效果差、生存率低,目前仍在不断努力寻找积极有效的治疗方案[4-5]。
FAT10是一种泛素样蛋白,是一种多肽分子,因为在其基因的编码区中包含2个泛素样区域,故又称双泛素,其具体作用机制至今尚未完全阐明,目前发现的作用机制有:(1)介导免疫炎症反应;(2)参与信号的转导;(3)蛋白易位等。也有报道发现,FAT10 在许多肿瘤患者体内表达明显上调,其作用机制可能为FAT10 可在细胞分裂前中期干扰着丝粒的定位,从而增加了细胞染色体的不稳定性,并有可能参与了细胞周期的调节,从而参与肿瘤的发生与发展[6-8]。众多研究发现 FAT10 m RNA 在大多的癌症样本中表达明显上调[9-11]。因此目前FAT10是研究肿瘤发病机制及治疗的一个热点,已有研究表明抑制 FATl0基因表达对于癌症的治疗有很大的帮助。本研究旨在通过干扰NCI-H226细胞中FAT10表达而探讨类泛素蛋白FAT10的异常表达在肺鳞癌进展中的作用机制。
1 材料和方法
1.1 主要仪器 流式细胞仪(United States,Indianapolis,BD FACSCalibur);PCR仪(美国,ABI公司);倒置显微镜(日本,OLYMPUS);双向电泳仪(美国,GE公司);培养箱(美国,porcival);细胞收集器(美国,PE公司);冷冻干燥离心机(美国,Virster Co.)。
1.2 材料及来源 人肺鳞癌细胞NCI-H226 细胞(中科院上海细胞所),逆转录反应试剂,FAT10 mRNA实时荧光定量RT-PCR检测试剂盒(日本Toyobo 公司),control siRNA,FAT10 siRNA,兔FAT10 单克隆抗体及小鼠抗3-磷酸甘油醛脱氢酶单克隆 ( GAPDH) 抗体(美国 SantaCruz)。FAT 10引物:上游 5' - CAATGCTTCCTGCCTCTGTG-3', 下 游 5' - TGCCTCTTTGCCTCATCACC- 3',长度为 297 bp ;系统内参GAPDH基因:上游5' -TCCCATCACCATCTTCCAG- 3',下游 5' -AG GAGTGGGTGTCGCTG- 3',长度为 662 bp (由上海生物工程公司设计) 。Control-siRNA、 FAT10 siRNA和重组表达载体pcDNA3.1-FAT10( 购于上海生物工程公司)。
1.3 研究方法
1.3.1 RT-PC检测FAT10 mRNA的表达 分别取出100 mg事先冻存的肺癌组织和癌旁组织(40例肺腺鳞癌病例均未进行放疗化疗等治疗,其中男性19例,女性21例,Ⅰ期 6例,Ⅱ期8例,Ⅲ期21例,Ⅳ期 5例),将组织放入试管中,采用Trizol试剂对组织进行裂解,按照说明书要求提取总RNA,采用紫外分光光度计检测总RNA的纯度。采用逆转录PCR测定FAT10 mRNA的表达水平,具体操作按照说明书进行,反转录cDNA后进行的PCR反应条件为:在93 ℃条件下变性2 min,55 ℃条件下退火1 min,72 ℃下延伸1 min,共40个循环。
1.3.2 Westerm blotting检测FAT10蛋白表达 按蛋白提取试剂盒说明书(总蛋白提取试剂盒,Sigma公司)提取相关组织总蛋白,BCA 蛋白浓度测定法对蛋白样品进行定量。取50μg 的总蛋白于10%聚丙烯酰胺凝胶中电泳。采用半干式电印迹将蛋白转移至 PVDF 膜上,经5% 脱脂牛奶封闭1 h分别加入相应一抗 FAT10(1∶500),4 ℃过夜,24 h后室温平衡 40 min,TBST 洗膜后加入辣根过氧化物酶标记的二抗(1∶800),37 ℃孵育1 h,洗膜后加入增强化学发光试剂,然后将膜置入X 线片暗盒、压片、显影、定影,以 GAPDH的表达作为参照,目的条带的灰度值与内参条带的灰度值比较。
1.3.3 NCI-H226细胞的培养及基因转染 人肺癌NCI-H226细胞快速复苏后用DMEM完全培养基培养,调整密度为1×106/mL。按处理方法不同分为4组:电转染FAT10 siRNA载体者为干扰组,转染pcDNA3.1-FAT10载体者为增强组,未转染的NCI-H226细胞为空白对照组,电转染ControlsiRNA载体者为阴性对照组。将处于对数生长期的NCI-H226细胞,制成单细胞悬液,利用PBS清洗并经胰酶消化后,离心收集NCI-H226,用电穿孔缓冲液重悬,离心800 g,静置5 min,清洗细胞3次,离心,重悬于电转液中,调整肺癌细胞密度至5×106/mL,每次准确吸取200 μL细胞悬液转移置电击杯,之后分别向四个处理组的电击杯中加入4μg FAT10 siRNA、pcDNA3.1-FAT10、生理盐水、Control-siRNA,混匀后,放置冰上30 min后,以电压350 V/cm, 电容 25 μF,时间常数T为0.9 ms的电转化参数,进行电穿孔。 将转染后的NCI-H226细胞,放置于室温30 min,细胞移入DMEM培养基,含10%小牛血清,1%双抗的培养皿中, 37 ℃ 、5%CO2孵箱内培育。
1.3.4 CCK-8 检测细胞增殖 取5×103/ mL人肺鳞癌NCI-H226细胞,将其接种在96孔板上,分组如前述,每组设置5个复孔。弃上清,并用PBS洗2遍,避光条件下每孔加入事先配制好的100 μL CCK-8工作液(含90 μL DMEM-F12基础培养基与10 μL CCK-8溶液)。37 ℃恒温培养箱内孵育2.5 h,将孔板置于酶标仪上进行吸光度值(OD值)的测定,测定条件为波长490 nm。
1.3.5 流式细胞术检测 分组如前述,取四组NCI-H226细胞各5×103/ mL以冷PBS 清洗2 次,用70 %的4 ℃乙醇进行细胞沉淀后混匀备用,冲洗细胞后用PBS调至细胞浓度1.5×106/L与含50 μg/ mL RNA 酶的 Tris-HCL 缓冲液 (pH7. 4) 共同孵育30 min。以100 μg/ mL (1 μg/mL)碘化丙啶行细胞DNA 染色,暗室中放置1 h 后, 流式细胞仪检测每组NCI-H226细胞的DNA含量分布情况,并测量每个细胞周期所占的百分比。上述四组NCI-H226细胞各1.5×106/L,经不含EDTA的胰酶消化,移入1.5 mL的Ep管内,4 ℃、2000 r/ min,离心5 min,弃上清;用PBS洗涤2次,加入500 μL Binding buffer悬浮细胞,5 μL Annexin V-FITC混匀后,加入5 μL PI,混匀;室温、避光,反应5~15 min;于1 h内采用流式细胞仪检测凋亡,激发波长(Ex)设定为488 nm,发射波长(Em)设定为530 nm。
1.3.6 小室侵袭实验检测细胞的侵袭能力 加10%胎牛血清于聚合好的小室下做为条件培养液,于聚碳酸酯微孔滤膜上铺Matrigel 50 μg/孔,在上室加入按上述四组NCI-H226细胞悬液100 μL(细胞总数为5×103/ mL),培养箱内放置24 h后取出,4%多聚甲醛固定10 min后苏木精溶液染色,于光镜下计量膜下表面的细胞数。每张膜于5个随机视野计数穿膜细胞,取其平均值。各组均平行设3个小室,重复3次计数。计算公式:细胞侵袭率=穿膜细胞数/上室中接种的细胞总数×100%。
1.3.7 RT-PCR检测Hsp90/Akt mRNA的表达 将各组细胞悬液经离心半径16 cm, 800 r/min, 离心5 min,收集目的细胞, 放入试管中,采用Trizol试剂对组织进行裂解,按照说明书要求提取总RNA,采用紫外分光光度计检测总RNA的纯度。采用逆转录PCR测定Akt mRNA的表达水平,具体操作按照说明书进行,反转录cDNA后进行的PCR反应条件为:在93℃条件下变性2 min,55℃条件下退火1 min,72℃下延伸1 min,共 40个循环。Akt的 上 游 引 物 序 列为 : 5' -GAGGAGCGGGAAGAGTG-3', 下 游 引物 序 列 为 :5'-GAGACAGGTGGAAGAAGAGC-3',扩增片段长度为 672bp。GAPDH 为内参照,上游引物序列为:5'-AGAAGGCTGGGGCTCA TTTG-3' , 下 游 引 物 序 列 为 :5'-AGGGGCC ATCCACAGTCTTC-3',扩增片段长度为 258 bp。
1.3.8 Westerm blotting检测Hsp90/Akt蛋白的表达 将各组细胞悬液经离心半径16 cm, 800 r/min,离心5 min,收集目的细胞, 按蛋白提取试剂盒说明书提取细胞总蛋白。BCA 法对蛋白样品进行蛋白浓度测定。取50 μg 的总蛋白于10%聚丙烯酰胺凝胶中电泳。采用半干式电印迹将蛋白转移至PVDF 膜上,经5% 脱脂牛奶封闭1h分别加入相应一抗 Akt(1∶800),4 ℃过夜,24 h后室温平衡40mim,TBST 洗膜后加入辣根过氧化物酶标记的二抗(1∶800),37℃孵育1h,洗膜后加入增强化学发光试剂(ECL),然后将膜置入X 线片暗盒、压片、显影、定影,以 GAPDH 的表达作为参照,目的条带的灰度值与内参条带的灰度值比较。
1.4 统计学处理 采用SPSS 12.0 统计软件进行分析。所有实验数据均以均数±标准差表示,实验数据用K-S检验符合正态分布,多组均数间的比较采用方差分析,两两比较应用最小显著差法(LSD法)进行处理,P<0.05 时表示差异有统计学意义。
2 结果
2.1 FAT10 mRNA的表达 采用RT-PCR检测FAT10 mRNA表达水平人肺鳞癌组织中的表达量为(0.89±0.11),癌旁组织的表达为(0.42±0.06),在癌组织中的表达明显高于癌旁组织(P<0.05)。如图1。
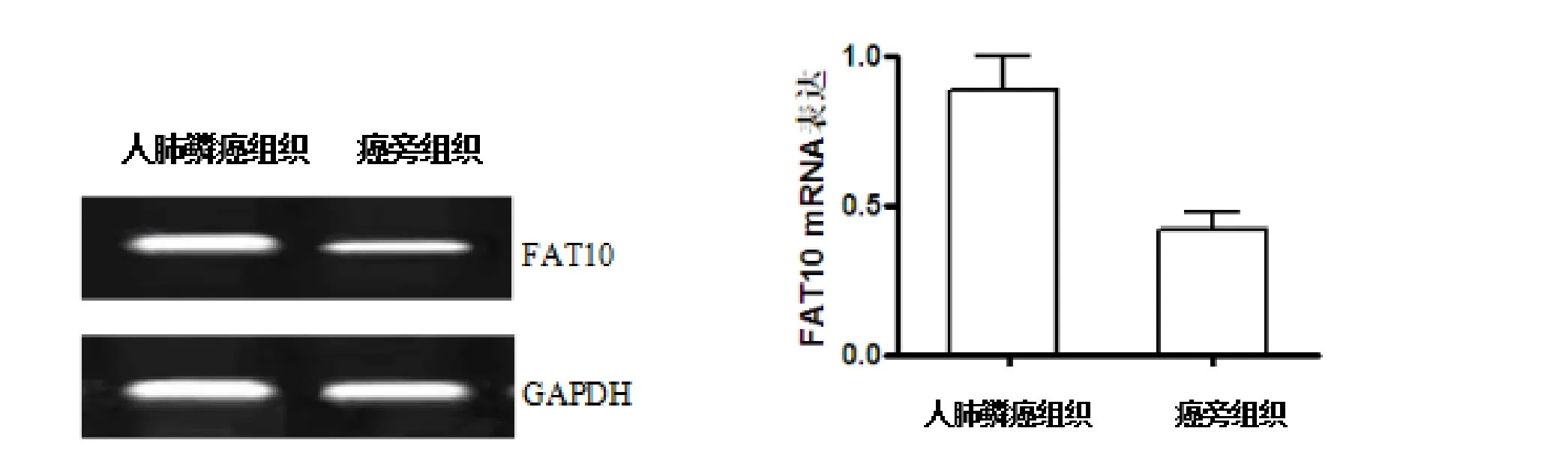
图1 RT-PCR检测的FAT10 mRNA在人肺鳞癌和癌旁组织中的表达
2.2 FAT10蛋白的表达 Westerm blotting检测的人肺鳞癌组织中FAT10蛋白表达为(1.56±0.09),在癌旁组织中表达为(0.67±0.04),癌组织中的表达量明显高于癌旁组织 (P<0.05)。如图2。
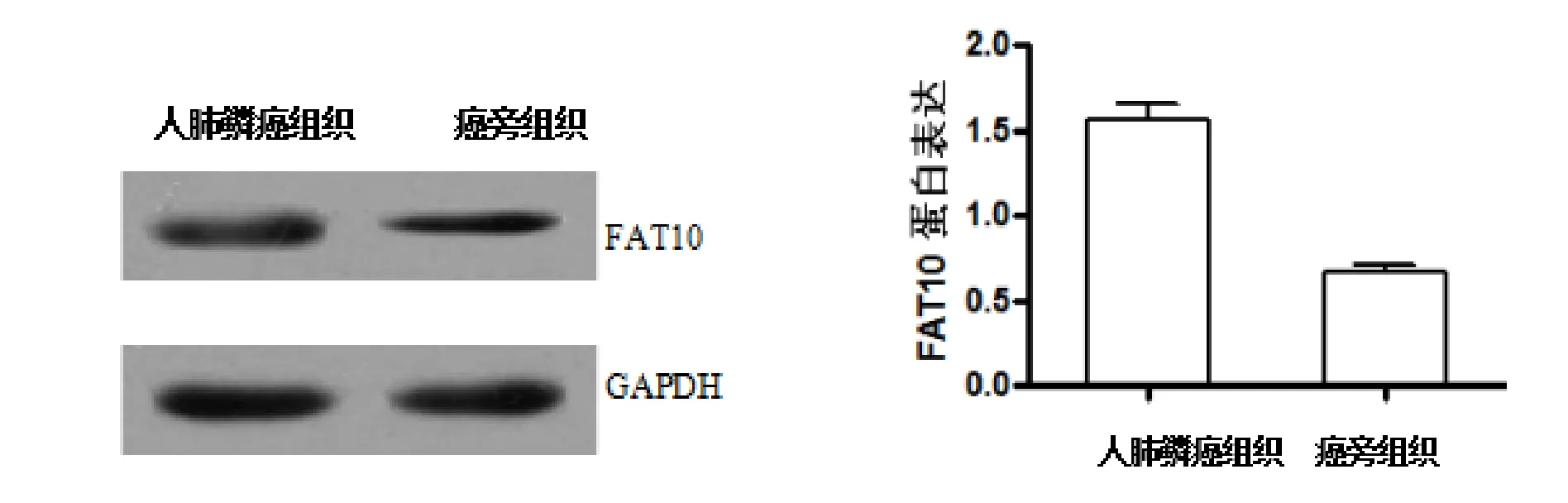
图2 Westerm blotting检测的FAT10蛋白在人肺鳞癌和癌旁组织中的表达
2.3 细胞增殖变化 转染48 h后采用CCK-8检测细胞增殖情况,结果发现:与空白对照组及阴性对照相比,干扰组NCI-H226细胞增殖被抑制,表现为OD 值明显减低(P<0.05),增强组NCI-H226细胞增殖能力提高,表现为OD 值明显升高。见表1。
2.4 细胞周期和凋亡检测结果 转染48 h后流式细胞术检测细胞周期和凋亡情况,结果发现,与空白对照组及阴性对照相比,干扰组NCI-H226细胞周期分布无明显变化,而细胞凋亡率增加;增强组NCI-H226细胞周期分布无明显变化,而细胞凋亡率降低。见表2。
表1 CCK-8 检测干扰FAT10表达对NCI-H226细胞增殖的影响()

表1 CCK-8 检测干扰FAT10表达对NCI-H226细胞增殖的影响()
注:与空白对照组相比,aP<0.05
组别OD值增强组 0.948±0.016a干扰组 0.527±0.011a空白对照组 0.727±0.014阴性对照组 0.730±0.012
表2 干扰FAT10表达对NCI-H226细胞周期和凋亡的影响()

表2 干扰FAT10表达对NCI-H226细胞周期和凋亡的影响()
注:与空白对照组相比,aP<0.05
组别细胞周期凋亡率G0/G1 S G2/M增强组 54.41±1.09 28.44±1.01 16.22±0.98 2.47±0.25a干扰组 54.18±0.27 29.13±0.28 12.15±0.44 6.13±0.37a空白对照组 54.23±1.12 27.32±1.13 13.46±1.32 4.22±0.10阴性对照组 54.26±0.87 27.29±1.21 13.38±0.96 4.19±0.13
2.5 细胞侵袭能力变化 转染48 h后采用小室侵袭实验检测细胞的侵袭能力,结果显示,与空白对照组及阴性对照相比,干扰组NCI-H226细胞的侵袭能力较前明显降低,增强组NCI-H226细胞的侵袭能力较前明显升高。见图3、表3。

图3 小室侵袭实验检测各组细胞的侵袭能力
表3 干扰NCI-H226细胞中FAT10表达后穿过滤膜的侵袭细胞数目(,个)

表3 干扰NCI-H226细胞中FAT10表达后穿过滤膜的侵袭细胞数目(,个)
注:与空白对照组相比,aP<0.05
组别侵袭细胞数目增强组 126.89±4.78a干扰组 57.55±2.65a空白对照组 91.09±6.31阴性对照组 89.94±4.45
2.6 转染后Akt mRNA和蛋白表达 RT-PCR检测转染后各组NCI-H226细胞中Akt mRNA表达,结果显示,与空白对照组及阴性对照相比,干扰组NCI-H226细胞中Akt mRNA表达升高, Hsp90/Akt信号通路表达上调;增强组NCI-H226细胞中Akt mRNA表达降低, Hsp90/Akt信号通路表达下调。见图4、表4。Westerm blotting 结果显示,与空白对照组及阴性对照相比,干扰组NCI-H226细胞中Akt 蛋白表达升高,增强组NCI-H226细胞中,Akt 蛋白表达降低, Hsp90/Akt信号通路表达下调。见图5、表4。
表4 Akt mRNA及其蛋白的表达()

表4 Akt mRNA及其蛋白的表达()
注:与空白对照组相比,aP<0.05
组别 Akt mRNA Akt蛋白增强组 0.84±0.06a 1.13±0.10a干扰组 0.25±0.04a 0.51±0.07a空白对照组 0.62±0.07 0.86±0.09阴性对照组 0.61±0.06 0.85±0.07
3 讨论
肺癌作为一种对人类危害极大的恶性肿瘤,研究发现其患病人数越累越多,因此受到了社会的广泛关注,然而由于部位及类型的不同,对于肺癌的治疗效果参差不齐,目前对于肺鳞癌的治疗仍无突破性的进展,对于其治疗的选择相对局限,因此深入探讨其具体发病机制对于肺癌的预防及治疗均有十分重要的意义[12]。
泛素可以通过体内的26S蛋白酶体途径降解包括细胞周期蛋白在内的多种蛋白,使得体内的细胞周期发生变化,使得其成为细胞恶性转化的研究热点,也有研究表明其可以调节体内细胞的凋亡,因此与肿瘤的发生及发展密切相关[13-14]。关于泛素的相关研究从20世纪70年代起已经开始,此后相关研究逐渐增多,并且与其相似的泛素样蛋白也逐渐走向人们的视野,成为研究的热点[15-17],因此泛素样蛋白的家族成员不断被发现[18-20],FAT10即为其中一员。FAT10是1996年被发现,当时即发现其与细胞的凋亡密切相关,这与先前发现的泛素的作用一致。随后对于FAT10的相关研究越来越多[21-23],对其特性及其作用机制不断做出补充。到目前为止研究发现,FAT10是一种蛋白标记,在包括肝癌、乳腺癌、卵巢癌等肿瘤患者体内其表达明显增高,因此明确 FAT10 在肿瘤中的诊断及治疗价值将是十分有必要的[24-26]。

图4 转染后各组Akt mRNA表达
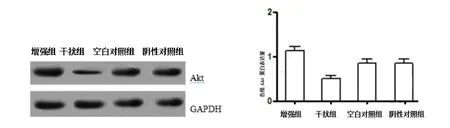
图5 转染后各组Akt蛋白表达
本研究通过干扰NCI-H226细胞中FAT10表达后探讨类泛素蛋白FAT10的异常表达在肺鳞癌进展中的作用机制,研究结果发现在人肺鳞癌组织中FAT10基因和蛋白的表达量明显增高,这与先前研究结果是一致的,本研究结果显示当干预FAT10的表达后,相应的NCI-H226细胞的增殖也受到不同程度地抑制,细胞的凋亡率较前增加,然而其侵袭力则明显降低,这与先前相关研究结果不谋而合[27]。本研究也为FAT10的作用机制提供了支持,即其可以通过上调Hsp90/Akt信号通路表达,使肿瘤细胞的增殖能力增强,使细胞的凋亡数目减少,侵袭能力增强,因此FAT10可能成为预防和治疗作用的靶点,为肿瘤的治疗提供了新的思路。
综上所述,FAT10 作为一个泛素样蛋白家族中的一员,与泛素有着相同的特性,与多种肿瘤的进展密切相关,抑制FAT10的表达可为肿瘤的治疗提供新的思路,但将这种思路应用于临床仍需不断地探索。
本研究的特点和创新之处: FAT10是一种新发现的,与泛素具有相似功能且可通过共价结合发挥泛素样作用的累泛素蛋白, FAT10在多种癌细胞如胃肠癌、肝癌等细胞中得以表达,本研究通过干扰NCI-H226细胞中FAT10表达,探讨FAT10的异常表达在肺鳞癌进展中的作用机制,旨在为肺鳞癌的治疗提供一种新思路。
不足和需要进一步完善之处:本研究对于FAT10基因影响肺鳞癌NCI-H226细胞的具体机制尚未明确,FAT10化修饰底物蛋白可调控众多细胞生命活动,尤其是肿瘤的发生发展,但其具体的调控机制尚不清楚,还需要进一步探讨研究。

