RhoA/ROCK信号通路对高糖致大鼠冠状动脉舒缩功能损伤的影响
孙志军,武 星,彭 晖,李卫萍,李虹伟
(首都医科大学附属北京友谊医院心脏中心,北京 100050)
冠状动脉粥样硬化性心脏病是目前导致人类死亡的主要疾病之一,糖尿病是冠状动脉粥样硬化性心脏病的主要病因和危险因素,高血糖可以导致冠状动脉舒张功能障碍,因此,糖尿病患者的心血管并发症与血糖升高有着直接关系。血管细胞对高血糖的早期反应是产生活性氧自由基(reactive oxygen species,ROS)。一氧化氮与O2·-在体内快速结合生成的过氧化亚硝基阴离子(ONOO-)是一种强氧化剂和硝化剂,可促使脂质过氧化、DNA链断裂和蛋白质修饰。研究证实,高糖可损伤冠状动脉电压依赖性钾离子通道,进而影响舒张功能;同时,冠状动脉在高糖孵育下生成的ONOO-增加,给予尿酸清除ONOO-后,冠状动脉舒张功能得以改善[1]。还有研究发现,糖尿病大鼠冠状动脉管壁氧化负荷增加,减少氧化负荷可以改善冠状动脉的舒张功能[1-3]。因此,探讨何种细胞内信号传导途径参与高糖刺激下的冠状动脉舒张功能受损,将为防治糖尿病心血管并发症提供新的治疗靶点。
RhoA/ROCK通路通过调控平滑肌收缩、细胞黏附、迁移、增殖和基因表达等,从而参与动脉粥样硬化、高血压、血管痉挛等的发生。研究显示,糖尿病大鼠冠状动脉的RhoA mRNA和蛋白表达均明显增高,RhoA/ROCK通路参与了冠状动脉平滑肌细胞舒缩调节作用[4-8]。因此,明确RhoA/ROCK信号通路是否参与高糖对大鼠冠状动脉平滑肌细胞功能的损伤,将为临床更全面地理解糖尿病的病理生理基础,寻找更好的糖尿病靶器官损害的治疗靶点提供一定的理论依据。
1 材料与方法
1.1实验动物清洁级雄性Sprague Dawley大鼠30只,7~8周龄,体质量(200.0±20.0)g,由北京维通利华实验动物技术有限公司提供。
1.2主要试剂与仪器RhoA 一抗购自美国Bioworld公司,ROCK1一抗和ROCK2一抗购自美国SANTA公司,甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗购自美国ProMab公司,Y-27632、C3转移酶、4-氨基吡啶(4-aminopyridine,4-AP)和佛司可林均购自美国Sigma公司;Powerlab生物信号采集分析系统购自澳大利亚亚埃德公司,DMT微血管环张力测试仪购自丹麦DMT公司。
1.3实验方法
1.3.1大鼠冠状动脉血管环的制备大鼠经腹腔注射水合氯醛麻醉,注射肝素抗凝,分离心脏后取直径 ≤200 μm的小冠状动脉,剪取长约2 mm的血管环备用。
1.3.2微血管环收缩舒张反应的测定将血管环分为正常葡萄糖组、左旋葡萄糖组、高葡萄糖组、高葡萄糖+C3转移酶组、高葡萄糖+Y-27632组,每组6个。各组血管环均在37 ℃条件下培养。正常葡萄糖组血管环给予5.5 mmol·L-1D-葡萄糖培养24 h;左旋葡萄糖组血管环给予5.5 mmol·L-1D-葡萄糖和17.5 mmol·L-1L-葡萄糖培养24 h;高葡萄糖组血管环给予23.0 mmol·L-1D-葡萄糖培养24 h;高葡萄糖+C3转移酶组血管环给予23.0 mmol·L-1D-葡萄糖培养24 h,C3 转移酶处理 16 h;高葡萄糖+Y-27632组血管环给予 23.0 mmol·L-1D-葡萄糖培养24 h,Y-27632预处理16 h。各组分别给予0.1、0.3、1.0、3.0 mmol·L-1的4-AP干预5 min,观察血管环对4-AP的收缩反应;在3.0 mmol·L-1的4-AP使血管环达到最大收缩力后给予1 μmol·L-1血管舒张剂佛司可林,观察血管的舒张反应变化(以给药前后张力变化的百分比表示)。
小冠状动脉的张力测定方法:将孵育后的冠状动脉环各穿入2根直径为40 μm的钨丝,固定在Multi Myograph System-610M浴槽内传感器上,通过微血管张力测试仪的换能系统自动采集血管环的张力变化。
1.3.3免疫组织化学法检测5组大鼠小冠状动脉中RhoA、ROCK1和ROCK2蛋白表达取制备好的大鼠冠状动脉血管环分为正常葡萄糖组、左旋葡萄糖组、高葡萄糖组、高葡萄糖+C3转移酶组、高葡萄糖+Y-27632组,每组3个血管环,各组干预措施同“1.3.2”项,行上述干预措施后取各组血管环制备石蜡切片。取各组石蜡切片二甲苯脱蜡2次,每次 5 min;浸入体积分数100%乙醇2次,每次 5 min;浸入体积分数95%、80%、70%、50%乙醇各 5 min;磷酸盐缓冲液(phosphate buffered saline,PBS)清洗10 min。滴加体积分数3% H2O2+PBS孵育10 min;磷酸盐吐温缓冲液(phosphate buffered saline-tween,PBS-T)清洗2次,每次3 min。滴加一抗100 μL,RhoA稀释度1200;ROCK1稀释度1200;ROCK2稀释度1250),4 ℃过夜;PBS-T清洗2次,每次3 min。滴加二抗100 μL,室温下二抗酶标结合反应10 min;PBS-T清洗2次,每次3 min。滴加100 μL 二氨基联苯胺孵育5 min;蒸馏水冲洗5 min。苏木精复染,中性树胶封片,显微镜下观察。对图片中血管组织采用着色的平均光密度方法来代表RhoA、ROCK1和ROCK2蛋白在血管组织中的平均表达水平。

2 结果
2.1RhoA抑制剂(C3转移酶)和ROCK抑制剂(Y-27632)对高糖刺激下大鼠冠状动脉舒缩功能的影响各组大鼠小冠状动脉对4-AP的收缩反应均呈浓度依赖性(图1)。正常葡萄糖组、左旋葡萄糖组、高葡萄糖组、高葡萄糖+C3转移酶组和高葡萄糖+Y-27632组大鼠小冠状动脉对3.0 mmol·L-1浓度4-AP的收缩力分别为(3.15±0.31)、(2.08±0.17)、(1.37±0.22)、(2.13±0.09)、(2.02±0.16)mN。左旋葡萄糖组、高葡萄糖组、高葡萄糖+C3转移酶组和高葡萄糖+Y-27632组大鼠小冠状动脉的收缩力低于正常葡萄糖组,差异有统计学意义(P<0.05)。高葡萄糖组大鼠小冠状动脉的收缩力低于左旋葡萄糖组,差异有统计学意义(P<0.05);高葡萄糖+C3转移酶组、高葡萄糖+Y-27632组与左旋葡萄糖组大鼠小冠状动脉的收缩力比较差异无统计学意义(P>0.05)。高葡萄糖+C3转移酶组、高葡萄糖+Y-27632组大鼠小冠状动脉的收缩力高于高葡萄糖组(P<0.05)。高葡萄糖+C3转移酶组与高葡萄糖+Y-27632组大鼠小冠状动脉收缩力比较差异无统计学意义(P>0.05)。
正常葡萄糖组、左旋葡萄糖组、高葡萄糖组、高葡萄糖+C3转移酶组和高葡萄糖+Y-27632组大鼠小冠状动脉对佛司可林的舒张反应分别为(48.97±1.77)%、(39.47±1.32)%、(35.20±1.98)%、(39.80±1.59)%、(39.68±1.57)%。左旋葡萄糖组、高葡萄糖组、高葡萄糖+C3转移酶组和高葡萄糖+Y-27632组大鼠小冠状动脉的舒张反应均低于正常葡萄糖组,差异有统计学意义(P<0.05)。高葡萄糖组大鼠小冠状动脉的舒张反应低于左旋葡萄糖组,差异有统计学意义(P<0.05);高葡萄糖+C3转移酶组和高葡萄糖+Y-27632组与左旋葡萄糖组大鼠小冠状动脉舒张反应比较差异无统计学意义(P>0.05)。高葡萄糖+C3转移酶组和高葡萄糖+Y-27632组大鼠小冠状动脉舒张反应高于高葡萄糖组,差异有统计学意义(P<0.05)。高葡萄糖+C3转移酶组与高葡萄糖+Y-27632组大鼠小冠状动脉舒张反应比较差异无统计学意义(P>0.05)。
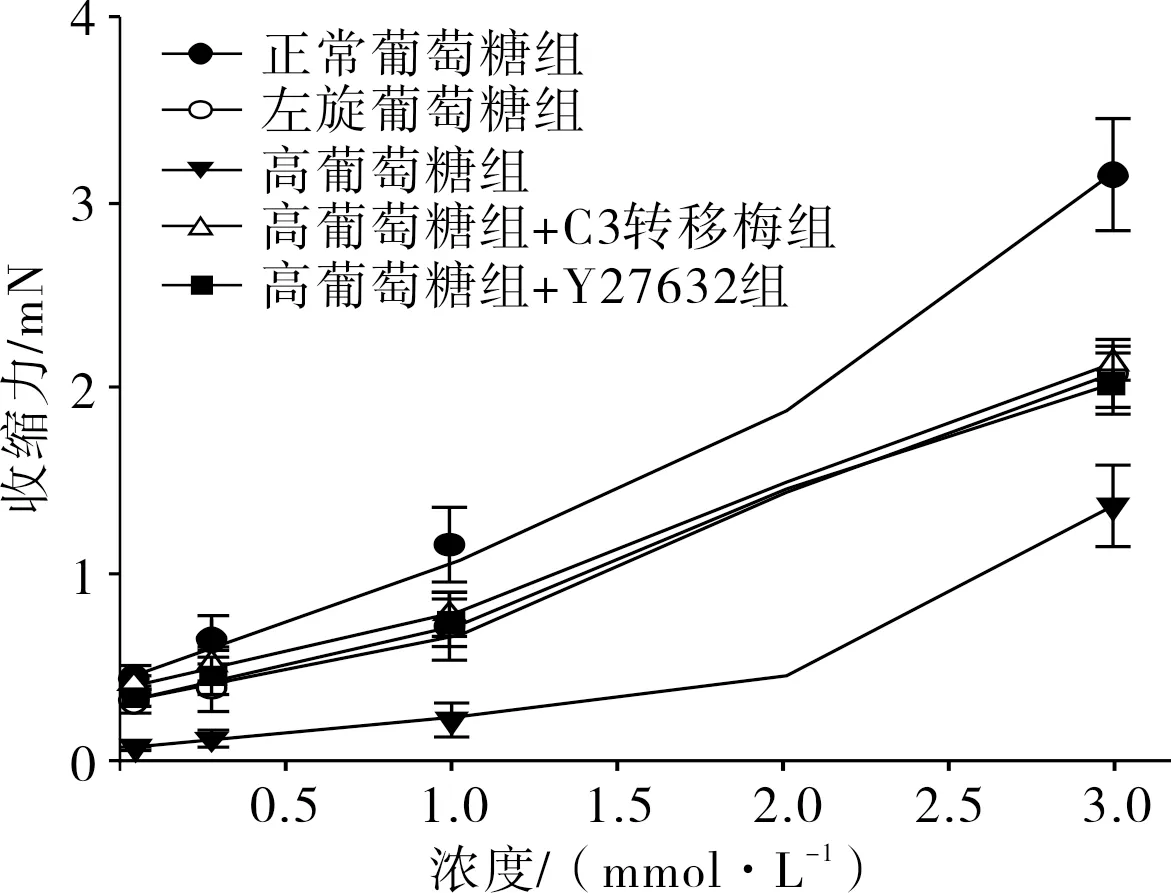
图15组大鼠小冠状动脉对4-AP的收缩反应
Fig.1Contractileresponseofsmallcoronaryarteryofratsto4-APinthefivegroups
2.25组大鼠小冠状动脉中RhoA、ROCK1和ROCK2蛋白的表达结果见图2和表1。左旋葡萄糖组、高葡萄糖组、高葡萄糖+C3转移酶组和高葡萄糖+Y-27632组大鼠小冠状动脉中RhoA蛋白表达均高于正常葡萄糖组,差异有统计学意义(P<0.05)。高葡萄糖组大鼠小冠状动脉中RhoA蛋白表达高于左旋葡萄糖组相,差异有统计学意义(P<0.05)。高葡萄糖+C3转移酶组、高葡萄糖+Y-27632组、左旋葡萄糖组大鼠小冠状动脉中RhoA蛋白表达水平比较差异无统计学意义(P>0.05)。高葡萄糖+C3转移酶组大鼠小冠状动脉中RhoA蛋白表达低于高葡萄糖组,差异有统计学意义(P<0.05);高葡萄糖+Y-27632组与高葡萄糖组大鼠小冠状动脉中RhoA蛋白表达比较差异无统计学意义(P>0.05)。高葡萄糖+Y-27632组与高葡萄糖+C3转移酶组大鼠小冠状动脉中RhoA蛋白表达比较差异无统计学意义(P>0.05)。
左旋葡萄糖组、高葡萄糖组和高葡萄糖+Y-27632组大鼠小冠状动脉中ROCK1蛋白表达均高于正常葡萄糖组,差异有统计学意义(P<0.05);高糖+C3转移酶组与正常葡萄糖组大鼠小冠状动脉中ROCK1蛋白表达比较差异无统计学意义(P>0.05)。高葡萄糖组与左旋葡萄糖组大鼠小冠状动脉中ROCK1蛋白表达比较差异无统计学意义(P>0.05),高葡萄糖+C3转移酶组和高葡萄糖+Y-27632组大鼠小冠状动脉中ROCK1蛋白表达显著低于左旋葡萄糖组,差异有统计学意义(P<0.05)。高葡萄糖+C3转移酶组和高葡萄糖+Y-27632组大鼠小冠状动脉中ROCK1蛋白表达水平显著低于高葡萄糖组,差异有统计学意义(P<0.05)。高葡萄糖+C3转移酶组大鼠小冠状动脉中ROCK1蛋白表达水平显著低于高葡萄糖+Y-27632组,差异有统计学意义(P<0.05)。
左旋葡萄糖组、高葡萄糖组、高葡萄糖+C3转移酶组和高葡萄糖+Y-27632组大鼠小冠状动脉中ROCK2蛋白表达均高于正常葡萄糖组,差异有统计学意义(P<0.05)。高葡萄糖组大鼠小冠状动脉中ROCK2蛋白表达高于左旋葡萄糖组,差异有统计学意义(P<0.05);高葡萄糖+C3转移酶组、高葡萄糖+Y-27632组、左旋葡萄糖组大鼠小冠状动脉中ROCK2蛋白表达比较差异无统计学意义(P>0.05)。高葡萄糖+C3转移酶组和高葡萄糖+Y-27632组大鼠小冠状动脉中ROCK2蛋白表达水平低于高葡萄糖组,差异有统计学意义(P<0.05)。高葡萄糖+C3转移酶组与高葡萄糖+Y-27632组大鼠小冠状动脉中ROCK2蛋白表达水平比较差异无统计学意义(P>0.05)。
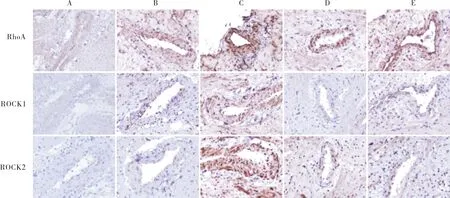
A:正常葡萄糖组;B:左旋葡萄糖组;C:高葡萄糖组;D:高葡萄糖+C3组;E:高葡萄糖+Y-27632组。
图25组大鼠小冠状动脉中RhoA、ROCK1和ROCK2蛋白表达(苏木精染色,×200)
Fig.2ExpressionofRhoA,ROCK1andROCK2proteininthesmallcoronaryarteryofratsinthefivegroups(hematoxylinstaining,×200)
表15组大鼠小冠状动脉中RhoA、ROCK1和ROCK2蛋白表达

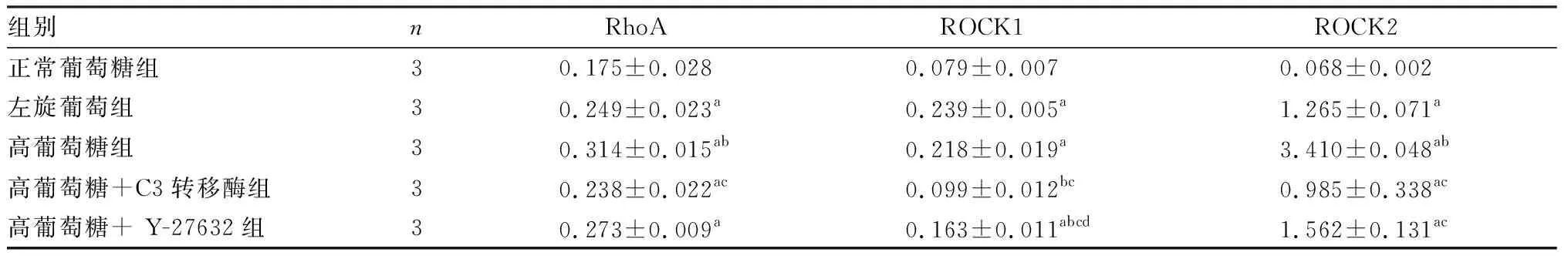
组别nRhoAROCK1ROCK2正常葡萄糖组 30.175±0.0280.079±0.0070.068±0.002左旋葡萄组 30.249±0.023a0.239±0.005a1.265±0.071a高葡萄糖组 30.314±0.015ab0.218±0.019a3.410±0.048ab高葡萄糖+C3转移酶组30.238±0.022ac0.099±0.012bc0.985±0.338ac高葡萄糖+ Y-27632组 30.273±0.009a0.163±0.011abcd1.562±0.131ac
注:与正常葡萄糖组比较aP<0.05;与左旋葡萄糖组比较bP<0.05;与高葡萄糖组比较cP<0.05;与高葡萄糖+C3转移酶组比较dP<0.05。
3 讨论
Rho蛋白是Ras超家族中小分子G蛋白的成员之一,在细胞的信号传导通路中作为分子开关,作用于细胞骨架或靶蛋白而产生多种生物效应[4]。Rho亚家族包括RhoA、RhoB和RhoC 3个成员。血管紧张素II、5-羟色胺、凝血酶、内皮素、血栓素A2、氧化型低密度脂蛋白、肿瘤坏死因子-α及白细胞介素1-β等均可以激活RhoA[5]。RhoA可以激活不同的下游效应器,参与平滑肌细胞收缩、细胞黏附、迁移、增殖和基因表达调控等,在不同的细胞信号传导通路上发挥生物学作用。RhoA最重要的下游效应器为ROCK,其在细胞形态维持、收缩、迁移、黏附、分裂、增殖、凋亡和基因转录等基本活动中发挥重要作用[6]。ROCK 是一种丝氨酸/苏氨酸激酶,包括2种亚型:ROCK1和 ROCK2。有研究显示,RhoA/ROCK信号通路在高血压、动脉粥样硬化、糖尿病及其并发症的发生及发展中发挥着重要的作用。高糖可以在系膜细胞[7]和血管平滑肌细胞[8]中激活Rho/ROCK 途径。
有研究显示,主动脉内皮细胞在高糖(23.0 mmol·L-1)条件下培养 6 h后,可明显增加 RhoA 活性[9]。大鼠的内皮细胞在高糖培养 72 h后,可激活 RhoA/ROCK通路,并且这种激活可以被 GF109203X 逆转[10]。研究显示,高血糖可导致线粒体自由基的大量产生,增加 ROS的生成,促进活性氮自由基ONOO-的生成,从而产生毒性作用,引起血管张力和功能障碍[11]。研究表明,RhoA/ROCK通路参与了胰岛素抵抗的调节和糖稳态的维持[12-13]。
本实验给予高糖孵育去内皮化的大鼠小冠状动脉24 h,结果显示,高葡萄糖组RhoA和ROCK2蛋白表达显著增加。同时高葡萄糖组的小冠状动脉舒张及收缩功能均显著下降。而左旋葡萄糖组的RhoA、ROCK2蛋白表达显著低于高葡萄糖组,且小冠状动脉的舒张和收缩功能下降程度显著低于高葡萄糖组。高葡萄糖+C3转移酶组和高葡萄糖+Y27632组小冠状动脉的舒张和收缩功能的下降程度也显著低于高葡萄糖组,提示ROCK抑制剂可显著改善高糖所致的平滑肌功能损伤。RhoA/ROCK通路的激活在很大程度上可能与高糖的刺激有直接关系,而RhoA/ROCK通路的激活导致了大鼠冠状动脉平滑肌功能的受损,因此,推断RhoA/ROCK信号传导通路参与了高糖所致的大鼠冠状动脉舒缩功能的受损过程。
C3转移酶是从梭状肉毒杆菌提取的一种生物毒素,可催化小三磷酸鸟苷结合蛋白Rho在41位天冬酰胺酸的单腺苷二磷酸(adenosine diphosphate,ADP)核糖基化,而该位点是公认的Rho蛋白功能区域,因此,C3转移酶引起的ADP核糖基化可使Rho蛋白失活,可作为RhoA的抑制剂[14]。吡啶类衍生物Y-27632是最常用的ROCK抑制剂,其可以渗透入细胞,结合到催化部位而抑制ROCK,有效抑制血管平滑肌细胞的ROCK,对血管平滑肌有明显的舒张作用,可降低血压。Y-27632 对ROCK的抑制特异性较其他蛋白激酶如蛋白激酶C、环磷酸腺苷依赖的蛋白激酶以及肌球蛋白轻链激酶等的抑制能力高200倍[15]。
本实验中分别用RhoA抑制剂C3转移酶和ROCK抑制剂Y-27632进行预处理,结果显示,该2组大鼠小冠状动脉的收缩及舒张功能均较高葡萄糖组有显著改善。因此,RhoA/ROCK 信号通路参与高糖致大鼠冠状动脉舒缩功能损伤过程,表明其在糖尿病及其并发症的发生、发展中发挥重要作用。

