lncRNA-MALAT1通过靶向下调miR-570-3p促进胃癌细胞增殖*
侯婧瑛, 凌 辉, 金小岩, 罗 信, 李楚强, 王凌云△
(中山大学孙逸仙纪念医院 1急诊科, 2消化内科, 3综合科, 广东 广州 510120)
长链非编码RNA (long non-coding RNA, lncRNA)的表达异常与多种疾病尤其是肿瘤密切相关[1-2]。,其可通过染色体重塑、转录和转录后加工等不同层面参与基因表达调控[3-4]。微小RNA (microRNA, miRNA,miR)是广泛存在于真核细胞中的单链非编码RNA,通过与靶基因3’端非翻译区近乎完全或不完全互补结合,在转录后或翻译水平发挥对基因表达的调节作用。有证据表明lncRNA与miRNA之间的相互调控在肿瘤的发生发展中扮演着十分重要的角色[5]。有靶向结合位点的lncRNA可以与miRNA形成竞争性内源RNA(competing endogenous RNA,ceRNA)从而抑制miRNA对靶基因表达的调控[3,6]。
肺腺癌转移相关转录本1(metastasis-associated lung adenocarcinoma transcript 1,MALAT1)是lncRNA 家族的一个重要成员。有证据显示MALAT1表达上调促进了胃癌的侵袭、进展及转移[7]。miR-570-3p则对一些肿瘤的发生发展具有抑制作用[8]。有研究表明miR-570-3p能够通过调控与肿瘤免疫相关的靶基因参与影响胃癌的临床病理进程包括分化、肿瘤侵袭及淋巴结转移等[9]。在本研究中,我们观察lncRNA-MALAT1对胃癌细胞增殖的影响并探讨其是否通过靶向下调miR-570-3p而发挥调控作用。
材 料 和 方 法
1 细胞系和试剂
胃癌细胞株SGC7901(中南大学细胞库);293T 细胞(中国科学院细胞库)。DMEM 高糖培养液、胎牛血清(fetal bovine serum,FBS)和胰蛋白酶(HyClone);CellTiter 96AQ单溶液细胞增殖检测试剂盒(Promega);转染试剂LipofectamineTMRNAiMAX和Lipofectamine 2000(Invitrogen);lncRNA-MALAT1 siRNA(si-MALAT1)及其阴性对照(si-MALAT1 negative control,si-MALAT1-NC)、miR-570-3p模拟物(miR-570-3p mimic)和抑制剂(miR-570-3p inhibitor)及阴性对照序列(广州锐博生物科技有限公司);QuickMutationTM基因定点突变试剂盒(碧云天);DpnI酶 (Promega);psiCHECK-2 双萤光素酶报告基因载体、萤光素酶检测试剂盒和Dual-Luciferase Reporter Assay System (Promega)。
2 实验分组和相关序列信息
2.1细胞实验 将体外培养的人胃癌细胞株SGC7901分为:空白对照(blank control)组:单纯的SGC7901细胞株;si-MALAT1组:转染si-MALAT1;si-MALAT1 NC组:转染si-MALAT1 NC。具体转染步骤如下:以每孔5×104的密度接种细胞,充分摇匀。第2天细胞融合度为40%,进行转染。吸去完全培养基,用PBS洗2遍,每孔加入1 mL 含20%胎牛血清的DMEM高糖培养基;用RNase-free的去离子水溶解siRNA至终浓度为20 μmol/L,将siRNA溶于500 μL Opti-MEM中,混匀、静置,为A管;将5 μL LipofectamineTMRNAiMAX 加入500 μL Opti-MEM中,轻轻混匀、静置,为B管;将A管和B管混合,混匀、静置20 min,分别加入各孔中;并孵育4~6 h后更换为完全培养基。混匀,放入细胞培养箱;4~6 h后,吸去转染培养基,用PBS洗2遍,每孔加入2 mL完全培养基。
2.2萤光素酶报告实验 设立lncRNA-MALAT1野生型(MALAT1-WT)和突变型(MALAT1-Mut),其中各型又分为5组:blank control组(单纯的293T细胞)、miR-570-3p mimic组、miR-570-3p mimic阴性对照(NC mimic)组、miR-570-3p inhibitor组和miR-570-3p inhibitor阴性对照(NC inhibitor)组。
3 方法
3.1MTS实验 各组胃癌细胞培养不同时点后消化细胞,吹散细胞并计数,调整细胞密度至1×105/L再接种到96孔板,每孔100 μL(每孔细胞为1×104),待细胞贴壁后再收集进行检测。在各个时点(0、24、48和72 h)收集细胞之后加入CellTiter 96 AQ单溶液细胞增殖检测试剂(比例10 ∶1,即100 μL培养液中加入10 μL检测液),孵育4 h后用Multiscan MK3酶标仪读板,读取A490值。
3.2RT-qPCR 检测 转染后24 h收集细胞,加入1 mL TRIzol溶液裂解提取总RNA,并采用核酸蛋白分析仪以及1.6%琼脂糖电泳对提取的总RNA进行分析。取8 μL总RNA液,70 ℃水浴5 min后加入17 μL反转录反应液,再在42 ℃孵育60 min终止反应,留取产物后待用。RT-qPCR 扩增参数: 95 ℃ 10 min(1个循环); 95 ℃ 15 s, 60 ℃ 30 s(40个循环);72 ℃延伸10 min。反应结束后,软件自动计算定量结果,具体引物序列信息详见表1。
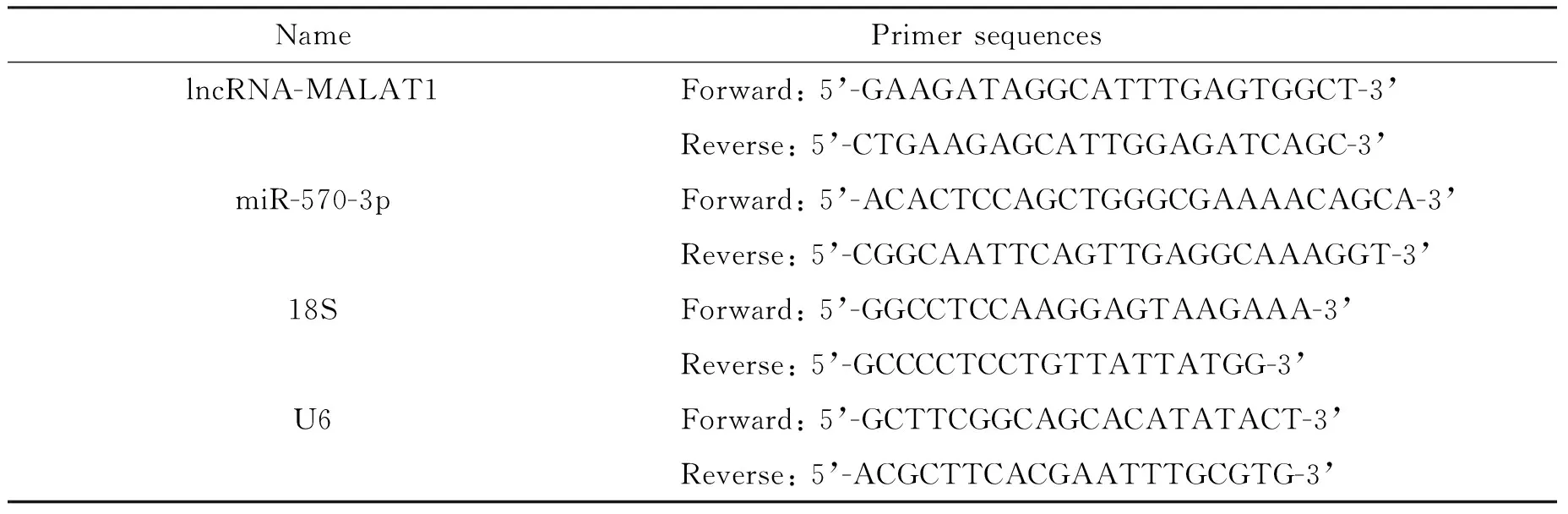
表1 RT-qPCR引物序列
3.3lncRNA-MALAT1表达载体及其突变载体构建 分析MALAT1基因序列,序列号为NR_002819.4,基因全长8 779 bp。采用RegRNA 2.0预测MALAT1与miR-570-3p的潜在结合位点(集中在第2 000~5 000 bp位置),由苏州金唯智公司合成第2 000~5 000 bp片段,并在合成的片段上、下游引入XhoI酶切位点和NotI酶切位点,将合成的片段和psiCHECK-2载体双酶切,在T4DNA连接酶的作用下,将MALAT1片段构建到psiCHECK-2 载体的多克隆位点处[4]。XhoI酶切位点和NotI酶切位点见表2中下划线标注部分所示。连接产物转化后质粒提取并酶切鉴定阳性克隆,送阳性质粒测序(从载体多克隆位点上游载体骨架处测序)。MALAT1突变采用点突变试剂盒,分别点突变4个位点,具体引物序列见表2所示,PCR扩增条件: 94 ℃ 3 min; 98 ℃ 15 s、58 ℃ 15 s、68 ℃ 5 min(20个循环); 68 ℃ 5 min。PCR产物经过DpnI酶切,37 ℃消化4 h以去除含甲基化的模板DNA。将经过DpnI处理的PCR产物纯化回收,测序。测序结果进行BLAST比对确认MALAT1以及MALAT1-Mut已成功克隆至psiCHECK-2载体中,上述野生型和突变型测序引物详见表3。
3.4阳离子脂质体法进行细胞转染 双萤光素酶报告实验中采用293T细胞进行转染,细胞培养方法详见课题组前期参考文献[4]。转染前1 d,细胞按每孔2×104的密度接种于含10% FBS的DMEM高糖培养基测定24孔板上。转染当天,细胞汇合度约为70%~80%,吸去旧的培养基,用PBS洗涤2次,然后每孔加入300 μL Opti-MEM培养基,置于5% CO2、37℃培养箱中;每个孔用Opti-MEM培养基稀释Lipofectamine 2000 1 μL,终体积为50 μL,室温下静置5 min;每个孔加入20 μmol/L的miRNA 1 μL或miRNA抑制剂和0.5 μg质粒,再加入Opti-MEM至总体积50 μL,室温下静置5 min;(最终孵育液中为50 nmol/L miRNA或100 nmol/L miRNA抑制剂)复合上述2个步骤中的稀释液,室温下静置20 min;每孔加入100 μL转染复合液,晃动24孔板稍加混匀;在5% CO2、37 ℃培养箱中孵育5 h,用新鲜的完全培养基(含FBS)替换含有转染复合物的培养基[4]。
3.5萤光素酶活性检测 用Dual-Luciferase Reporter Assay System (E1910)进行样品萤光素酶活性检测。 转染48 h后,吸去旧的培养基,用PBS清洗2次,每孔细胞加入100 μL PLB (Passive Lysis Buffer),室温轻微振摇15 min,收集细胞裂解液。将20 μL细胞裂解液加入发光板后,用GloMax生物发光检测仪读取背景值2 s,每样品加入100 μL LAR II工作液,快速混匀,读值2 s。读值完毕后,每样品再加入100μL Stop & Glo®Reagent,快速混匀后,放入发光检测仪中,读值2 s。以上每个样本重复3次,记录结果和保存数据[4]。
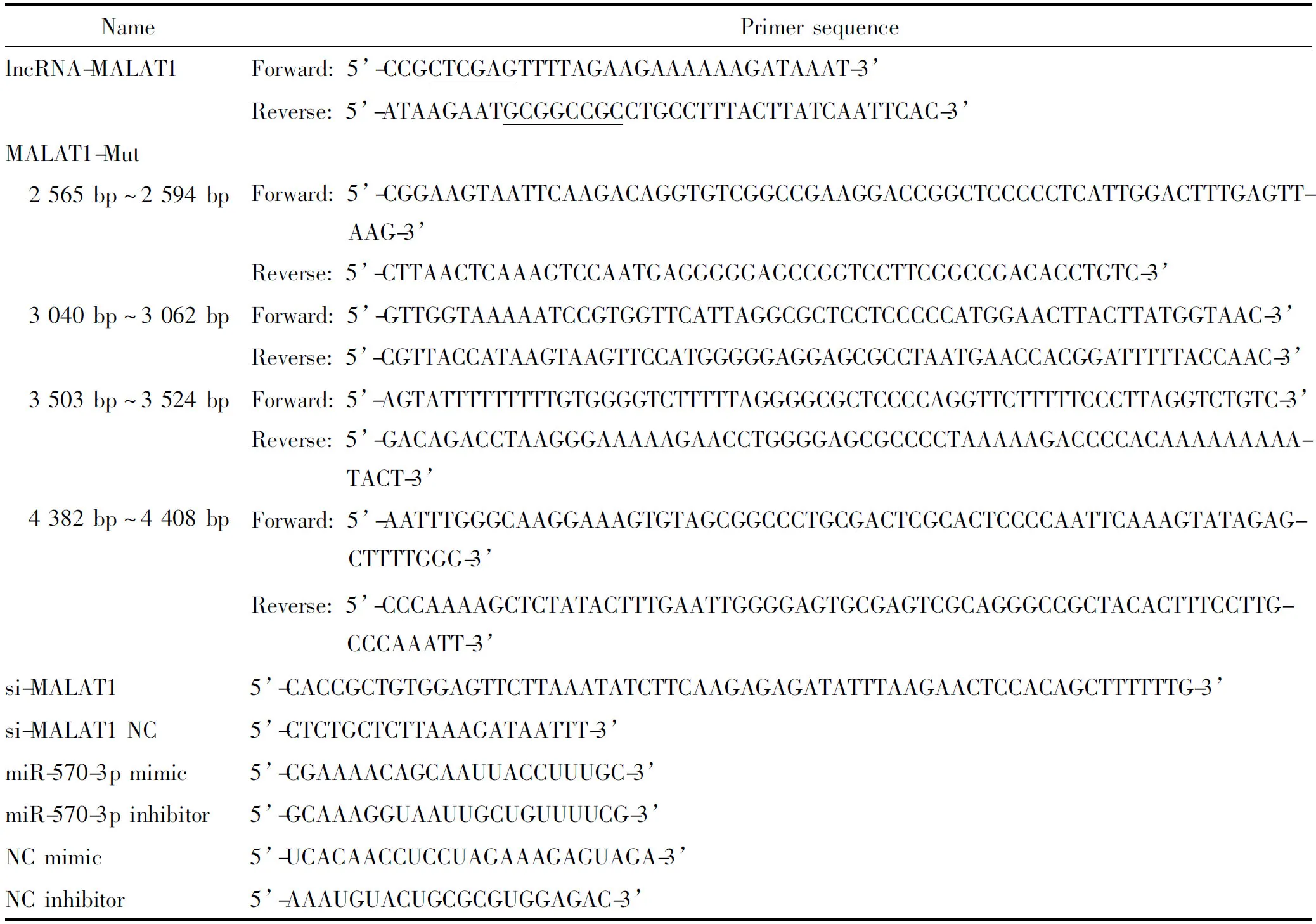
表2 引物序列

表3 测序引物序列
4 统计学处理
采用SPSS 17.0 统计软件分析,计量资料以均数±标准差(mean±SD)表示,报告基因分析中多组之间的差异比较采用单因素方差分析,组间两两比较采用Bonferroni法,以P<0.05 为差异有统计学意义。
结 果
1 MALAT1对胃癌细胞增殖的影响
MTS检测结果显示,si-MALAT1组细胞在体外培养24、48和72 h的A490值均低于si-MALAT1 NC组和空白对照组(P<0.01),见图1,表明lncRNA-MALAT1能够促进胃癌细胞的增殖。
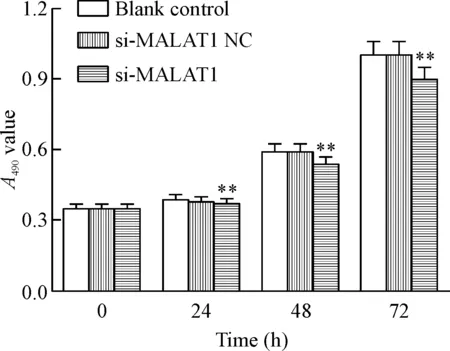
Figure 1.Detection of gastric cancer cell proliferation in each group. Mean±SD. n=3.**P <0.01 vs blank control and si-MALAT1 NC group.
2 不同时点miR-570-3p表达量变化情况
检测单纯的SGC7901细胞株培养不同时点miR-570-3p表达量变化情况,结果显示,随着时间的推移,miR-570-3p的表达量呈明显的动态下降趋势(P<0.01),见图2,提示miR-570-3p的表达与胃癌细胞增殖呈负相关关系。
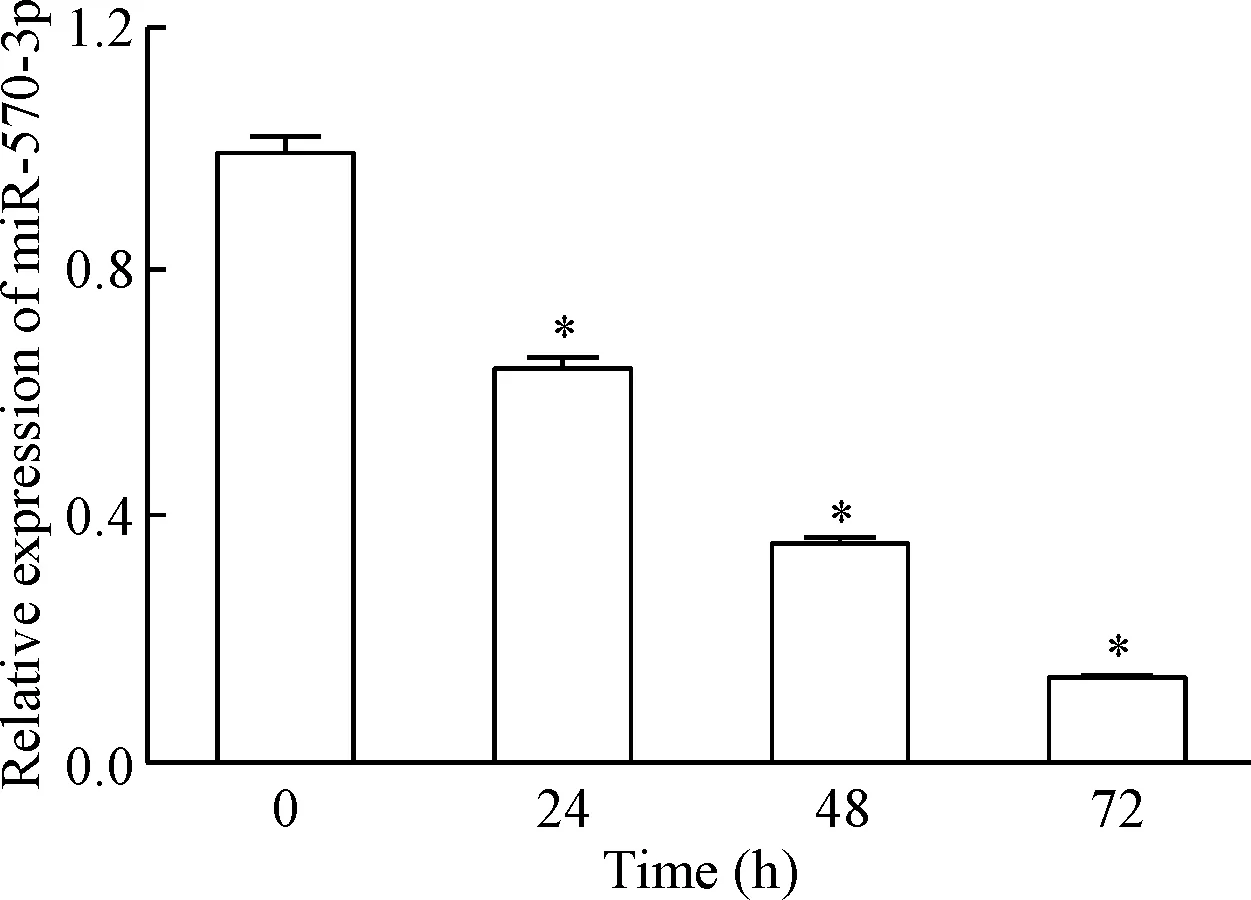
Figure 2.The miR-570-3p expression in pure SGC7901 gastric cancer cell cultured in vitro at different time points Mean±SD. n=3. *P<0.05 vs 0 h.
3 lncRNA-MALAT1和miR-570-3p表达的关系
si-MALAT1组lncRNA-MALAT1的表达量较si-MALAT1 NC组和空白对照组明显降低(P< 0.01);而si-MALAT1组miR-570-3p的表达量较si-MALAT1 NC组和空白对照组明显升高(P<0.01),见图3,表明抑制lncRNA-MALAT1后miR-570-3p表达出现显著上调。
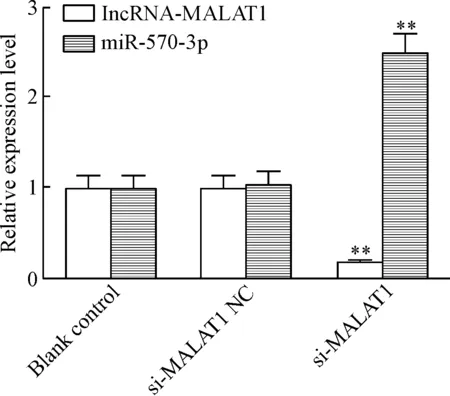
Figure 3.The MALAT1 and miR-570-3p expression in the gastric cancer cells in each group. Mean±SD. n=3. **P<0.01 vs blank control group and si-MALAT1 NC group.
4 psiCHECK-2-MALAT1双萤光素酶报告基因载体的酶切鉴定和测序
采用RegRNA 2.0分析MALAT1基因序列,确定与miR-570-3p潜在结合位点,见图4。psiCHECK-2-MALAT1野生型和psiCHECK-2-MALAT1突变型酶切鉴定及测序结果均显示,目的基因MALAT1和其突变型均已成功转入psiCHECK-2 载体中,见图5,其中MALAT1(3 000 bp)在相应的位置切出一条目的条带(5A箭头所指),psiCHECK-2-MALAT1双萤光素酶报告基因载体构建成功。

Figure 4.Binding sites of miR-570-3p and lncRNA-MALAT1.
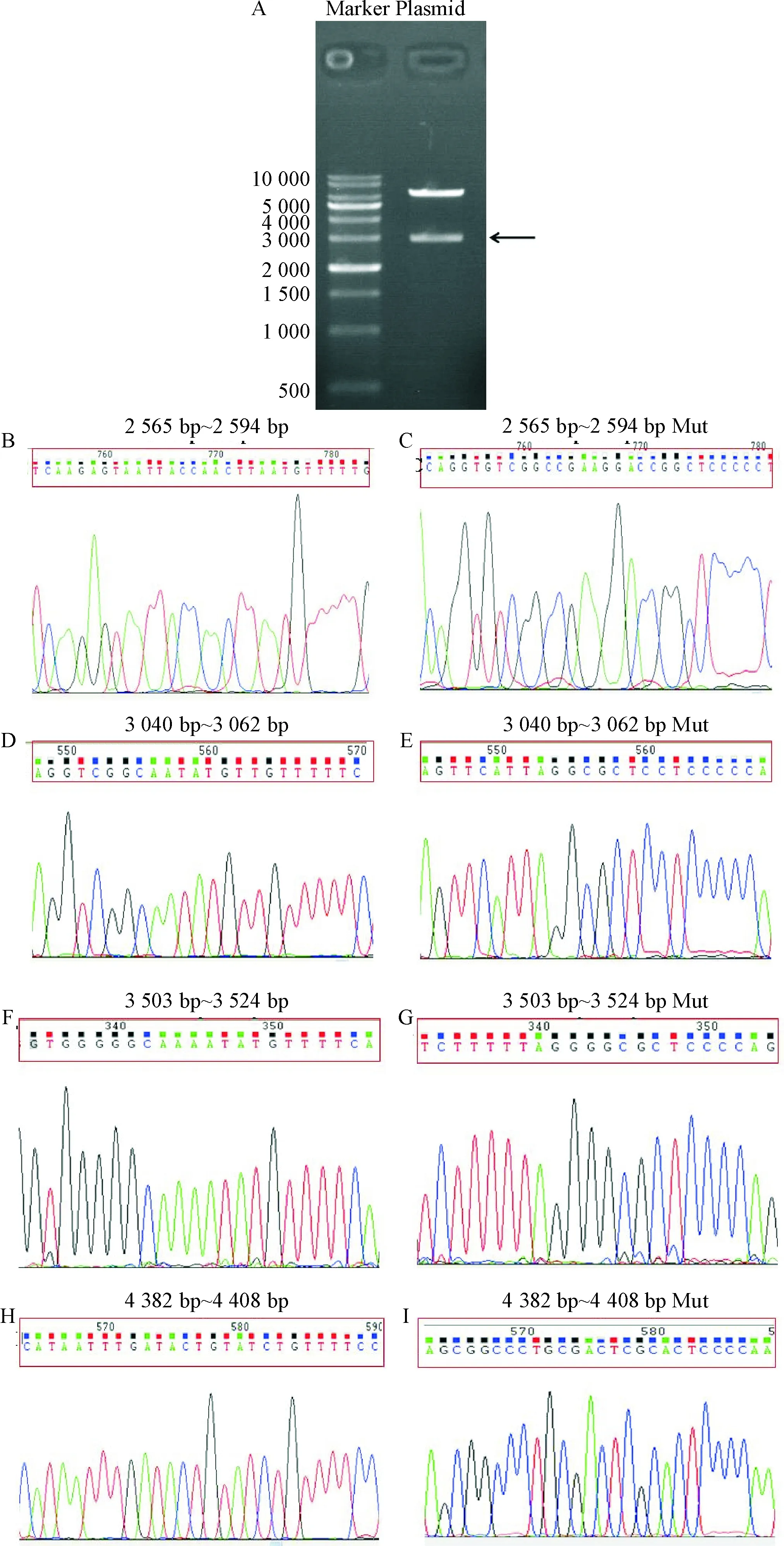
Figure 5.Endonuclease digestion and sequencing of the constructed recombinant plasmids. A: the result of enzyme digestion analysis; B and C: the sequencing analysis of the 2 565~2 594 bp of MALAT1 and MALAT1-Mut, respectively; D and E: the sequencing analysis of the 3 040~3 062 bp of MALAT1 and MALAT1-Mut, respectively; F and G: the sequencing analysis of the 3 503~3 524 bp of MALAT1 and MALAT1-Mut, respectively; H and I: the sequencing analysis of the 4 382~4 408 bp of MALAT1 and MALAT1-Mut, respectively.
5 Promega 双萤光素酶报告基因检测结果
双萤光素酶报告基因检测显示,miR-570-3p模拟物与MALAT1野生型和突变型报告基因共转染293T 细胞后,miR-570-3p模拟物组MALAT1野生型的双萤光素酶活性与miR-570-3p模拟物组阴性对照组相比萤光素酶活性明显降低(P<0.01),而miR-570-3p抑制剂组MALAT1野生型双萤光素酶活性与miR-570-3p抑制剂阴性对照组相比明显增强(P<0.01); miR-570-3p模拟物、miR-570-3p抑制剂、miR-570-3p模拟物阴性对照、miR-570-3p抑制剂阴性对照对MALAT1突变型的萤光素酶活性无明显影响,见图6。

Figure 6.The results of Promega dual-luciferase reporter assay. Mean±SD. n=3. **P<0.01 vs NC mimic group; ##P<0.01 vs NC inhibitor group.
讨 论
表观遗传和非编码RNA在肿瘤的发生、发展及免疫逃避方面起着重要作用[10]。LncRNA是一类转录本长度超过200个核苷酸的RNA分子,它们本身并不编码蛋白,而是以RNA的形式在不同层面广泛参与机体多种生物学功能的调控,其中包括对基因表达的遗传和表观遗传调控、基因表达的转录水平调控、细胞核亚结构的形成以及对干细胞多能性和体细胞重编程的调控等[3-4]。有证据表明lncRNA不仅在正常细胞的增殖和分化过程中发挥着重要调控作用,其在肿瘤的发生、发展等过程中同样表现出诸多潜在的作用[1-2]。现已发现在恶性肿瘤中普遍存在异常的lncRNA表达谱[11]。miRNA在肿瘤领域的研究目前已经不断深入。既往研究表明miRNA参与了多种肿瘤的调控。miRNA 在各种恶性肿瘤中存在表达量上的差异性,其特异性表达调节了肿瘤细胞的增殖、分化和凋亡[12]。近年来关于miRNA 与肿瘤的发生发展以及诊断和治疗等方面的相关研究亦不断涌现。现已证实lncRNA可作为ceRNA通过miRNA 应答元件(miRNA response element,MRE)竞争结合具有相同MRE 的miRNA来调控靶基因的表达水平,从而影响细胞的功能[3-4],并且这种调控机制在肿瘤的发生发展中发挥了重要作用[5]。
lncRNA-MALAT1首先在非小细胞肺癌被发现并引起关注。lncRNA-MALAT1定位于染色体11q13.1,在哺乳动物进化中高度保守,核苷酸序列3’ 末端 5 kb 左右人鼠同源性高达90%,提示其在进化过程中扮演了重要角色[13]。多项研究表明lncRNA-MALAT1在胃癌中的表达增高与肿瘤的侵袭、进展及转移密切相关。LncRNA-MALAT1能够促进胃癌细胞的扩增[14],其亦可通过抑制凋亡及上皮间质转化进而增加胃癌细胞的肿瘤源性和侵袭性[15];另发现lncRNA-MALAT1能够作用于肿瘤抑制因子进而促进胃癌细胞的迁移和侵袭[16];此外,lncRNA-MALAT1还通过正向调节血管形成进而促进胃癌的发生和转移[17];已有学者发现lncRNA-MALAT1高表达与胃癌患者的淋巴结转移、近处转移以及总体生存率相关[18]。由此可见,lncRNA-MALAT1在胃癌的发生、发展及转移中均扮演着至关重要的角色。在本研究中,与既往报道相一致,我们发现,抑制lncRNA-MALAT1在胃癌SGC7901细胞株的表达后,细胞不同时点的增殖能力显著下降,表明lncRNA-MALAT1能够促进胃癌细胞的增殖。
目前已有报道lncRNA-MALAT1可作为ceRNA参与调控肿瘤的发生发展[7,19-20]。miR-570-3p被证实与消化系统肿瘤的发生发展密切相关,其能够抑制一些肿瘤的侵袭性并降低恶性肿瘤的死亡风险。miR-570-3p的遗传突变与胆囊癌的易感性及治疗预后相关[21]。研究显示miR-570-3p能够抑制慢性粒细胞白血病细胞的扩增和糖代谢[8],另有报道miR-570-3p表达增高能显著降低直结肠癌的死亡风险[22]。既往已有一些关于miR-570与胃癌的相关研究报道,如miR-570-3p能够通过下调肿瘤免疫相关因子的表达影响胃癌的临床病理进程包括分化,肿瘤侵袭性及淋巴结转移等[9]。另有研究发现miR-570-3p与胃腺癌的临床病理特征包括分化阶段、浸润深度、淋巴结转移以及TNM分期均相关[23]。在本研究中,为明确lncRNA-MALAT1是否能够通过靶向下调miR-570-3p参与调控胃癌细胞增殖,我们在体外培养的单纯SGC7901胃癌细胞株中检测了不同时点miR-570-3p表达量的变化情况,结果显示随着细胞增殖率的逐渐增加,miR-570-3p表达呈明显的动态下降趋势,提示miR-570-3p的表达与胃癌细胞增殖呈负相关关系。在此基础上,我们检测了不同实验组lncRNA-MALAT1和miR-570-3p的表达情况,结果显示在采用siRNA抑制lncRNA-MALAT1的表达后,miR-570-3p表达显著上调,表明lncRNA-MALAT1能够抑制miR-570-3p的表达。我们进一步通过生物信息学网站RegRNA 2.0数据库预测lncRNA-MALAT1和miR-570-3p的潜在结合位点,在此基础上构建含MALAT1野生型和突变型质粒的双萤光素酶报告载体,并用双萤光素酶报告基因检测分析MALAT1与miR-570-3p之间的靶向关系。我们发现,miR-570-3p模拟物组MALAT1野生型报告基因的萤光素酶活性显著降低,miR-570-3p抑制剂组MALAT1野生型报告基因的萤光素酶活性则明显增加;而miR-570-3p模拟物、miR-570-3p抑制剂及其阴性对照对MALAT1突变型的萤光素酶活性均无明显影响。以上充分说明了lncRNA-MALAT1能够直接靶向结合并下调miR-570-3p。
综合以上,本研究发现lncRNA-MALAT1能够靶向结合并下调miR-570-3p进而促进胃癌细胞增殖。本研究为胃癌的诊断治疗以及预后判断提供了一个新的靶点和突破口。

