中国早期乳腺癌卵巢功能抑制临床应用专家共识(2018年版)
中国抗癌协会乳腺癌专业委员会
乳腺癌已经成为威胁中国女性健康的第一大恶性肿瘤,发病率呈逐年上升的趋势。中国乳腺癌发病率年增幅是世界平均水平的2倍,相较于美国乳腺癌患者的中位诊断年龄64岁,中国乳腺癌患者的中位诊断年龄为48~50岁,更为年轻,约有60%的患者在诊断时为绝经前状态[1]。据统计,中国绝经前女性早期乳腺癌患者中50%~60%为激素受体阳性,辅助内分泌治疗是降低这类患者复发风险的重要手段,如采用他莫昔芬治疗5~10年已经成为绝经前激素受体阳性早期乳腺癌患者的标准内分泌治疗方式[2-5]。卵巢功能抑制(ovarian function suppression,OFS)已经应用于乳腺癌治疗数十年,早期辅助治疗研究证实,单独的OFS能够降低50岁以下乳腺癌患者的复发风险,改善生存情况[2]。2009年的一项关于促性腺激素释放激素激动剂(gonadotropin-releasing hormone agonists,GnRHa)在早期乳腺癌中的Meta分析结果显示,没有足够的证据证实GnRHa增加辅助化疗或他莫昔芬治疗的临床获益,从而OFS的治疗地位变得模糊起来[6]。因此,中国抗癌协会乳腺癌专业委员会召集了国内乳腺癌治疗领域的临床专家,基于当时的循证医学数据,如TEXT和SOFT研究5年随访的结果[7-8]等,共同商讨制定了《中国早期乳腺癌卵巢功能抑制临床应用专家共识(2016年版)》[9]。但新的循证医学数据,例如SOFT和TEXT 8年随访数据[10]、ASTRRA研究[11]和HOBOE-2[12]研究结果,都证实联合OFS的治疗方案能够为绝经前激素受体阳性的乳腺癌患者带来获益,共识的修改和更新势在必行。因此中国抗癌协会乳腺癌专业委员会再次召集国内乳腺癌领域的临床专家,共同商讨修订了《中国早期乳腺癌卵巢功能抑制临床应用专家共识(2018年版)》,该共识为进一步规范和优化OFS在早期绝经前乳腺癌患者中的临床应用提供了指导意见。
1 OFS的作用机制
绝经前女性下丘脑分泌促性腺激素释放激素(gonadotropin-releasing hormone,GnRH),与垂体细胞膜上相应受体结合,使垂体释放黄体生成素(luteinizing hormone,LH)和卵泡刺激素(follicle-stimulating hormone,FSH),从而作用于卵巢并释放雌激素。雌激素能促进乳腺肿瘤的生长[13-14]。OFS是指通过手术或药物抑制卵巢产生雌激素。常用药物包括GnRHa。常见的GnRHa有戈舍瑞林、曲普瑞林和亮丙瑞林。GnRHa通过对垂体持续刺激,抑制垂体分泌LH和FSH,雌激素的分泌量随之下调,从而达到下调雌激素水平的目的[15-16]。
2 绝经状态判定
绝经一般是指月经永久性终止,提示卵巢合成的雌激素持续性减少。绝经状态的确定,对于内分泌治疗的选择至关重要。年龄和治疗导致的闭经时间、雌二醇(estradiol,E2)水平和FSH水平是判断绝经状态的指标。自然绝经和干预绝经的相关定义见表1。

表 1 自然绝经和干预绝经的相关定义
《中国抗癌协会乳腺癌诊治指南与规范(2017版)》[17]和《中国绝经前女性乳腺癌患者辅助治疗后绝经判断标准及芳香化酶临床应用共识(草案修正案)》[18]在绝经的定义方面存在一些差异,前者是根据国外的指南而制定的,后者则结合中国女性实际绝经的中位年龄和临床实践的可操作性而制定的。指南和共识均指出,双侧卵巢切除术后的患者均为绝经后患者;正在接受LHRH拮抗剂/激动剂的患者月经状况无法判断;化疗前未绝经者,化疗所致的闭经也不能判断其为绝经后状态。
化疗或内分泌治疗后闭经的患者需反复测定FSH和E2水平,确认其为绝经后状态时方能应用芳香化酶抑制剂(aromatase inhibitor,AI)。绝经前患者使用AI存在两个方面的问题:AI相关的绝经前雌激素水平较高可以使AI疗效降低、失效甚至可能增加乳腺癌的复发风险;AI的促排卵作用可以引起非预期怀孕。有文献报道,化疗停经患者的绝经判定可能需要8个月的等待时间[7],年龄小于45岁的亚洲女性的等待时间长达2年[11]。
3 绝经前激素受体阳性的早期乳腺癌OFS临床应用的专家观点
3.1 OFS方式和选择
OFS方式主要包括双侧卵巢手术去势、卵巢放疗去势和药物去势。手术去势包括传统手术切除术和腹腔镜手术切除术,为有创性并且不可逆。卵巢切除术虽然可使血清E2浓度迅速降低,但患者也永久性失去卵巢[16]。卵巢放疗相关研究显示,20%~30%的患者经放疗后不能成功达到卵巢去势的效果,且整体诱导雌激素下降的水平显著差于卵巢切除术,因而临床使用受到了限制[16]。
去势药物GnRHa能够抑制血清中雌激素水平,其抑制程度与手术去势相似。在激素受体阳性的转移性乳腺癌患者中开展的Intergroup研究显示,戈舍瑞林对乳腺癌治疗的客观有效率与手术去势相当,且使用戈舍瑞林患者安全性和耐受性良好[19]。在辅助治疗的ZEBRA研究中,接受2年的戈舍瑞林辅助治疗后,77%的患者在3年内恢复卵巢功能,而接受CMF方案化疗的患者3年内仅有23%的患者卵巢恢复正常功能[20],因此使用GnRHa是绝经前乳腺癌患者一种理想的OFS方法,2016年的美国临床肿瘤协会(American Society of Clinical Oncology,ASCO)关于OFS的指南更新也推荐使用GnRHa药物去势为OFS疗法的首选[21]。
专家观点:GnRHa能够迅速降低女性血清雌激素水平,达到绝经后状态,停药后这一作用可逆。因此建议将GnRHa药物去势作为绝经前激素受体阳性早期乳腺癌患者OFS的首选。
3.2 OFS的获益人群
ZEBRA研究观察2年戈舍瑞林对比CMF化疗方案治疗绝经前早期乳腺癌的疗效,结果显示,对于激素受体阳性的患者,两组治疗方案的无病生存率和总生存率差异无统计学意义(P>0.05),且戈舍瑞林组相比CMF方案化疗有较好的耐受性[20,22]。2007年,GnRHa在乳腺癌辅助治疗的Meta分析进一步确认,在激素受体阳性患者中戈舍瑞林单药与化疗的临床获益相似[5]。在ZIPP研究中,在标准放化疗后,患者随机分配到观察组、2年他莫昔芬组、2年戈舍瑞林组和2年他莫昔芬联合戈舍瑞林组。研究对比了含戈舍瑞林方案和不含戈舍瑞林方案的患者获益,在不加他莫昔芬的基础上,戈舍瑞林能够显著获益;而在他莫昔芬基础上,戈舍瑞林获益不显著[23]。该研究的局限性在于辅助内分泌治疗的时间只有2年,相比于标准5年的内分泌治疗时长来说,不符合当前的临床实践。另外一项E-3193研究,纳入了肿瘤小于3 cm且淋巴结阴性未接受辅助化疗的绝经前激素受体阳性的患者,接受5年他莫昔芬单药对比5年OFS联合他莫昔芬的研究。5年的无病生存率(87.9% vs 89.7%,P=0.62)和总生存率(95.2% vs 97.6%,P=0.67)差异无统计学意义,但是该研究因入组慢而提前终止,分析未达到研究假设的统计学效能[24]。
2014年的SOFT研究报道,5年随访结果显示,OFS联合他莫昔芬对比他莫昔芬单药在总人群中没有显著获益。但在接受化疗的亚组中,他莫昔芬单药组、OFS联合他莫昔芬组与OFS联合AI组的5年无乳腺癌生存率分别为78.0%、82.5%和85.7%,绝对获益率分别为4.5%和7.7%,乳腺癌发生风险分别降低了22%(HR=0.78,95%CI:0.60~1.02)和35%(HR=0.65,95%CI:0.49~0.87);在年龄<35岁的年轻患者中,他莫昔芬单药组、OFS联合他莫昔芬组与OFS联合AI组的5年无乳腺癌生存率分别为67.7%、78.9%和83.4%,5年无乳腺癌生存绝对获益率分别为11.2%和15.7%;在未化疗的亚组中,3个治疗组的无乳腺癌生存率都在95%以上[7]。2018年N Engl J Med发表的SOFT 8年随访结果则进一步显示了整体人群获益,OFS联合他莫昔芬较他莫昔芬单药显著提高无病生存率(83.2% vs 78.9%,HR=0.76,95%CI:0.62~0.93,P=0.009)及总生存率(93.3% vs 91.5%,HR=0.67,95%CI:0.48~0.92)。OFS联合AI相较于他莫昔芬单药在整体人群中显著提高无病生存率(85.9% vs 78.9%,HR=0.65,95%CI:0.53~0.81)。未化疗亚组和化疗亚组患者的无疾病生存率趋势未见异质性。化疗亚组OFS联合他莫昔芬相较于他莫昔芬单药随访8年的无病生存率分别为76.7%和71.4%,绝对获益率为5.3%;未化疗亚组,8年的无病生存率分别为90.6%和87.4%,绝对获益率为3.2%。在小于35岁的人群中,OFS联合他莫昔芬相较于他莫昔芬单药随访8年的无病生存率分别为73%和64.3%,绝对获益率为8.7%。在亚组分析中显示,人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)状态并不影响OFS的疗效[10]。
2017年St. Gallen共识指出,考虑使用OFS的因素包括:年龄小于等于35岁、接受辅助化疗后仍为绝经前激素水平、淋巴结转移数大于等于4个[25]。2016年ASCO更新的OFS治疗指南指出,较高危患者应当接受含OFS的内分泌治疗,低危患者则不需要使用含OFS的内分泌治疗;临床分期为Ⅱ或Ⅲ期应接受辅助化疗的患者,推荐接受含OFS的内分泌治疗;临床分期为I或Ⅱ期考虑使用化疗的较高危患者,应考虑使用含OFS的内分泌治疗[21]。截止本共识发稿之日,St. Gallen共识和ASCO指南尚未基于SOFT和SOFT&TEXT研究的最新结果进行更新。
专家观点:中高危绝经前激素受体阳性乳腺癌推荐接受OFS的内分泌治疗;低危患者推荐他莫昔芬单药治疗。建议采用如下临床路径以选择辅助内分泌治疗方案(图1,表2)。
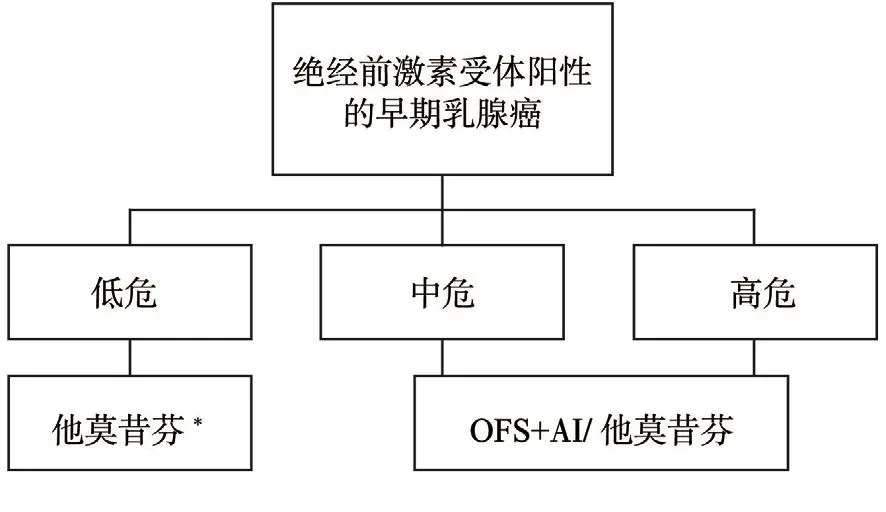
图 1 绝经前激素受体阳性的早期乳腺癌的辅助内分泌治疗临床路径

表 2 乳腺癌术后复发风险的分组[17]
3.3 OFS联合方案的选择
在绝经后辅助内分泌治疗中,初始5年的AI治疗相比他莫昔芬显著降低了患者的复发风险[26]。ABCSG-12评估了戈舍瑞林联合他莫昔芬对比戈舍瑞林联合阿那曲唑的疗效。2011年中位随访62个月的结果显示,戈舍瑞林联合AI组与戈舍瑞林联合他莫昔芬组在无病生存率方面差异无统计学意义(P>0.05);而在总生存率方面,戈舍瑞林联合AI甚至较差[27]。是否辅助5年的OFS联合AI使绝经前激素受体阳性乳腺癌患者治疗获益,这在SOFT和TEXT研究中得到进一步评估。2014年发布的两项研究的结果显示,OFS联合AI治疗组及OFS联合他莫昔芬治疗组,在SOFT研究中,5年无病生存率分别为91.1%和87.3%,绝对获益率为3.8%(HR=0.72,P<0.001);在TEXT研究中,5年无病生存率分别为92.8%和88.8%,绝对获益率为4%(HR=0.66,P<0.001),在接受化疗患者中,远处复发率降低了2.6%(TEXT)和3.4%(SOFT)[8]。2018年N Engl J Med发表的最新SOFT和TEXT研究的9年随访结果再次证实,OFS联合AI显著提高了总体人群疾病的预后。与OFS联合他莫昔芬相比,OFS联合AI显示出无病生存持续的改善,8年无病生存情况率分别为82.8%和86.8%(HR=0.77,95%CI:0.67~0.90,P=0.0006),绝对获益为4%。并减少远处复发,8年无远处复发率分别为89.7%和91.8%(HR=0.80,95%CI:0.65~0.96),绝对获益为2.1%;HER2阴性患者(占总人群的86%)中,OFS联合AI改善所有亚组的疾病预后;对于HER2阴性且风险高需接受化疗的患者,OFS联合AI获得了显著的临床获益,在TEXT和SOFT研究中,无病生存绝对获益率分别为6.9%和9.2%,无远处复发间期绝对获益分别为5%和7%[10]。基于SOFT和TEXT研究的STEPP分析,纳入绝经前激素受体阳性、HER2阴性的患者,通过综合复发风险评分评估5年无乳腺癌间期的绝对获益,结果显示OFS联合AI相较于他莫昔芬单药在高危复发风险患者中5年BCFI的绝对获益率为10%~15%;中危复发风险患者5年BCFI的绝对获益率至少为5%;而非常低危的患者5年BCFI的绝对获益有限[28]。2018年ASCO大会上公布了基于SOFT和TEXT研究8年随访的STEPP分析,评估8年无远处复发率的绝对获益,结果显示,OFS联合AI相较于OFS联合他莫昔芬或单药他莫昔芬在高危复发风险患者中,8年无远处复发率绝对获益率为10%~15%;在中危复发风险患者中,8年无远处复发绝对获益率为4%~5%;在低危复发风险患者中,他莫昔芬单药治疗基础上强化内分泌治疗的获益较少,因为大于97%的患者在治疗第8年时仍未出现远处复发[29]。2018年欧洲临床肿瘤协会(European Society for Medical Oncology,ESMO)年会上公布了HOBOE-2研究的结果,HOBOE-2研究是一项Ⅲ期平行对照研究,纳入了1 065例患者,随机分为3个治疗组,分别为他莫昔芬联合曲普瑞林(他莫昔芬+OFS)、来曲唑联合曲普瑞林(AI+OFS)以及唑来膦酸联合来曲唑和曲普瑞林(唑来膦酸+AI+OFS),患者中位年龄45岁,中位随访65个月。结果显示,绝经前激素受体阳性的早期乳腺癌患者接受5年唑来膦酸联合AI和OFS、5年AI联合OFS和5年他莫昔芬联合OFS的5年无病生存率分别为93.3%、93.2%和85.4%,5年OFS联合AI相较于5年OFS联合他莫昔芬的无病生存率绝对获益为7.8%(HR=0.72,95%CI:0.48~1.07,P=0.06);在此基础上联合唑来膦酸相较于5年OFS联合他莫昔芬显著改善了无病生存情况,减少了48%的疾病发生风险,绝对获益率为7.9%(HR=0.52,95%CI:0.34~0.80,P=0.003)[12]。
OFS联合AI的不良事件发生率与AI在绝经后激素受体阳性乳腺癌相似。AI联合OFS组多见骨质疏松、骨折和阴道干燥等;他莫昔芬联合OFS组多见血栓症状、潮热和夜汗;两组患者的依从性良好,3、4级不良事件发生率相似(32%和31%);AI联合OFS组早期停止规定的口服内分泌治疗的患者更多(1年:14% vs 6%;4年:25%vs 19%);曲普瑞林停药率差异无统计学意义(4年:18% vs 19%)[10]。
专家观点:对绝经前激素受体阳性的早期乳腺癌中危和高危患者,或STEPP分析的较高风险患者推荐OFS联合AI治疗,OFS联合他莫昔芬治疗也是合理的选择。对存在他莫昔芬禁忌证的任何风险级别患者,推荐OFS联合AI治疗。
3.4 GnRHa用药时机
对于接受化疗的早期绝经前激素受体阳性的乳腺癌患者,使用GnRHa的起始时间(同步化疗还是等化疗结束且确认绝经前状态后序贯使用)一直存在较多的争议。2018年美国临床肿瘤协会(American Society of Clinical Oncology,ASCO)年会上发表的一项韩国的ASTRRA研究,纳入了雌激素受体阳性、年龄小于45岁、既往接受过(新)辅助化疗且未绝经或后续恢复卵巢功能的早期乳腺癌患者,评估他莫昔芬(5年)+OFS(2年)对比他莫昔芬(5年)的疗效。该项研究在最后一次化疗后3个月内进行卵巢功能基线评估,且每6个月进行一次卵巢功能评估,持续2年,当评估为绝经前患者时进行随机。对化疗诱导闭经的患者先给予口服他莫昔芬。结果显示,OFS联合他莫昔芬组和他莫昔芬单药组5年无病生存率分别为91.1%和87.5%(HR=0.686,95%CI:0.483~0.972,P=0.033)[11]。在TEXT研究中,计划接受化疗的患者接受OFS同步化疗的治疗方案。结果显示,OFS联合AI和OFS联合他莫昔芬的5年无病生存率分别为89.8%和84.6%,8年无病生存率分别为86.8%和82.8%[8,10]。SOFT研究入组的患者如接受化疗,则在末次化疗后8个月内确认绝经前状态后再接受OFS。结果显示,OFS联合AI和OFS联合他莫昔芬的5年无病生存率分别为84.3%和80.6%,8年无病生存率分别为85.9%和83.2%[7,10]。TEXT和SOFT两组患者接受内分泌治疗的依从性相当。另外,PROMISE研究入组的绝经前患者接受化疗同步GnRHa治疗对比化疗,其中80%的患者为激素受体阳性。生存结果显示,两组患者5年无病生存率分别为80.5%和83.7%(HR=1.17,95%CI:0.72~1.92,P=0.52)[30]。一项在绝经前早期乳腺癌患者化疗期间短期运用GnRHa进行OFS的Meta分析,GnRHa组与对照组的5年无病生存率差异无统计学意义(85.1% vs 87.6%,HR=1.17,95%CI:0.62~2.20),5年总生存率差异也无统计学意义(96.6% vs 95.6%,HR=0.79,95%CI:0.24~2.59)[31]。
在SOFT和ASTRRA研究中,化疗后确认绝经前状态后再使用GnRHa,避免了部分因化疗导致卵巢永久性损伤患者使用GnRHa的必要性。在ASTRRA研究中观察时间甚至长达2年,95.1%的患者在化疗结束2年后恢复卵巢功能。过长的等待将会造成部分患者丧失接受OFS和AI治疗的机会[7,11]。
专家观点:根据激素受体阳性乳腺癌化疗前的卵巢功能状态,决定辅助内分泌治疗方案;GnRHa可以在化疗结束后直接序贯使用;GnRHa同步化疗不影响患者的生存获益;已接受化疗的患者不推荐确认卵巢功能状态后再使用GnRHa。
3.5 GnRHa最佳疗程
关于GnRHa在绝经前乳腺癌治疗中的最佳疗程,目前尚无明确定论。既往关于GnRHa用于绝经前乳腺癌辅助治疗的重要临床研究采用了2、3或5年的OFS疗程,如ZIPP研究中GnRHa的疗程为2年,ABCSG-12研究中GnRHa的疗程为3年,SOFT和TEXT研究中GnRHa的疗程则为5年。上述疗程均证实了GnRHa良好的安全性和耐受性[7-8,10,23,27]。SOFT研究显示,GnRHa联合他莫昔芬组的5年无病生存率、无乳腺癌生存率和总生存率分别达86.6%、88.4%和96.7%[7],8年无病生存率、无乳腺癌生存率和总生存率分别达83.2%、89.4%和93.3%[10]。ASTRRA研究中接受他莫昔芬5年联合OFS 2年对比他莫昔芬5年,两组的5年无病生存率分别是91.1%和87.5%(HR=0.686,95%CI:0.483~0.972,P=0.033),OFS联合他莫昔芬组的绝对获益率为3.6%;两组的5年总生存率分别为99.4%和97.8%(HR=0.31,95%CI:0.102~0.941,P=0.029)[11]。HOBOE-2研究的结果显示,5年唑来膦酸联合AI和OFS、5年AI联合OFS以及5年他莫昔芬联合OFS的5年无病生存率分别为93.3%、93.2%和85.4%[12]。由于没有GnRHa不同治疗疗程的对比研究,基于内分泌治疗延长治疗的理念及SOFT/TEXT试验的长期随访结果,建议辅助GnRHa治疗的疗程为5年。
2015年《ESMO原发性乳腺癌诊断、治疗和随访临床实践指南》[32]和《中国抗癌协会乳腺癌诊治指南与规范(2017版)》[17]推荐的GnRHa疗程为2~5年。2017年St. Gallen专家共识[25]、2016年ASCO关于OFS的指南更新[21]以及2017年BCY3指南[33]推荐的疗程为5年。
专家观点:建议GnRHa辅助内分泌治疗的疗程为5年,短于5年但超过2年的应用也有获益。
3.6 GnRHa辅助治疗的安全管理
在SOFT/TEXT研究中,中位随访68个月时,仅13.7%的患者在早期停止了治疗,其中OFS联合AI组的停药率为16.1%,而OFS联合他莫昔芬组的停药率为11.2%[8]。中位随访9年时,15%的患者早期停止所有研究方案规定的治疗,OFS联合AI组早期停止规定的口服内分泌治疗的患者更多(1年:14% vs 6%;4年:24% vs 19%);曲普瑞林停药率无差异(4年:18% vs 19%)[10]。GnRHa联合AI或GnRHa联合他莫昔芬的主要不良事件与AI及他莫昔芬在绝经后乳腺癌患者的不良事件相似。两种含GnRHa的辅助内分泌治疗方案的3~4度不良事件发生率相当,但相比他莫昔芬单药明显增加。AI联合OFS组多见骨质疏松、骨折和阴道干燥等不良事件;他莫昔芬联合OFS组多见血栓症状、潮热和盗汗[8]。总之,这两种方案不会严重影响大部分患者的生活质量,但是部分患者确实因不良事件影响治疗的依从性,从而影响患者的生存获益。针对性的治疗能够有效地缓解不良事件的症状,改善患者的生活质量,提高治疗的依从性,从而降低乳腺癌的复发风险[34-35]。
专家观点:与患者充分沟通可能的不良事件,选用合适的药物去势治疗方案。合理的安全管理能够有效缓解不良事件症状,增加患者治疗的依从性(表3)。
3.7 雌激素水平检测
计划进行辅助内分泌治疗的绝经前患者,如进行OFS治疗,可能发生化疗诱导的月经状态改变,造成后续内分泌治疗方案的选择困难。但对于年轻患者而言,化疗导致的闭经大多为可逆的。一项595例的观察性研究显示,小于35岁的患者因化疗导致的闭经在化疗后6个月内恢复月经的比率为85%,35~40岁的患者因化疗导致的闭经在化疗后6个月内恢复月经的比率为61%[36]。一项针对45岁以下的中国乳腺癌患者的研究,91.1%的患者因化疗导致闭经,66.7%的患者化疗后能够恢复月经[37]。ASTRRA研究纳入年龄小于45岁的患者,发现81.4%的患者在化疗结束1年后恢复卵巢功能,95.1%的患者在化疗结束2年后恢复卵巢功能[11]。如果在化疗后对激素水平进行反复检测,以判定是否处于绝经前状态,进而决定是否进行OFS治疗既不可靠又延误后续治疗。另外,较低的雌激素水平需要精确度和灵敏度均较高的设备,尽管精准的雌激素水平检测值得进一步研究,但是广泛地检测雌激素仍然无法大范围使用[38]。CBCSG008研究开展了性激素三项的全国多中心临床调查研究[39],发现国内医疗机构由于使用了多种不同的检测仪器和多种试剂盒,各自的参考范围亦不相同,且目前尚无公认的以及没有权威的中国女性不同绝经状态的激素正常值,因此本共识不推荐在使用药物去势期间仅根据所检测的激素水平来做治疗的决定。此外,雌激素水平随自然周期波动,在OFS治疗的基础上联用其他内分泌治疗药物也会影响雌激素水平,激素水平的检测结果无法直接代表患者的卵巢功能状态[40]。另外,患者和医师应当在接受药物去势期间警惕某些可能提示卵巢功能恢复的生理变化,如月经恢复和(或)更年期症状的周期性波动。因此,在化疗开始前判断患者的卵巢功能状态更为合理[27]。
专家观点:对于接受药物去势的患者,不推荐在药物去势治疗过程中监测雌激素水平和根据检测报告来决定是否继续药物去势,但必须警惕某些可能提示卵巢功能恢复的生理变化,如月经恢复和(或)更年期症状的周期性波动。

表 3 含GnRHa辅助内分泌治疗安全管理治疗推荐

