牙鲆甲状腺素受体β互作蛋白的鉴定及其受甲状腺素调控的分析
喻 杰,付元帅,施志仪
(上海海洋大学水产与生命学院,农业部淡水水产种质资源重点实验室,上海 201306)
甲状腺素(TH)是一类氨基酸衍生物,其在鱼类早期发育过程中具有重要的调控作用。甲状腺素是由甲状腺素受体(TR)介导发挥作用的,研究证实,在TR介导TH基因转录的过程中,一系列的TR结合蛋白参与其中[1]。这些结合蛋白中,一些具有组蛋白乙酰转移酶(histone acetyl transferases, HATs)或组蛋白去乙酰化酶(histone deacetylases, HDACs)活性,它们通过对组蛋白特定氨基酸的乙酰化或去乙酰化修饰来重塑染色质结构。如果组蛋白尾部的赖氨酸残基被HAT乙酰化,则染色质结构会变松散,聚合酶II更易进入,从而启动转录。如果组蛋白尾部赖氨酸残基被HDAC去乙酰化,则染色质将变得紧凑,使得聚合酶II难以进入,导致转录抑制[2]。另外,TR还可以通过蛋白和蛋白结合的形式直接发挥作用。如TR可以与细胞周期蛋白D1(Cyclin D1)的CREB区域结合,阻止其磷酸化;对小鼠甲状腺肿瘤细胞的研究发现,TRβ还可以与磷脂酰肌醇-3激酶(PI3K)的p85α C末端的SH2区域结合[3],令其磷酸化,使得介导的下游通路发生级联激活反应。
免疫沉淀(immunoprecipitation,IP)是以抗原和抗体之间的专一性免疫反应为基础的用于研究蛋白质相互作用的经典方法,是确定蛋白质在完整细胞内生理性环境下天然相互作用的有效方法。通过抗体在细胞总蛋白裂解液中捕获抗原及与抗原相互作用的蛋白,经过适当地洗脱,收集免疫复合物,然后分离蛋白质,加以质谱鉴定,从而得到蛋白的氨基酸序列及种类信息[4]。牙鲆(Paralichthysolivaceus)是一种重要的海水经济养殖鱼类,其从仔鱼到稚鱼的发育经过一个重要的变态发育过程,该过程受甲状腺素的调控,而甲状腺素是由TR介导发挥作用的。关于甲状腺素在牙鲆变态过程中对相关功能基因影响的研究已有报道[5-7]。本研究以甲状腺素受体β(TRβ)为研究对象,制作多克隆抗体,利用免疫沉淀法在牙鲆胚胎细胞中探索TRβ的相互作用蛋白,以期进一步了解甲状腺素受体介导甲状腺素调控牙鲆变态过程,为牙鲆变态的分子机制研究提供基础资料。
1 材料与方法
1.1 牙鲆胚胎细胞
本研究所用的牙鲆胚胎细胞(flounder embryonic cells,FEC)来自中国水产科学研究院黄海水产研究所陈松林老师的馈赠,在本实验室细胞培养室连续培养。培养方法参照CHEN等[8]的研究。
1.2 牙鲆仔鱼实验
牙鲆仔鱼实验在中国水产科学研究院北戴河中心实验站进行,培育温度为19~21°C。将孵化后第15天(15 dph)的仔鱼随机分成3组(每组3个缸,每缸2 000尾鱼),饲养直至41 dph。3组分别为:正常对照组(NC):在天然海水中饲养;TH组:在含有0.1 mg·L-1TH(L-甲状腺素,T4;Sigma-Aldrich,St.Louis,MO,USA)的海水中饲养;TU组:在含30 mg·L-1硫脲(上海生工)的海水中饲养[9]。在21 dph(变态早期)和28 dph(变态高峰期)时采集各个实验组样品,收集的牙鲆幼体用DEPC水洗涤并用MS-222(125 mg·L-1;Sigma-Aldrich,St.Louis,MO,USA)进行麻醉,然后在液氮中速冻并在-80 ℃下储存直至使用。
1.3 牙鲆TRβ多克隆抗体制备
牙鲆TRβ多克隆抗体交由上海友科生物科技有限公司制备。制备流程为:表达载体构建-蛋白表达纯化回收-兔子免疫-抗体纯化。
1.4 免疫沉淀
待细胞长满培养瓶底,用预冷的PBS洗涤细胞两次,第二次洗涤后吸干PBS,加入预冷的2 mL裂解液和20 μL PMSF混合液,吹打使其充分融合,在-80 ℃冰箱中反复冻融3次,每10 min一次;超声破碎:功率200 W,5 s冲击,9 s间隙,共60次;经过超声处理的样品在4 ℃,12 000 r·min-1离心15 min,去除不溶物质;立即将上清液转移到新的离心管中;BCA法对总蛋白进行定量检测;取提取的蛋白1 mg,加入TRβ 多克隆抗体(5 μL)、适量PBS、甘油,IP结合体系为 1 mL,甘油终浓度为10 %。4 ℃摇床孵育过夜;次日,取60 μL protein A/G,加入10倍protein A/G体积的PBS进行清洗,重复4次;清洗结束后加入10倍protein A/G体积的IP buffer平衡1次,将清洗平衡后的protein A/G按每个样品60 μL加入到昨日的抗体蛋白复合物中,4 ℃结合2 h,结合完成后,用10倍体积的IP buffer清洗4次;加入适量体积的PBS及1×SDS loading buffer,沸水中煮10 min,用于后续分析。以兔IgG替代TRβ 多克隆抗体作为对照组(control),同步进行免疫沉淀。
1.5 Western Blot检测IP复合物
取免疫沉淀得到的蛋白复合物10 μL进行SDS-PAGE凝胶电泳、转膜、封闭,以TRβ 多克隆抗体为一抗进行免疫反应,紧接着孵育二抗,超敏ECL化学发光法显色拍照。
1.6 质谱检测IP复合物
取IP复合物进行SDS-PAGE电泳,切下含目的条带和蛋白marker的胶块,利用天根生物的试剂盒进行考马斯亮蓝染色脱色。脱色完成后,切下含目的蛋白的胶块进行胶内酶解。样品处理完成后,进行液质联用质谱分析。
1.7 牙鲆仔鱼总RNA提取和cDNA合成
将牙鲆仔鱼混合样品100 mg左右,加入1 mL Trizol,吹打并研磨,然后依照Trizol Reagent试剂盒方法提取总RNA,总RNA用NANODROP 2000测定OD 260/OD280值及浓度,再用1 % 琼脂糖凝胶电泳检测RNA ( 1.0 μg) 完整性。确认RNA质量能够满足后续实验要求后,置于-80 ℃冰箱保存备用。
RNA用DNase I处理后,作为模板,按照Promega公司试剂盒说明书方法进行反转录,反转录得到的cDNA直接用于PCR扩增或-20 ℃保存。
1.8 实时荧光定量PCR
从NCBI网站的GeneBank(https://www.ncbi.nlm.nih.gov/nucleotide/)中获取相应基因的mRNA序列,使用Primer Premier 5.0软件(Premier,Canada)设计用于定量RT-PCR的引物(表1)。使用20 μL反应体积进行PCR扩增反应:1 μL cDNA模板,上下游引物各0.5 μL (10 μM),10 μL THUNDERBIRD SYBR qPCR Mix (TOYOBO,Osaka,Japan),8 μL ddH2O。反应条件为:95 ℃ 10 min;95 ℃ 10 s;61 ℃ 15 s;72 ℃ 20 s,采集荧光39次,然后进行融解曲线的扩增。实验设置生物学重复3个,技术重复2次。实验前首先制备目的基因和内参基因的标准曲线。18s在牙鲆变态发育过程中具有恒定的表达,故本研究选择其为内参基因。标准曲线结果显示目的基因和内参基因的R值均大于0.99,相应的扩增效率(E)均介于95 %~100 %之间,并且目标基因和内参基因的M值相差小于0.1。基因相对表达量数据运用2-ΔΔCT方法计算[10],其数值用平均值±标准误差(mean±SE)表示,n=3。数据采用Sigamplot 10.0软件中的One-Way方差分析 (ANOVA),使用Dunnett’s T 多重比较法进行相对表达分析,当P<0.05时表示差异显著。

表1 研究所用引物Tab.1 Primers used in this study
注:F和R分别代表上游引物和下游引物;Q-RT-PCR:荧光定量PCR
Note: F and R denote forward and reverse primers, respectively; Q-RT-PCR: quantitative real-time PCR
2 结果与分析
2.1 牙鲆TRβ多克隆抗体的制备和检测
原核表达的TRβ蛋白经SDS-PAGE凝胶电泳检测正确后纯化回收进行兔子免疫。4次免疫完成后采集检测血清小样,抗血清效价符合标准后采全血分离抗血清。利用抗原亲和纯化柱对抗血清进行抗原亲和纯化,获得特异性抗体。最终获得抗原亲和纯化抗体3.6 mg,酶联免疫吸附实验(ELISA)结果显示抗体效价≥1∶80 000,符合标准。
将TRβ多克隆抗体以1∶1 000体积比稀释后作为一抗,HRP偶联的羊抗兔IgG以1∶2 000体积比稀释后作为二抗,分别对牙鲆胚胎细胞和牙鲆组织总蛋白质样品进行Western blot实验。结果如图1,在牙鲆细胞和组织样品中均检测到了信号,TRβ蛋白大小为43 kDa,在图1中显示为40 kDa蛋白marker左右的条带。该结果表明制备的牙鲆TRβ多克隆抗体在稀释1000倍时仍能识别牙鲆细胞和组织中的TRβ蛋白,说明该TRβ多克隆抗体具有良好的特异性。
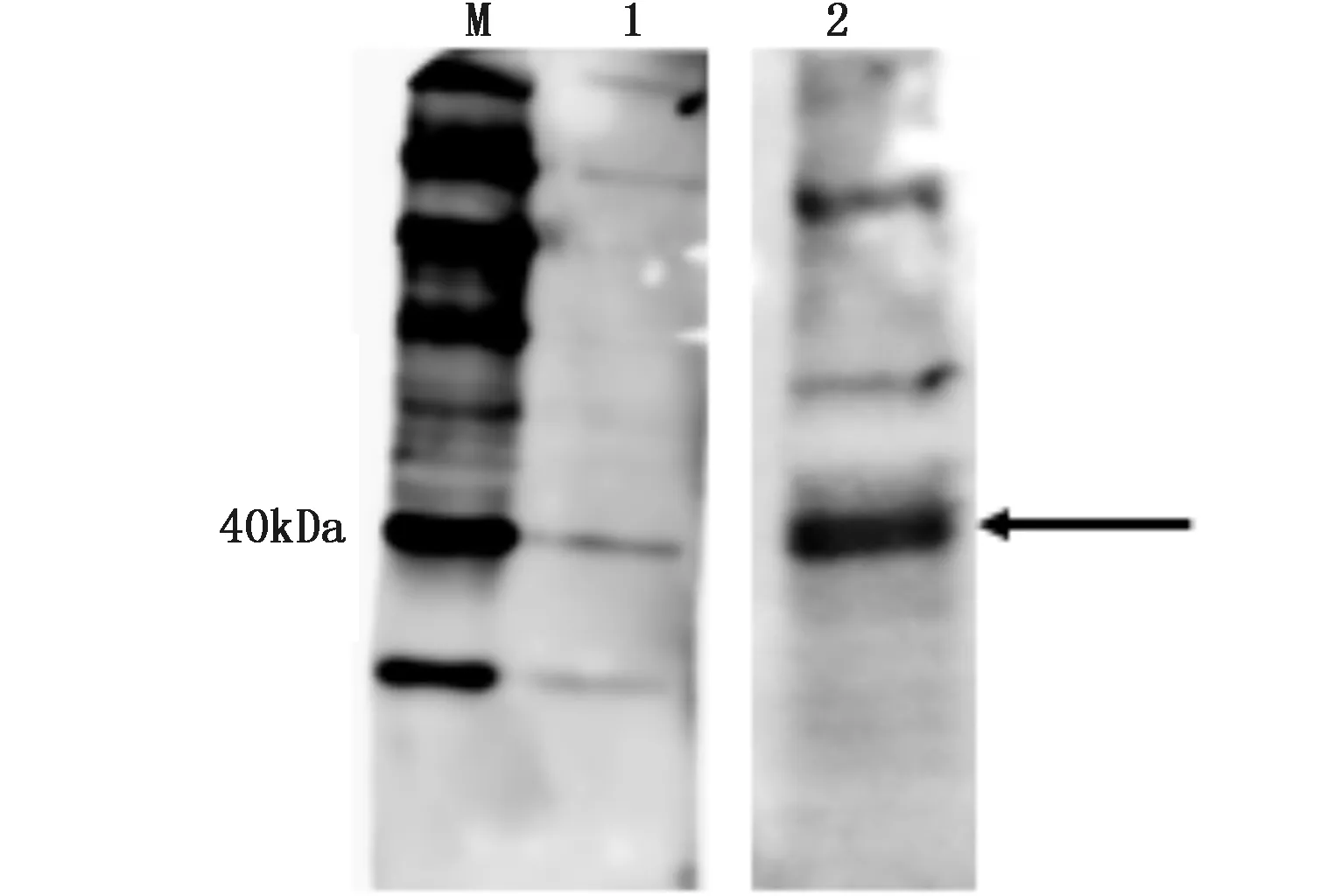
图1 TRβ多克隆抗体用于牙鲆细胞和组织总蛋白的Western BlotFig. 1 Western Blot analysis of the TRβ polyclonal antibody against total proteins from FECs and P. olivaceus tissues 注:M:蛋白质量标准;1:牙鲆胚胎细胞总蛋白WB;2:牙鲆组织总蛋白WB。箭头所指为牙鲆TRβ蛋白信号Note: M: protein marker; 1: FECs total protein WB; 2: P. olivaceus tissues total protein WB. The arrow shows signal of P. olivaceus TRβ protein
2.2 免疫沉淀
2.2.1 Western Blot检测免疫沉淀复合物
本研究利用免疫沉淀技术(Immunoprecipitation,IP),以牙鲆胚胎细胞为对象,探索与牙鲆TRβ相互作用的蛋白质。实验设置3个组,第一组:input为牙鲆胚胎细胞总蛋白直接上样,上样量24 μg;第二组:IP为TRβ抗体与牙鲆胚胎细胞总蛋白的免疫沉淀复合物,共沉淀了978 μg蛋白,上样量10 μL;第三组:对照组control为兔IgG与牙鲆胚胎细胞总蛋白的免疫沉淀复合物,沉淀量1 mg,上样量5 μL。以TRβ多克隆抗体检测免疫沉淀复合物中是否存在TRβ蛋白,实验结果显示,在细胞总蛋白和TRβ抗体与牙鲆胚胎细胞总蛋白的免疫沉淀复合物中均检测到大小在43 kDa左右的片段,与TRβ蛋白的大小相符,对照组则没有检测到TRβ蛋白信号,仅检测到2个大小分别在25 kDa和55 kDa左右的片段,推测为用于免疫沉淀的抗体存留在免疫沉淀复合物中所显示的信号,同样在TRβ抗体与牙鲆胚胎细胞总蛋白的免疫沉淀复合物中也检测到这两个条带信号(图2)。Western Blot检测结果表明免疫沉淀实验效果较好,沉淀复合物可用于后续质谱检测分析。
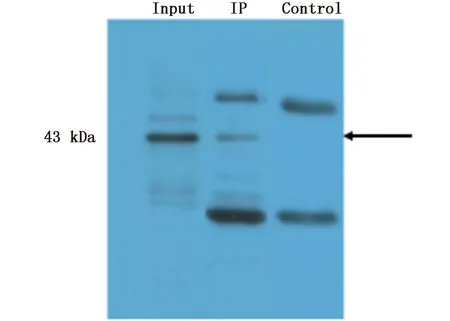
图2 免疫沉淀复合物的Werstern Blot检测Fig.2 Werstern Blot detection of immunoprecipitation complexes注:Input:细胞总蛋白上样;IP:TRβ抗体免疫沉淀复合物;Control:兔IgG抗体免疫沉淀复合物。箭头所指为牙鲆TRβ蛋白信号Note: Input: Cell total protein loading; IP: TRβ antibody immunoprecipitation complex; control: Rabbit IgG immunoprecipitation complex. The arrow shows signal of P. olivaceus TRβ protein
2.2.2 质谱检测IP复合物
将牙鲆TRβ多克隆抗体与胚胎细胞总蛋白的免疫沉淀复合物经SDS-PAGE凝胶电泳,割取含有目的蛋白的胶条(图3),回收蛋白,上机进行LC-MS/MS 90 min质谱鉴定。
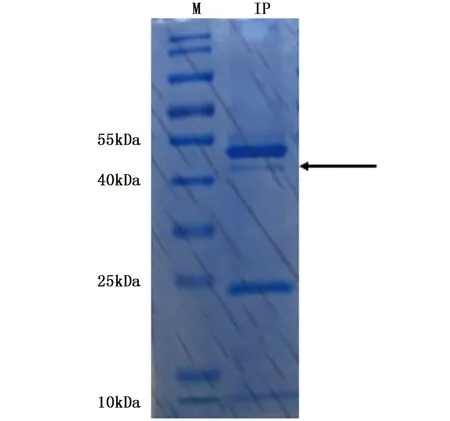
图3 免疫沉淀复合物的SDS-PAGE凝胶电泳考染图Fig. 3 Immunoprecipitation complex SDS-PAGE gel electrophoresis注:M:蛋白质量标准;IP:TRβ抗体免疫沉淀复合物。箭头所指为牙鲆TRβ蛋白信号Note: M: Protein marker; IP: TRβ antibody immunoprecipitation complex. The arrow shows signal of P. olivaceus TRβ protein
质谱鉴定数据经搜索Mascot数据库查询结果显示:本次质谱鉴定的阈值得分是26分(图4),大于26分的蛋白为可信蛋白。本研究从牙鲆TRβ多克隆抗体与胚胎细胞总蛋白的免疫沉淀复合物中共鉴定得到了21个与TRβ蛋白可信度高的相互作用牙鲆蛋白(表2)。
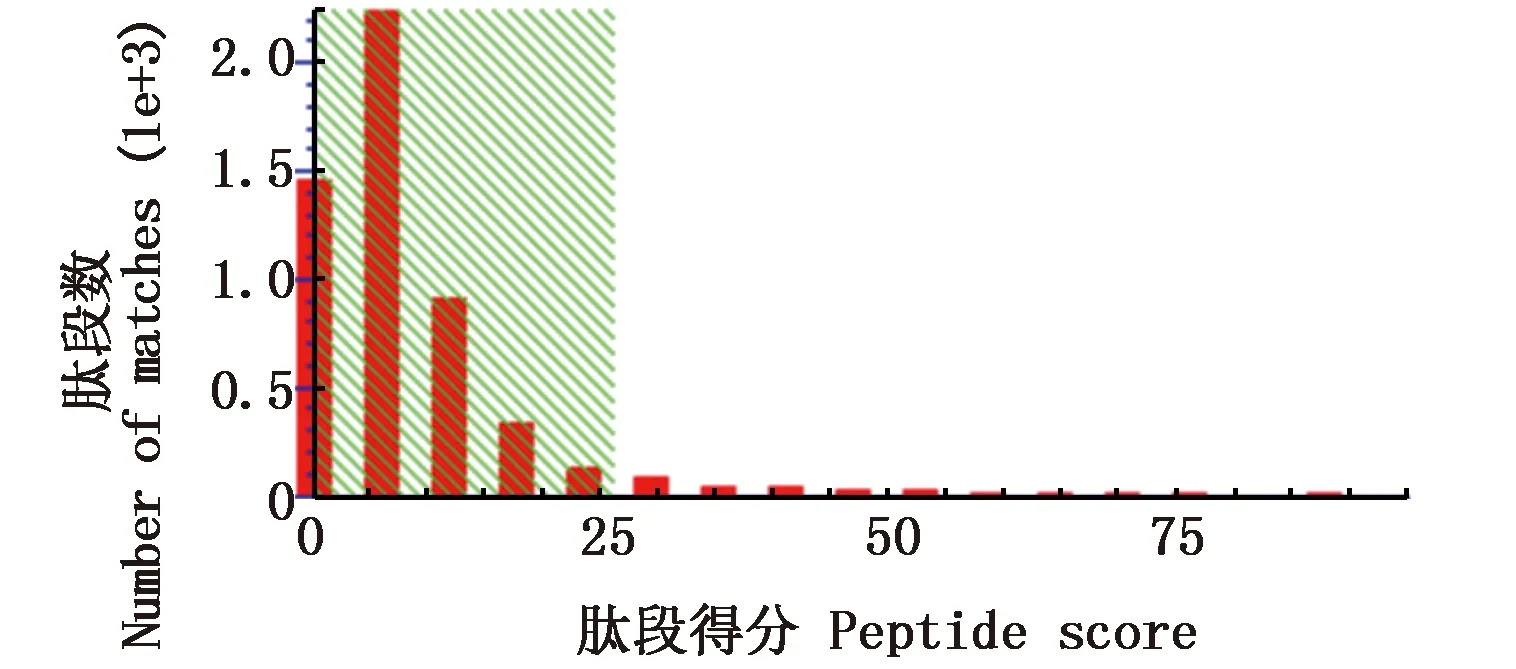
图4 肽段得分分布Fig. 4 Peptide score distribution注:离子得分以-log10(P)表示,其中P为随机事件的概率。个体离子得分大于26表示具有同一性或广泛同源性Note: Ions score is -log10 (P), where P is the probability that the observed match is a random event. Individual ions scores > 26 indicate identity or extensive homology
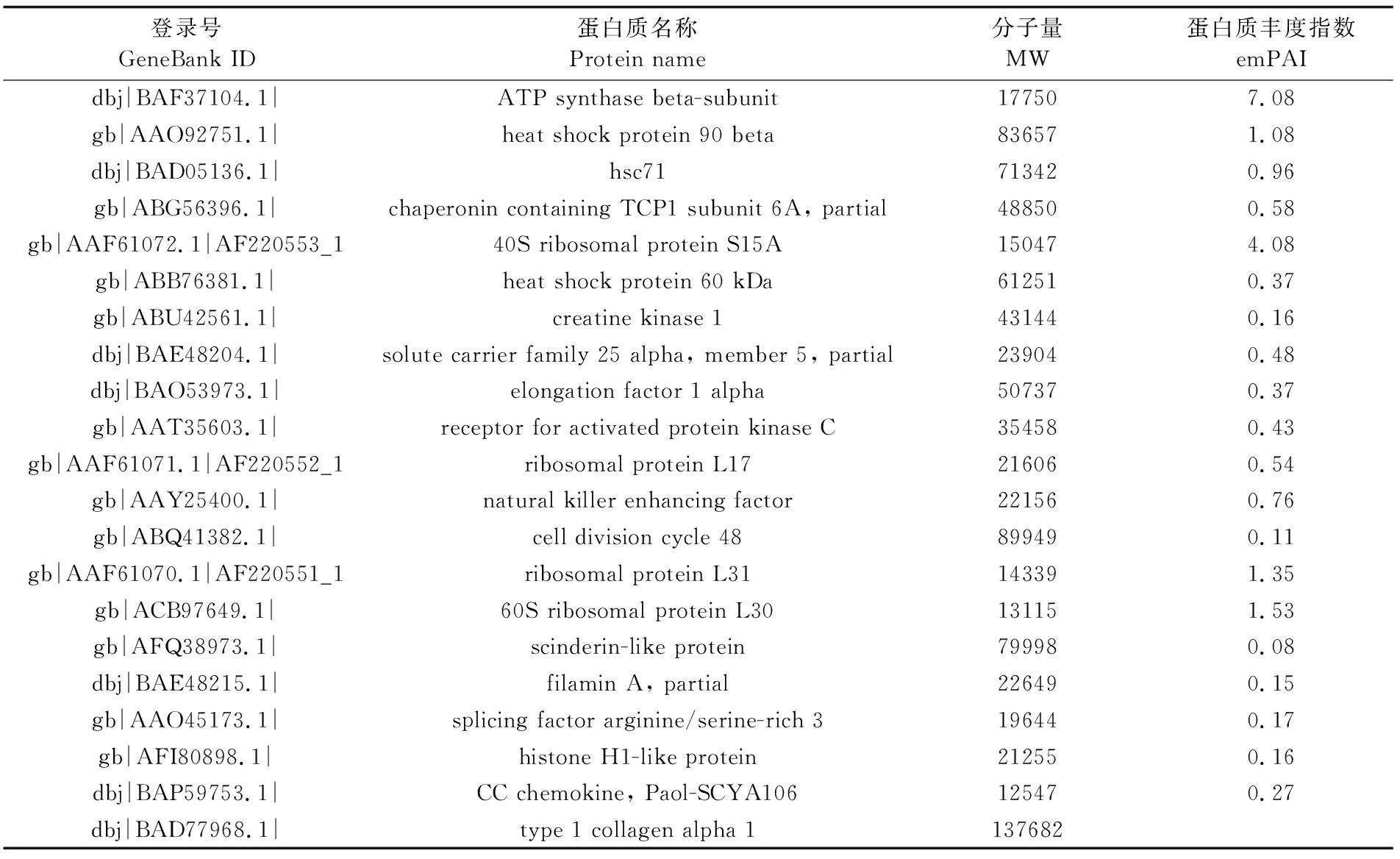
登录号GeneBank ID蛋白质名称Protein name分子量MW蛋白质丰度指数emPAIdbj|BAF37104.1|ATP synthase beta-subunit177507.08gb|AAO92751.1|heat shock protein 90 beta836571.08dbj|BAD05136.1|hsc71713420.96gb|ABG56396.1|chaperonin containing TCP1 subunit 6A, partial488500.58gb|AAF61072.1|AF220553_140S ribosomal protein S15A150474.08gb|ABB76381.1|heat shock protein 60 kDa612510.37gb|ABU42561.1|creatine kinase 1431440.16dbj|BAE48204.1|solute carrier family 25 alpha, member 5, partial239040.48dbj|BAO53973.1|elongation factor 1 alpha507370.37gb|AAT35603.1|receptor for activated protein kinase C354580.43gb|AAF61071.1|AF220552_1ribosomal protein L17216060.54gb|AAY25400.1|natural killer enhancing factor221560.76gb|ABQ41382.1|cell division cycle 48899490.11gb|AAF61070.1|AF220551_1ribosomal protein L31143391.35gb|ACB97649.1|60S ribosomal protein L30131151.53gb|AFQ38973.1|scinderin-like protein799980.08dbj|BAE48215.1|filamin A, partial226490.15gb|AAO45173.1|splicing factor arginine/serine-rich 3196440.17gb|AFI80898.1|histone H1-like protein212550.16dbj|BAP59753.1|CC chemokine, Paol-SCYA106125470.27dbj|BAD77968.1|type 1 collagen alpha 1137682
随后笔者进行了蛋白质GO富集分析,从3个方面对鉴定的蛋白进行了注释:分子功能(GO-MF),细胞组分(GO-CC)和生物过程(GO-BP)。GO-MF分析结果显示,这些可信度较高的作用蛋白主要具有ATP结合、未折叠的蛋白质结合、核糖体的结构组成、激酶活性、跨膜转运蛋白活性、GTP酶活性、翻译延长因子活性、过氧化物氧还原酶活性、水解酶活性、肌动蛋白丝结合、RNA结合、DNA结合、趋化因子活性以及细胞外基质结构组分这些分子功能。其中参与蛋白数量最多的分子功能是ATP结合和核糖体的结构组成。GO-CC细胞内组分分析结果显示,所鉴定的蛋白主要分布在核糖体、细胞质、细胞核、线粒体内膜、染色体以及胞外区域,其中绝大多数的蛋白集中在线粒体和细胞质中。GO-BP分析结果显示,笔者鉴定的这些IP复合物中的蛋白主要参与翻译、蛋白质折叠和重折叠、细胞氧化还原内稳态、细胞分裂、核小体装配、雌激素应答、压力应答以及免疫应答的生物学进程。
同时经KEGG通路分析结果显示,鉴定的蛋白参与核糖体通路、内质网蛋白加工、MAPK信号转导通路、剪接体、粘着斑、氧化磷酸化、内吞作用、RNA降解、氨基酸物质代谢、胆汁分泌、信使RNA监测通路、细胞周期、沙门氏菌感染、单纯疱疹感染以及细胞因子受体相互作用途径中。
2.2.3 结合蛋白在牙鲆变态过程中的表达及其对外源激素刺激的反应
鉴于免疫沉淀实验中蛋白质之间非特异性相互作用以及瞬时相互作用的存在,加之本研究采用了LC-MS/MS上机90min质谱鉴定的高灵敏度,这些都增加了与TRβ非特异性结合蛋白存在的几率。所以笔者选择了可信蛋白中质谱比对结果得分以及相对蛋白质丰度指数最高的7个蛋白作为研究对象,分别为:ATP合酶β亚基(beta-F1-ATPase)、热休克蛋白90β(Hsp90β)、含有TCP1的伴侣蛋白亚基6A(Cct6A)、40S核糖体蛋白S15A(RPS15A)、肌酸激酶1(CK1)、溶质载体家族25α成员5(Slc25a5)和延伸因子1(EF1a)。利用Primer Premier 5.0软件(Premier,Canada)在CDS区内设计定量引物(表1),以18s rRNA为内参基因,在Bio-Rad CFX96 TouchTM Real-Time PCR Detection System上对这7个基因在牙鲆变态早期(21dph)和高峰期(28dph)的对照组(NC)、TH组以及TU组的相对表达量进行检测(图5)。
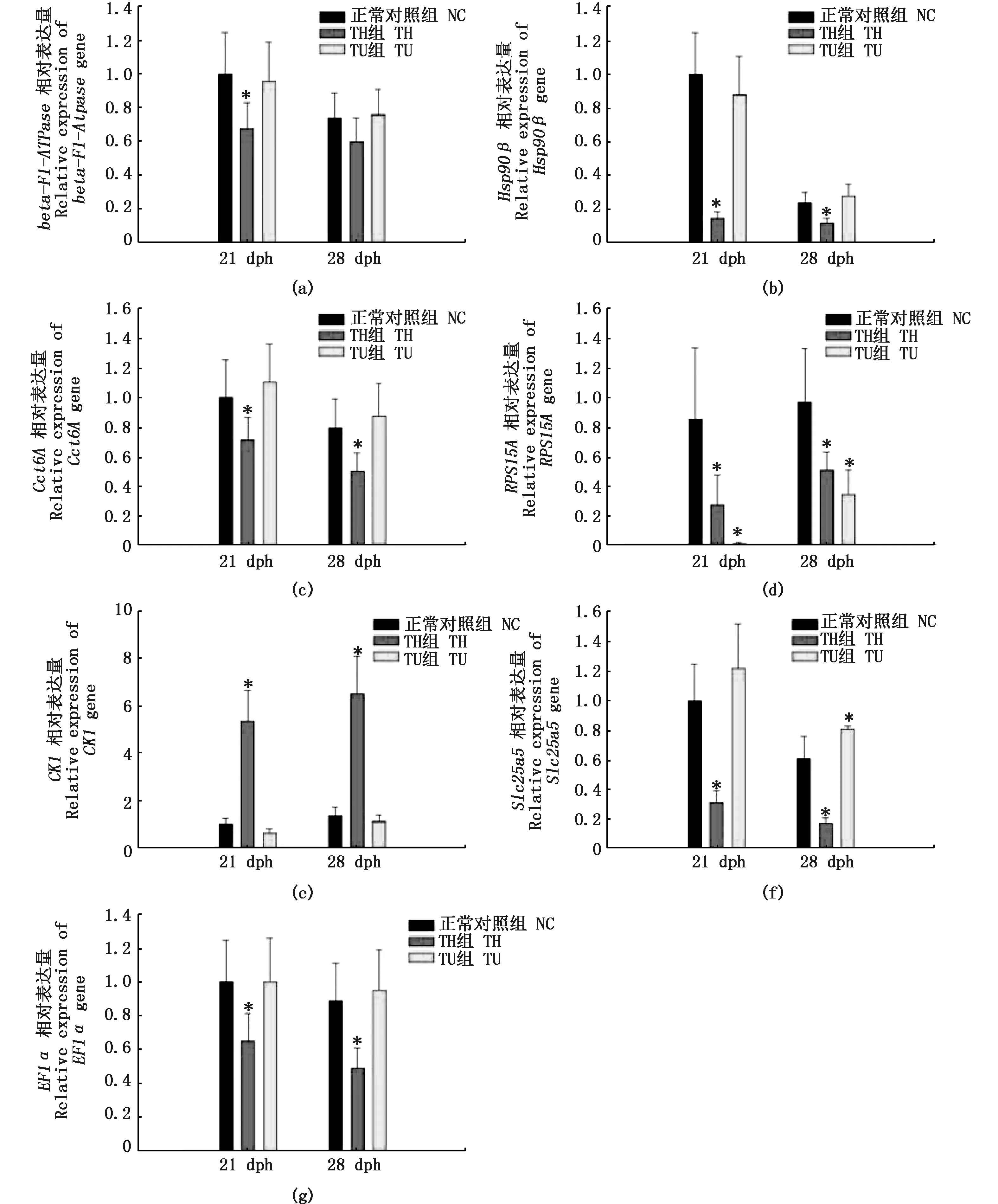
图5 IP可信蛋白mRNA在牙鲆21 dph和28 dph的表达及其对外源TH和TU处理的反应Fig. 5 Expression of IP-identifiable protein mRNA in P. olivaceus 21dph and 28dph and their responses to exogenous TH and TU treatments注:图a~g分别代表beta-F1-ATPase, Hsp90β, Cct6A, RPS15A, CK1, Slc25a5, EF1a的表达。每个mRNA的表达由平均值±标准误差(SE)(N=3)的误差棒显示。带有星号的值与正常对照(NC)的相应值有显著差异(P<0.05)Note: a~g represent the expression of beta-F1-ATPase, Hsp90β, Cct6A, RPS15A, CK1, Slc25a5, EF1a, respectively. The means ± standard error (SE) (N=3) of the expression of each mRNA is shown by error bar. Values with asterisk are significantly different (P<0.05) from the corresponding value for the normal control (NC)
对所选蛋白mRNA进行定量检测分析结果显示,除了RPS15A和CK1,其余蛋白的mRNA丰度在变态高峰期(28 dph)均低于变态早期(21 dph),且beta-F1-ATPase、Hsp90β、Cct6A、Slc25a5和EF1a对外源甲状腺素及硫脲处理具有相似的反应(图5),它们的表达在牙鲆变态早期和高峰期均受外源甲状腺素的显著下调(P<0.05),而硫脲处理对它们的表达基本都没有显著性影响(P>0.05),仅Slc25a5在高峰期受硫脲处理显著下调(图5-f,P<0.05)。而RPS15AmRNA的表达量在甲状腺素和硫脲处理后均显著下降,且在变态早期和高峰期均如此(图5-d,P<0.05)。与其余基因截然不同;CK1在外源甲状腺素处理后其mRNA丰度增长了约5倍,在变态早期和高峰期均如此,差异极显著(P<0.01),而硫脲处理对CK1的表达没有明显影响(图5-g)。
3 讨论
免疫沉淀技术主要包括染色质免疫沉淀技术(chromatin immunoprecipitation,Ch IP)、蛋白质免疫沉淀技术(protein immunoprecipitation,PIP)以及放射免疫沉淀技术(radioimmunoprecipitation,RIP)[11]。本研究中所提及的免疫沉淀(IP)为蛋白质免疫沉淀技术,是以抗体和抗原之间的专一性免疫反应作用为基础,主要用于抗原结合蛋白的定性检测,是研究蛋白质在细胞内完整生理性作用的有效方法[12-14]。本研究为进一步探索牙鲆TRβ的功能,以牙鲆胚胎细胞为实验对象,采用温和裂解的方法,在细胞内自然状态下利用定制的牙鲆TRβ多克隆抗体(rabbit TRβ polyclonal antibody)去捕获细胞内的TRβ蛋白及与之相互作用的蛋白质复合物,再利用蛋白免疫印迹(Western Blot)和LC-MS/MS质谱的方法确定相互作用蛋白,从TRβ多克隆抗体与牙鲆胚胎细胞总蛋白的免疫沉淀复合物中鉴定得到了21个达到本次质谱鉴定阈值得分的可信牙鲆蛋白(表2)。
鉴于本研究免疫沉淀中可能存在的假阳性结果,研究选择了可信蛋白中质谱比对结果得分以及相对蛋白质丰度指数最高的7个蛋白作为进一步研究对象,它们分别为:ATP合酶β亚基(beta-F1-ATPase)、热休克蛋白90β(Hsp90β)、有TCP1的伴侣蛋白亚基6A(Cct6A)、40S核糖体蛋白S15A(RPS15A)、肌酸激酶1(CK1)、溶质载体家族25α成员5(Slc25a5)和延伸因子1(EF1a)。
ATP合酶是位于核糖体内膜上的含有多个亚单位的复合酶分子,在跨膜质子梯度存在的条件下,将ADP转化成ATP,参与氧化磷酸化和光合磷酸化途径,是生物体能量代谢的关键酶。ATP合酶由F0和F1两个亚单位组成,β亚基属于F1亚单位,也是承载ATP合酶催化位点的主要亚基[15-16]。研究证明膜表达的ATP合成酶除了具有合成和水解ATP的活性,还承担很多其它的生物学功能,例如可以影响内皮细胞血管生成、调节血清胆固醇的水平、调节肿瘤细胞胞内酸碱度等[17-18],而β亚基不仅参与催化作用,还可位于生物膜表面参与各种生理功能[19]。Hsp90β、Hsc71和Hsp60均属于热休克蛋白家族同源基因,这是一类在进化过程中高度保守的且在各种生物体中广泛存在的蛋白。在功能上,它们作为分子伴侣,对细胞内正常生理和应激情况下蛋白内稳态的维持起着至关重要作用[20-21]。研究表明,在急性高温和低温胁迫下,鳜(Sinipercachuatsi)体内多种组织中的多种热休克蛋白表达量增加,且与胁迫作用时间呈现正相关[22],表明机体调用热休克蛋白以积极的方式应答并抵御不适温度对自身产生的伤害。Cct6A是分子伴侣蛋白的一种,可在ATP水解释放能量的条件下协助蛋白质的折叠组装。其包含的TCP1亦属于热休克蛋白Hsp60家族,是一种在细胞胞浆中广泛分布的异型寡聚蛋白,也是目前为止在真核细胞胞浆中发现的唯一一个伴侣素蛋白[23-24]。RPS15A是核糖体的结构成分,是蛋白质翻译不可或缺的。研究发现在星形细胞瘤、结直肠癌以及前列腺癌中RPS15A的表达均升高,李光耀等[25]利用RNAi技术观察并分析RPS15A基因对白血病细胞增殖、细胞周期分布及凋亡的影响,发现对白血病细胞的RPS15A基因进行敲降可阻滞其细胞周期,增加细胞凋亡,从而影响白细胞的增殖。CK1(Creatine kinase 1,肌酸激酶1)是组织中调节细胞能量代谢的关键酶,与细胞的能量反馈调节、细胞膜的稳定性、神经功能、有氧耐力、肌肉收缩有关,主要存在于高能耗组织如骨骼肌、脑、心脏等组织的细胞中[26-28]。研究发现甲状腺机能亢进和甲状腺机能衰退会导致总肌酸激酶活力的变化,证明甲状腺素可调节肌酸激酶及其同工酶的总活性[29-30]。Slc25a5是溶质载体蛋白基因SLC大家族中SLC25小家族的一员,是位于线粒体膜上的一类运输分子。线粒体膜由作为各种分子的转运蛋白的蛋白质组成,Slc25a5就是其中一员[31]。SLC25A5(溶质载体家族25,成员5)也被称为ANT2,在增殖细胞中高度表达,研究发现癌细胞中的ANT2诱导与糖酵解代谢和癌发生直接相关,另外ANT2基因的抑制可导致人细胞的生长停滞[32]。延伸因子1-α(EF1a)是真核生物翻译延伸因子(eEF1)的一个亚基,该蛋白在蛋白质生物合成期间促进氨酰基-tRNA与核糖体A位点的GTP依赖性结合,帮助肽链的延伸[33]。研究表明,在压力条件下,细胞可通过调节EF1和EF2等延伸因子的表达来调节总蛋白的合成[34]。另外EF1a除了参与蛋白质的翻译过程外,还具有许多其它的重要功能,如可以充当分子伴侣保护相关蛋白免受环境压力的损害,协助蛋白的修复,参与溶酶体对N端封闭蛋白的降解等[34]。GOULART-SILVA等[35]对INS-1E细胞(胰腺β细胞)施以甲状腺素T3处理后,翻译因子EF1A和胰岛素的表达同时增长。
进一步对编码它们的基因mRNA表达分析结果显示,它们的表达在外源甲状腺素处理后均表现出显著变化,其中beta-F1-ATPase、Hsp90β、Cct6A、RPS15A、Slc25a5和EF1a的表达受外源甲状腺素处理显著下调,CK1截然相反,它的表达受甲状腺素处理显著上调;硫脲的处理对所分析的基因则几乎都没有明显影响(图5)。这些结果间接支持了所分析的可信蛋白与甲状腺素受体β之间的相互联系。本文对牙鲆甲状腺素受体β结合蛋白的研究还停留在描述性阶段,它们与TRβ的准确关系和具体功能仍然需要进行下一步的更深研究。尽管如此,本文的研究结果将有助于牙鲆甲状腺素受体结合蛋白与牙鲆变态关系的研究。

