高效液相色谱-串联质谱法测定毛发中40种常见精神药物
徐代化,欧 军,陈深树,徐期林,焦台风,程良红,陈垚翰
(1.广东南天司法鉴定所,广东 深圳 518003; 2. 深圳黑尔格科技有限公司,广东 深圳 518109)
近年来毛发中精神药物的检测领域引起了世界各国科学家越来越多的关注[1]. 毛发的检测被广泛应用于人类行为毒理学、犯罪刑侦与毒品成瘾、药物滥用与慢性中毒的诊断、死后毒理学、性犯罪、治疗合规控制等领域[2].
高效高通量的毛发中精神药物检测技术的研究以及用药频度和用药史与毛发中精神药物含量的相关性研究近年来研究较为关注. 数篇综述论文总结了毛发中精神药品检测方法、毛发样品的清洗和提取方法[3]、仪器检测方法[4-6]和毛发检测应用[7]等.
2014年台湾中山医科大学的Chang[8-9]等开发了一种基于液相色谱-串联质谱(LC-MS/MS)的高通量检测方法, 可以同时检测冰毒(MA)、苯丙胺(AMP)、3,4-亚甲基二氧甲基苯丙胺(MDMA)、3,4-亚甲基二氧苯丙胺(MDA)及氯胺酮,检出限在0.5~5.0 pg/mg之间.
2015年韩国成均馆大学Lee[10]发展了一种基于LC-MS/MS的毛发中具有高风险滥用勃起功能障碍药物的检测方法,可以检测包括米罗那非、西地那非、他达拉非、乌地那非和伐地那非以及对应代谢物,并用于监控该类药物的滥用. 另一种基于LC-MS/MS高效液相检测毛发样本中常见毒品的方法被报道,该方法可以同时检测15种常见毒品[11]. 香港科技大学Zhu[12]报道了使用基于纳米微流控芯片与LC-MS/MS联用技术同时检测8种常见毒品及其代谢物的方法,该方法能高效快速地检测出毛发中的目标化合物.
尽管毛发中精神药物的测定方法研究取得了一定进展,但是目前的方法都只能同时检测少数常见几类精神药物,这无法满足吸毒成瘾认定和戒毒监管中精准高效的检测需求. 本文旨在开发一种具有普遍适用性的毛发中精神药物的检测方法,通过高效液相色谱-串联质谱(HPLC-MS/MS)进行检测,能够对毛发中40种常见精神药物进行定性和定量测定.
1 试验部分
1.1 仪器与试剂
仪器: Agilent 1290-6470 Triple Quad 高效液相-串联三重四极杆质谱联用仪(美国Agilent公司),Cenece@ TDZ5-WS离心机(湖南赛特湘仪离心机仪器有限公司),Vortex kylin-bell@5旋涡混合仪(美国),国华SHA-C恒温振荡器,KQ-250DE超声波清洗器(昆山市超声仪器有限公司).
试剂:(-)-Δ9-四氢大麻酚、1R-2S-(-)-盐酸麻黄碱、2-羟基乙基氟西泮、6-乙酰吗啡、7-氨基氯硝西泮、7-氨基氟硝西泮、7-氨基硝西泮、α-羟基阿普唑仑、α-羟基咪达唑仑、α-羟基三唑仑、阿普唑仑、苯丙胺、苯甲酰爱康宁、溴安定、氯硝西泮、可卡因、可待因、脱烃基氟胺安定、地西泮、2-亚乙基-1,5-二甲基-3,3-二苯基吡咯烷、艾司唑仑、氟硝西泮、氟西泮、海洛因、劳拉西泮、3, 4-亚甲基二氧基苯丙胺、3, 4-亚甲基二氧基乙基苯丙胺、3, 4-亚甲基二氧基甲基苯丙胺、美沙酮、甲基苯丙胺、咪达唑仑、吗啡、硝甲西泮、硝西泮、去甲基地西泮、奥沙西泮、替马西泮、三唑仑、唑吡坦、佐匹克隆标准品(质量浓度均为1.0 mg/mL)均购买自美国Cerilliant标准品公司;乙腈、甲醇和正己烷为色谱级,购自德国Merck公司; 乙酸铵、甲酸为质谱级试剂,购买自百灵威试剂公司. 试验用水均来自Milli-Q纯水系统,购买自法国Millipore公司.
标准贮备液(1.0 μg/mL): 分别准确量取适量40种精神药物标准品于10 mL容量瓶中, 用少量甲醇溶解后, 并用甲醇定容至刻度,逐级稀释配置成 1.0 μg/mL标准贮备液.
吸毒人员样本来源于深圳宝安戒毒所,本项目获得由深圳市生物医学伦理审查委员会批准的审查批件(深圳伦审[2018]第(001)号),使用人体生物样本开展研究. 本文涉及五位受试者提供的毛发样本,编号为SZNTMF0001-0005.
1.2 试验方法
1.2.1 色谱条件
色谱柱:Capcell Pak C18(250 mm×2.0 mm,MGII 5 μm),柱温:30 ℃, 流速:0.2 μL/min;以含有20 mmol/L乙酸铵和0.1%甲酸缓冲液的纯化水为流动相A, 以色谱纯乙腈为流动相B, 按照表1进行梯度洗脱.

表1 梯度洗脱程序Table 1 Gradient elution program
1.2.2 质谱条件
离子源为电喷雾电离-正离子模式,检测方式为动态多反应模式检测(DMRM)或多反应模式(MRM)检测;参数设置:喷嘴电压:500 V;毛细管电压:3 500 V;干燥气温度:300 ℃;干燥气流速:5 L/min;鞘气温度:250 ℃;鞘气流速:11 L/min;经过对毛细管出口去族电压(DP)、碰撞池能量(CE)等质谱参数的优化,最终确定各精神药物的动态多反应模式检测参数如表2所列.
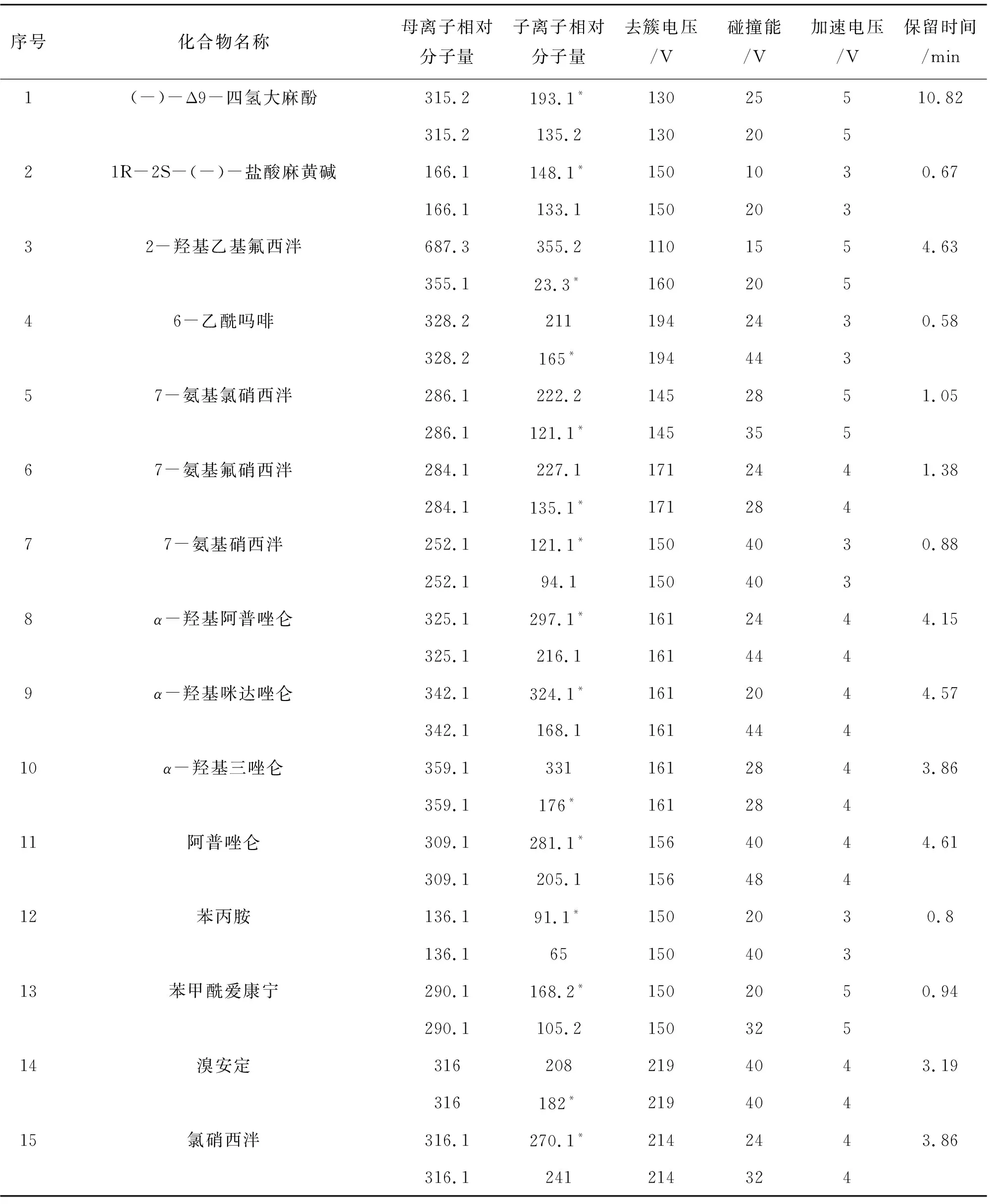
表2 40种精神药物的动态多反应模式检测参数Table 2 Optimized MRM parameters for 40 drugs
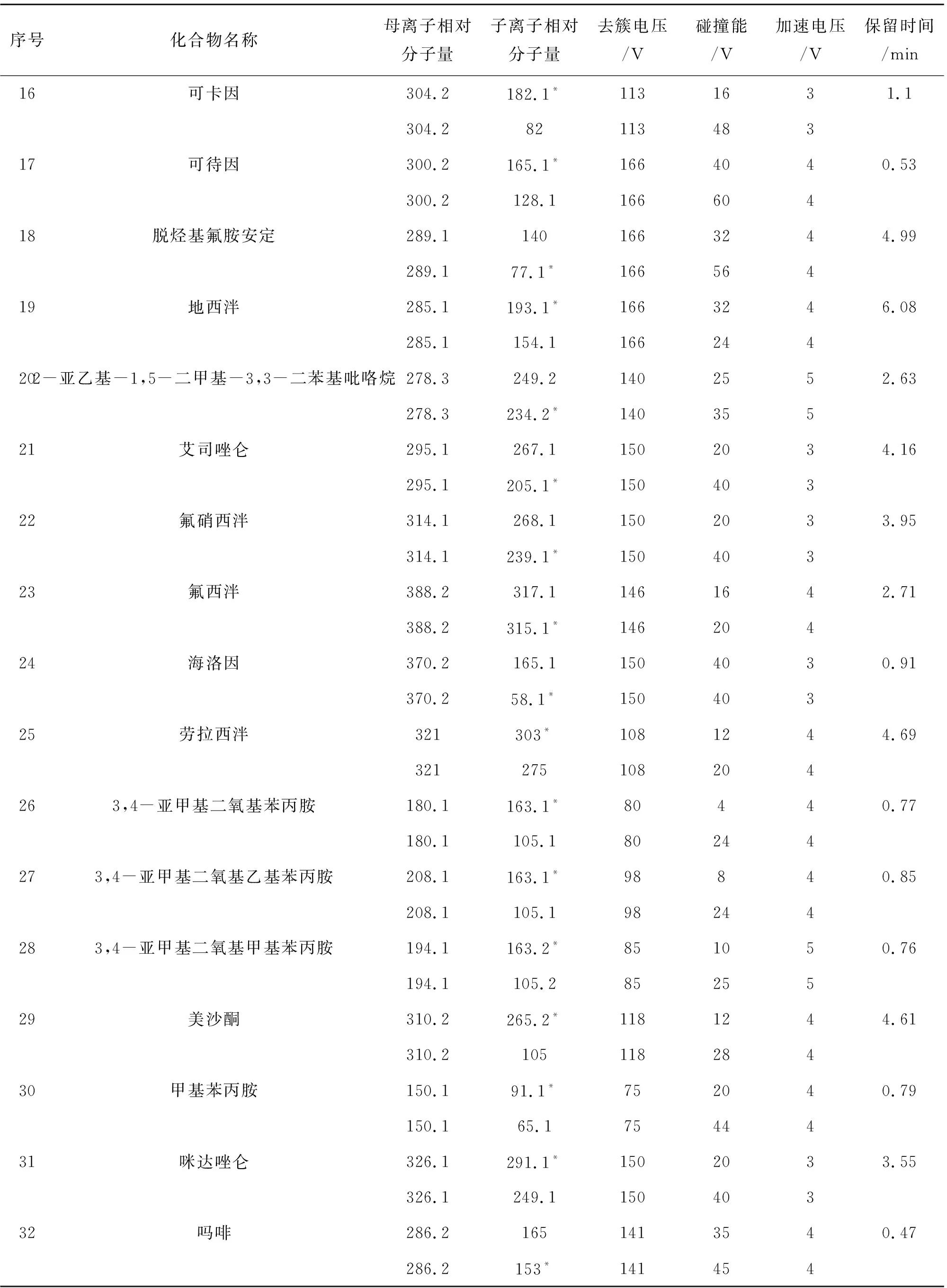
续表2

续表2
*:定量离子
1.2.3 样品前处理方法
使用去离子水对毛发样本进行粗洗涤,再使用丙酮对经过粗洗涤的毛发样本进行精洗涤,毛发晾干后使用冷冻研磨机磨碎. 将20 mg磨碎后的毛发样本加至1 mL甲醇中70 ℃超声提取2 h,在2 000~2 800 r/min转速下离心5 min,吸取上清液在70 ℃氮气挥干,再加入100L甲醇复溶,上机检测.
空白毛发样本经过前处理后,使用上述色谱和质谱条件进行检测,以各种精神药物均为未检出进行空白确认,用于后续标准曲线的建立以及方法精密度和回收率试验. 具体步骤为:将20 mg空白毛发样本按照上述步骤洗涤,晾干后,剪碎,按照标准曲线配置要求和空白加标试验要求添加相应含量的精神药物标准品,并按照上述步骤超声提取,挥干,复溶,上机检测.
1.2.4 方法学验证
分别对线性范围、灵敏度、准确度和回收率进行了考察,同时以3个标准质量浓度水平(低:10 ng/g,中:50 ng/g,高:200 ng/g)用于准确度和回收率试验.
线性范围分别使用5个校准点质量浓度(9、40、90、450、770 ng/g)进行曲线拟合,考察相关系数. 灵敏度通过方法检出限(LOD)和方法定量限(LOQ)进行评估,制备了一系列递减浓度的添加毛发样本,经过方法前处理后上机测定其信噪比,以确定方法检出限和方法定量限. LOD被确定为信噪比(S/N)接近于3的浓度,LOQ被确定为信噪比(S/N)接近于10的浓度. 准确度是通过分别得到低、中、高浓度的6次平行测定的结果,并计算其RSD进行评估. 回收率试验是通过考察加标毛发样本的低、中、高浓度的检测浓度与实际添加浓度的百分比所得到.
2 结果与讨论
2.1 仪器条件优化
C18反向柱是广泛使用的分离色谱柱,目标方法涉及的毒药品种类繁多,为了保持方法的适用性,我们选择了Capcell Pak C18(250 mm×2.0 mm,MGII 5 μm). 该柱被广泛应用在食品、化妆品和药品的有关成分检测中. 为了保证检测的灵密度,必须使用梯度洗脱的方法将各个待测物质尽量分开,同时考虑检测效率,将检测时间控制在15 min内. 通过方法优化,我们最终选择了1.2.1中所述方法,得到的40种毒药物的DMRM色谱图如图1所示.

图1 40种毒药物的DMRM色谱图Fig. 1 DMRM spectrum of 40 drugs
2.2 样品前处理优化
样品前处理包括毛发样品的清洗处理和毛发样本的提取处理[3]. 清洗的目的是除去毛发表面的污染物质,防止其对检测结果的干扰,目前文献采取的主要方法为水洗与丙酮洗涤相结合的方法. 毛发样本提取处理方法较多,根据分析目标物的性质可采用无机酸溶液提取方法,例如1%的磷酸溶液、盐酸溶液提取,无机碱溶液提取(例如5%氢氧化钠溶液消解提取),有机溶剂提取(例如甲醇、乙腈、乙酸乙酯等溶剂提取),混合溶剂提取(例如将无机酸溶液和有机溶剂按照比例混合提取). 以上方法的局限性在于采用的浸泡提取方法所需时间长(18~24 h). 我们发现使用甲醇为溶剂超声提取可以在短时间内完成提取,回收率满足要求. 通过试验考察了超声提取时间和提取温度参数的影响,最终优化的参数见1.2.3.
2.3 方法标准曲线和检出限
线性范围的考察是通过选取5个校准点质量浓度(分别为9、40、90、450、770 ng/g),每个校准点平行测定6次取平均值进行曲线拟合,并得到相关系数. 灵敏度通过方法检出限(LOD)和方法定量限(LOQ)进行评估. 具体方法为将添加了一系列递减浓度的精神药物标准品的毛发样本经过前处理后上机检测,使用信噪比(S/N)接近3时的浓度确定为方法检出限(LOD),使用信噪比(S/N)接近10时的浓度确定为方法定量限(LOQ),试验确定相应浓度后平行测定6次取平均值. 结果显示该方法对于40种常见精神药物的回收率为77.3%~94.3%,在线性范围(9~770 ng/g)内相关系数大于0.942, 方法检出限为0.01~0.8 ng/g,所得数据如表3所列.
2.4 方法精密度和回收率
回收率是分别考察3个加标毛发样本(质量浓度为10、50、200 ng/g)的检测(n=6)与实际质量浓度的百分比, 准确度通过分别计算以上低、中、高浓度的6次测定结果的RSD进行评估,结果显示各个待检目标化合物在低、中、高浓度的回收率均高于75%,RSD均在5%以内,具体数据如表4所列.
2.5 案例应用
通过以上建立的方法,对吸毒人员的毛发样品(SZNTMF0001-0005)进行检测, 以确定其可能吸食毒品的种类.
2.5.1 案例1(SZNTMF0001)
将20 mg毛发样本按照前处理方法处理,提取液上机检测,检出吗啡12 ng/g、6-单乙酰吗啡8 ng/g、可待因10 ng/g、甲基苯丙胺46 ng/g、苯丙胺10 ng/g,DMRM色谱图如图2所示.

表3 方法的线性范围、方法检出限(LOD)和方法定量限(LOQ)Table 3 Linearity, limit of detection and limit of quantification

表4 方法精密度和回收率Table 4 Precision and recovery of method

续表4
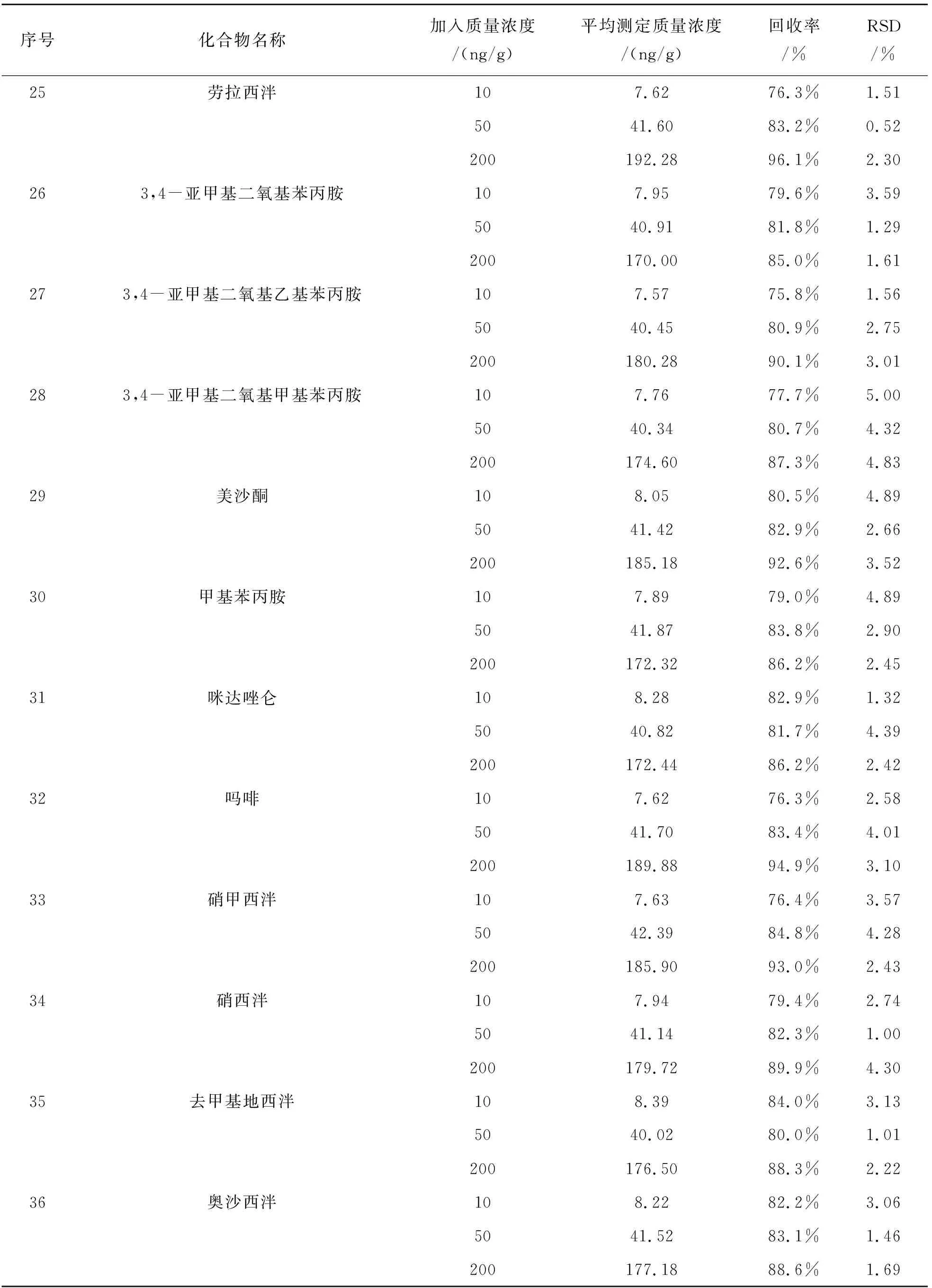
续表4

续表4
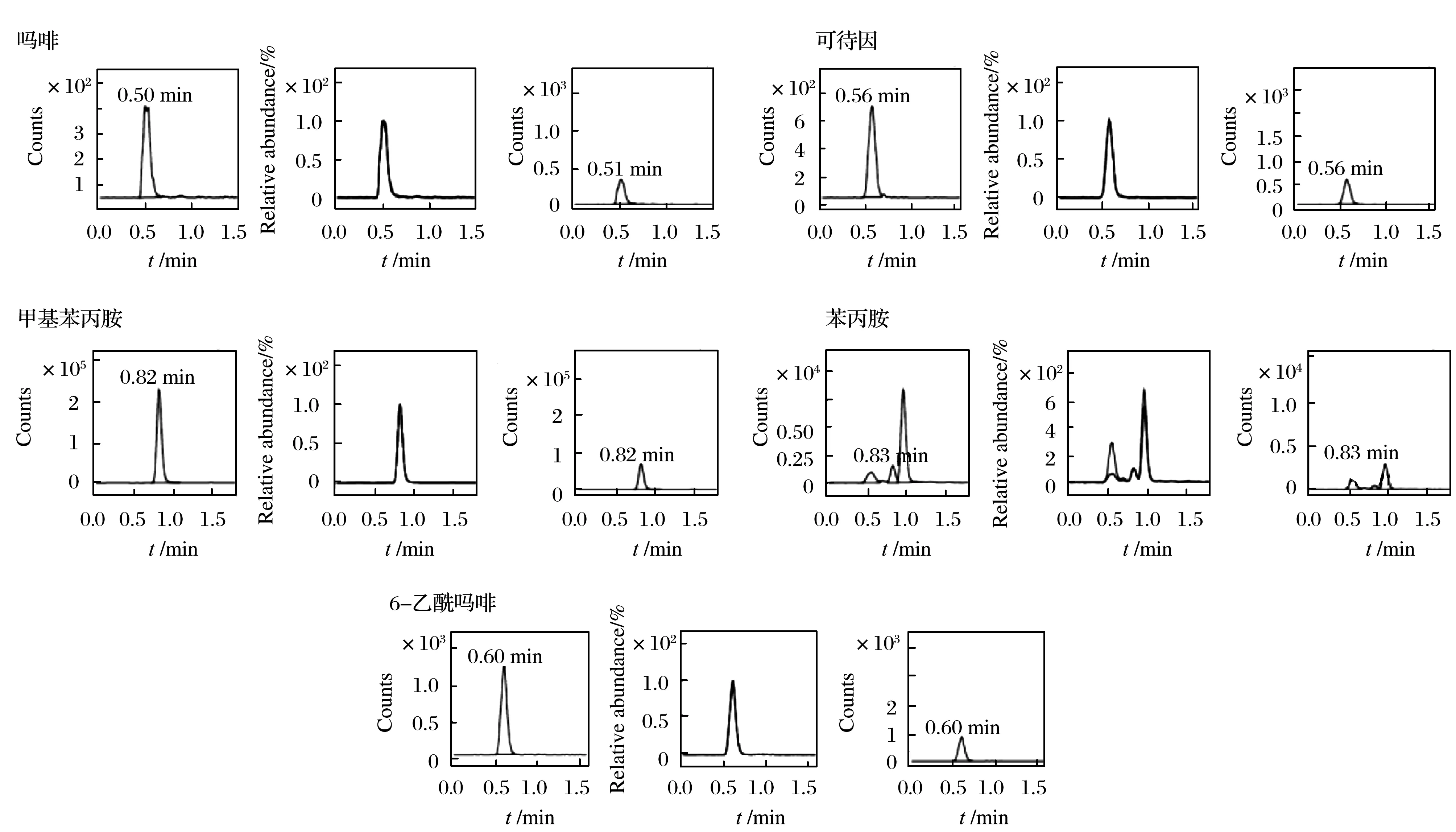
图2 案例1 DMRM图谱Fig. 2 DMRM spectra of case 1
2.5.2 案例2(SZNTMF0002)
将20 mg毛发样本按照前处理方法处理,提取液上机检测,检出甲基苯丙胺49 ng/g、苯丙胺10 ng/g,DMRM色谱图如图3所示.
2.5.3 案例3(SZNTMF0003)
将20 mg毛发样本按照前处理方法处理,提取液上机检测,检出吗啡64 ng/g、6-单乙酰吗啡14 ng/g、可待因13 ng/g,DMRM色谱图如图4所示.

图3 案例2 DMRM图谱Fig. 3 DMRM spectra of case 2

图4 案例3 DMRM图谱Fig. 4 DMRM spectra of case 3
2.5.4 案例4(SZNTMF0004)
将20 mg毛发样本按照前处理方法处理,提取液上机检测,检出吗啡51 ng/g、6-单乙酰吗啡16 ng/g、可待因15 ng/g、海洛因11 ng/g,DMRM色谱图如图5所示.
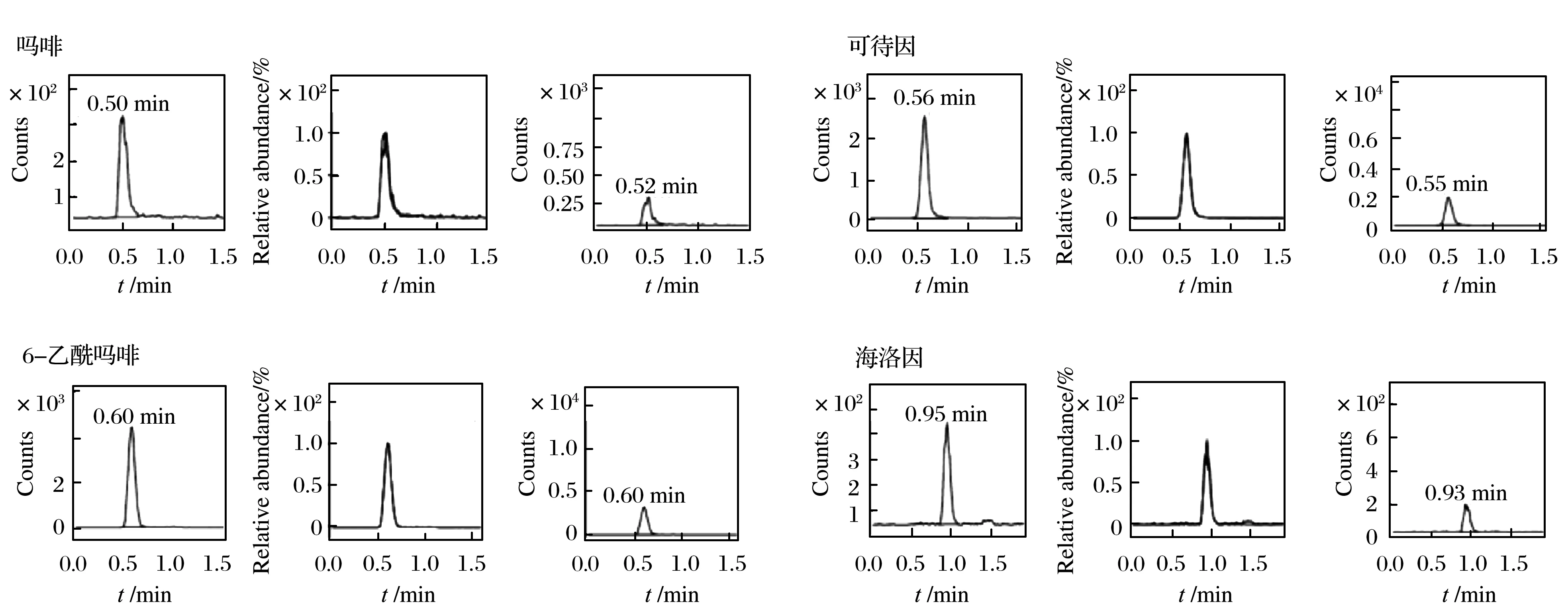
图5 案例4 DMRM图谱Fig. 5 DMRM spectra of case 4
2.5.5 案例5(SZNTMF0005)
将20 mg毛发样本按照前处理方法处理,提取液上机检测,检出吗啡84 ng/g、6-单乙酰吗啡5.6 ng/g、可待因19 ng/g、海洛因13 ng/g、美沙酮16.8 ng/g,DMRM色谱图如图6所示.
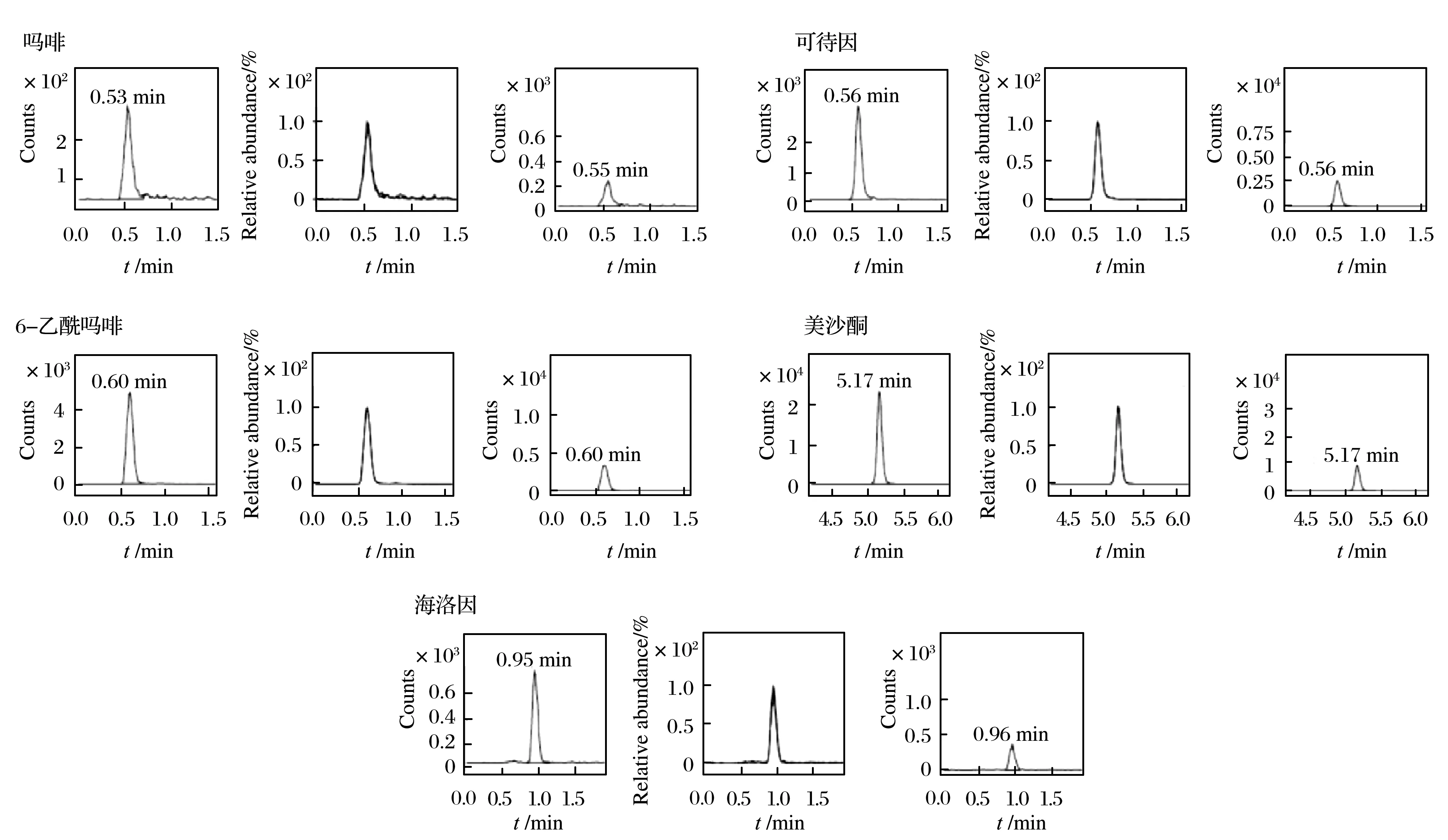
图6 案例5 DMRM图谱Fig. 6 DMRM spectra of case 5
3 结论
本文建立了一种使用高效液相色谱-串联质谱仪对毛发中40种常见精神药物进行定性和定量的检测方法. 本方法检测时间短,灵敏度高,可用于人体毛发样本中精神药物的快速检测, 为公安民警办案提供了有力的技术支持.

