人源抗ICAM-1单链抗体的制备及其生物学活性鉴定
陈云雨,孙红,刘刚,胡华波,张国利,刘晓平,岳玉环
人源抗ICAM-1单链抗体的制备及其生物学活性鉴定
陈云雨1,2,孙红2,3,刘刚1,胡华波1,张国利2,刘晓平1,岳玉环2
1 皖南医学院 药学院 新药筛选与评价中心,安徽 芜湖 241002 2 军事医学研究院 军事兽医研究所,吉林 长春 130122 3 黑龙江生物科技职业学院 生物制药系,黑龙江 哈尔滨 150025

陈云雨, 孙红, 刘刚, 等. 人源抗ICAM-1单链抗体的制备及其生物学活性鉴定. 生物工程学报, 2018, 34(12): 2016–2024.Chen YY, Sun H, Liu G, et al. Preparation and identification of anti-human ICAM-1 scFv. Chin J Biotech, 2018, 34(12): 2016–2024.
利用噬菌体展示技术筛选特异性人源抗ICAM-1单链抗体(Anti-human ICAM-1 scFv)并进行生物学活性鉴定。应用Tomlinson I+J噬菌体抗体库,以P1抗原肽为包被抗原,经过4轮“吸附-洗脱-扩增”进行亲和富集筛选。以PCR反应、ELISA抗原交叉反应和Dot blotting实验进行阳性克隆的鉴定。scFv经原核表达和分离纯化后,以Western blotting实验、竞争ELISA实验和细胞黏附抑制实验对其生物学活性进行初步鉴定。Tomlinson I+J噬菌体抗体库经4轮亲和富集筛选,利用ELISA方法成功筛出4株阳性克隆。通过PCR鉴定反应、ELISA抗原交叉反应和Dot blotting实验,最终获得了1株既能与P1抗原肽特异结合又能与人ICAM-1抗原特异结合的阳性克隆J-A1。对scFv进行原核表达和亲和层析后获得了高纯度的目的蛋白。竞争ELISA实验和细胞黏附抑制实验证实纯化的scFv具有良好的亲和活性和抗细胞黏附活性。文中成功利用噬菌体展示技术筛选到特异性人源抗ICAM-1 scFv,为进一步探索该抗体在炎症相关性疾病治疗中的应用奠定了基础。
噬菌体展示技术,细胞间黏附分子,ICAM-1,单链抗体,人源化抗体
细胞间黏附分子-1 (Intercellular adhesion molecule-1,ICAM-1) 广泛表达于多种细胞表面,属于免疫球蛋白超家族成员,是由膜外区、跨膜区和胞浆区组成的跨膜糖蛋白。在细胞生理状态时,ICAM-1处于低水平表达;当细胞受到致炎因子刺激后,ICAM-1表达量明显增加。通过与淋巴细胞功能性相关抗原(Lymphocyte functional antigen-1,LFA-1) 结合,介导粒细胞、淋巴细胞与血管内皮细胞的黏附,促进白细胞游走和趋化于炎症病灶,加重病理损伤,在炎症性疾病的发生与发展中发挥重要作用,已经成为炎症相关性疾病治疗的新靶标[1-4]。利用重组抗体封闭ICAM-1生物学功能,减轻并改善病理性炎症损伤已经成为抗炎治疗的重要策略。目前,应用抗ICAM-1单克隆抗体疗法对移植排斥反应、自身免疫性疾病、多发性骨髓瘤、糖尿病肾病、溃疡性结肠炎等多种疾病的治疗已经取得了较好的疗效[5-7]。
与传统的嵌合抗体相比,单链抗体(Single chain fragment variable,scFv) 不仅保持亲本抗体的特异性、载体性和靶向性特点,还具有分子量小、免疫原性低、组织穿透力强和易于改造等诸多优点,已经成为重组抗体领域的研究热点[8-9]。郝文波等利用抗ICAM-1单克隆抗体对噬菌体十二肽库进行筛选,证实保守序列P1短肽(KLYLIAEGSVAA) 同样具有天然ICAM-1的生物学功能[10]。本研究将P1短肽作为抗原,利用Tomlinson I+J噬菌体抗体库,经4轮“吸附-洗脱-扩增”亲和富集筛选人源抗ICAM-1 scFv,经分离纯化后,对其生物学活性进行初步研究。
1 材料与方法
1.1 材料
小鼠抗ICAM-1单克隆抗体(Monoclonal antibody,McAb) 2C5由本实验室制备;P1抗原肽(KLYLIAEGSVAA)由上海强耀生物科技有限公司合成;Tomlinson I+J噬菌体抗体库、辅助噬菌体KM13、TG1和HB2151由中国科学院过程工程研究所刘瑞田教授惠赠;c-Myc(9E10)-HRP购自Santa Cruz公司;脂多糖(Lipopolysaccharide,LPS)、胰酶、四甲基联苯胺溶液(3,3ʹ,5,5ʹ-Tetramethylbenzidine,TMB) 和二氨基联苯胺溶液(3,3ʹ-Diaminobenzidine,DAB) 购自Sigma-Aldrich;2×Easy®酶、DNA标准分子量购自TransGen公司;二辛可宁酸(Bicinchoninic acid,BCA) 蛋白浓度测定试剂盒购自Thermo公司;HisTrap亲和层析柱购自GE公司;人ICAM-1抗原购自R/D公司;其他试剂为国产分析纯。
1.2 方法
1.2.1 抗ICAM-1 scFv的亲和富集筛选
将P1抗原肽(1 μg/孔) 包被96孔酶标板,使用Tomlinson I+J噬菌体抗体库(I库库容1.47×108;J库库容1.35×108;scFv产物含有c-Myc和His标签),在96孔酶标板中实施4轮“吸附-洗脱-扩增”亲和富集筛选过程。进行第1轮筛选时,以含0.1% Tween-20的磷酸盐(Phosphate buffered solution,PBS) 缓冲液(PBST) 洗板10次,第2轮及其以后的筛选中分别洗板20次,充分洗去非特异性吸附的噬菌体。洗涤后以胰酶室温消化30 min,洗脱噬菌体。经过“吸附-洗脱-扩增”过程将每轮筛选所收集的噬菌体置于下一轮筛选条件中,从而使阳性噬菌体得到富集并计算每轮筛选的富集倍数。
1.2.2 阳性克隆的ELISA检测
将第4轮亲和富集筛选的阳性噬菌体感染HB2151后,从所涂布的TYE平板上随机挑取单克隆菌落接种到96孔细胞培养板(含 100 μg/mL Amp和1%葡萄糖的2×TY培养基)培养过夜。次日从该板上转接2 μL菌液至第二块96孔细胞培养板(含100 μg/mL Amp和0.1%葡萄糖的2×TY培养基),37 ℃培养至600约为0.9时加入1 mmol/L IPTG诱导,30 ℃培养过夜。次日离心取上清进行阳性克隆菌株的ELISA检测。
在ELISA检测中,以P1抗原肽(1 μg/孔) 包被96孔酶标板,以包被1 μg牛血清白蛋白(Bull serum albumin,BSA) 作为阴性对照。酶标板经2%脱脂奶粉(Skim milk) 封闭后,每孔加入50 μL诱导上清,室温孵育1 h。PBST洗涤3次后,每孔加入1∶500稀释的c-Myc(9E10)-HRP抗体,室温孵育1 h。再以PBST洗板3次后,每孔加入TMB底物溶液避光显色,然后加入2 mol/L H2SO4终止反应,酶标仪测定450值。每份样品做双孔测定,取平均值。阳性克隆菌株确定标准:值为阴性对照值3倍以上。
1.2.3 PCR鉴定阳性克隆
按照pIT-2载体基因序列,合成两条引物扩增基因片段。P1:5ʹ-CAGGAAACAGCTATGA C-3ʹ;P2:5ʹ-CTATGCGGCCCCATTCA-3ʹ。
PCR反应体系如下:引物P1 (10 μmol/L) 和P2 (10 μmol/L) 各0.5 μL,阳性克隆菌液1 μL,2×Easy®10 μL,再用无菌蒸馏水补足体积至20 μL。
PCR扩增条件:94 ℃预变性5 min;94 ℃ 30 s、54 ℃ 30 s、72 ℃ 60 s,30个循环;72 ℃延伸10 min。PCR反应结束后,用1%琼脂糖凝胶电泳检测PCR扩增结果。
1.2.4 阳性克隆的ELISA抗原交叉反应实验
分别以P1抗原肽(1 μg/孔)、3%牛血清白蛋白(BSA) 和2%脱脂奶粉(Milk) 包被96孔酶标板,4 ℃过夜。次日,每孔分别加入PCR鉴定含有完整基因片段的阳性克隆诱导的上清进行ELISA抗原交叉反应实验,实验步骤如1.2.2所述。
1.2.5 Dot blotting实验鉴定阳性克隆
将硝酸纤维素膜置于平皿中,以1 μL人ICAM-1抗原(1.0 mg/mL) 在硝酸纤维素膜中央点样。经2%脱脂奶粉封闭后,加入500 μL 经抗原交叉反应实验鉴定的阳性克隆诱导的上清,以牛血清白蛋白(BSA) 为阴性对照,37 ℃孵育 2 h。PBST洗涤3次后,每孔加入1∶500稀释的c-Myc(9E10)-HRP抗体,37 ℃孵育1 h。再以PBST洗涤3次,以DAB溶液显色。
1.2.6 抗ICAM-1 scFv的分离纯化与Western blotting鉴定
将J-A1工程菌接种于500 mL 2×TY培养基(含100 μg/mL Amp+0.1%葡萄糖) 中进行scFv的诱导表达(1.0 mmol/L IPTG,30 ℃诱导16 h)。离心收集上清,以40%饱和硫酸铵沉淀目的蛋白,用20 mL平衡液(25 mmol/L Tris,0.5 mol/L NaCl,pH 7.5) 稀释后,制备粗提液。将HisTrap亲和层析柱以平衡液进行平衡后。以0.5 mL/min上样,再以平衡液洗脱流穿峰至基线。最后以洗脱液(25 mmol/L Tris,0.5 mol/L NaCl,200 mmol/L 咪唑,pH 7.5) 进行梯度洗脱并收集目的蛋白峰。纯化的目的蛋白以10% SDS-PAGE进行分析,将其透析过夜后,以BCA蛋白浓度测定试剂盒进行定量。
将含人ICAM-1抗原的SDS-PAGE胶进行转膜,进行Western blotting检测。一抗为1∶200稀释的纯化scFv,二抗为1∶500稀释的c-Myc(9E10)- HRP抗体,用增强型HRP (Horseradish peroxidase) 底物化学发光液显影成像。
1.2.7 抗ICAM-1 scFv的生物学活性鉴定
1) 竞争ELISA实验
将P1抗原肽(1 μg/孔) 包被96孔酶标板,以牛血清白蛋白(BSA) 封闭酶标板。将0.1 mg/mL McAb 2C5与倍比稀释的scFv混合后,100 µL/孔依次加入酶标板,37 ℃孵育1 h。PBST洗板3次后,加入HRP标记的羊抗小鼠IgG,37 ℃孵育 1 h。以TMB底物溶液避光显色,2 mol/L H2SO4终止反应,酶标仪检测450值。
2) 人血管内皮细胞-单核细胞黏附抑制实验[11-12]
将以LPS刺激后的人血管内皮细胞ECV304用Hank’s液洗涤2次后,前两组加入抗ICAM-1 scFv (2 μg、5 μg),后两组加入McAb (2 μg、5 μg),每组设置8孔,以加入PBS孔作为对照组,37 ℃培养60 min。每孔加入单核细胞悬液100 μL (约1×105/孔),37 ℃孵育60 min,用预温培养基轻轻洗去未黏附单核细胞。充分洗涤后,每孔加入 100 μL 0.25% Rose Bengal溶液,室温静止5 min。弃除染料后,以PBS洗涤2次,每孔再加入PBS-乙醇(/=1∶1) 200 μL,室温静置30 min,酶标仪检测570值。
黏附率(%)=(ECV304细胞黏附单核细胞值–ECV304细胞值)/总单核细胞值×100%。
1.2.8 统计学分析
2 结果与分析
2.1 抗ICAM-1 scFv的亲和富集筛选
Tomlinson I+J噬菌体抗体库经4轮“吸附-洗脱-扩增”亲和富集筛选后,噬菌体抗体收获率由第1轮的2.00×10–8增加到第4轮的4.00×10–5,富集倍数增加2000倍左右 (表1)。亲和富集筛选过程中噬菌体抗体收获率的逐渐升高是特异性噬菌体抗体富集的表现,是评价亲和富集筛选效果的一个核心指标[13-15]。
将第4轮亲和富集筛选的阳性噬菌体感染HB2151后,从所涂布的TYE平板中随机挑取400个单克隆菌落接种于96孔板中进行培养并诱导表达scFv,利用ELISA实验进行初步筛选,最后得到4株阳性克隆,分别命名为J-A1、J-H12、I-B7和I-B10。

表1 亲和富集筛选对抗ICAM-1 scFv的富集效应
2.2 阳性克隆的鉴定
以PCR法对上述4株阳性克隆进行PCR扩增,在约930 bp处均扩增出特异条带,与预期大小一致,说明其含有完整的基因(图1A)。将4株阳性克隆用ELISA实验进行抗原交叉反应检测,实验结果表明,J-A1菌株特异性较好,其他3株与牛血清白蛋白(BSA) 或脱脂奶粉(Milk) 均有较高的交叉反应(图1B)。Dot blotting实验表明,J-A1菌株可以与人ICAM-1抗原发生特异性结合反应(图1C)。
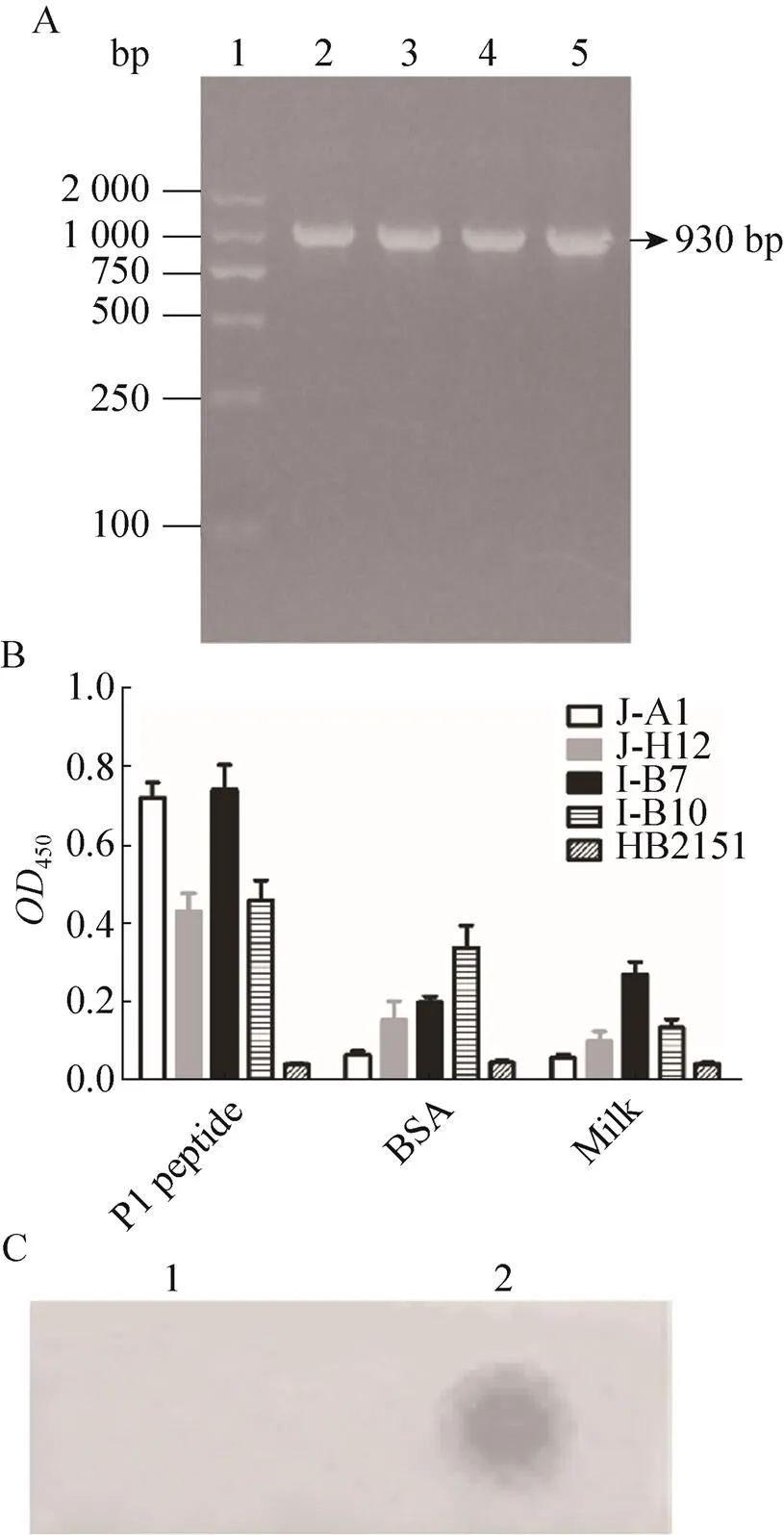
图1 阳性克隆的鉴定
2.3 J-A1序列测定与分析
J-A1序列分析表明,抗基因全长720 bp,其中重链可变区基因位于Linker的上游,长348 bp,编码116个氨基酸;轻链可变区基因位于Linker的下游,长327 bp,编码109个氨基酸。两者由含15个氨基酸的柔性短肽连接(加粗序列),构成了完整的抗基因序列(图2)。Blast分析表明,该基因序列符合数据库中单链抗体所具有的特点,重链可变区和轻链可变区具有完整的骨架区和互补决定区(划线序列) 结构。

图2 抗ICAM-1 scFv基因序列分析
2.4 抗ICAM-1 scFv的分离纯化与Western blotting鉴定
J-A1工程菌经IPTG诱导培养后,离心收集上清,经HisTrap亲和层析柱分离纯化后,收集目的蛋白样品进行SDS-PAGE,经考马斯亮蓝染色后呈单一蛋白条带,表明纯化的scFv具有较高的纯度。蛋白样品分子量为30 kDa,与scFv理论分子量基本一致(图3A)。scFv经透析和BCA法定量后,其浓度为0.65 mg/mL。Western blotting实验表明,以纯化的scFv作为一抗,在相对分子量55 kDa左右出现特异性条带,其与ICAM-1抗原分子量大小一致,证实了纯化的scFv可与人ICAM-1抗原发生特异性结合反应(图3B)。
2.5 抗ICAM-1 scFv生物学活性鉴定
竞争ELISA实验表明,伴随scFv的倍比稀释,450值逐渐升高,说明scFv和McAb与P1抗原肽的结合作用是相互排斥的,scFv能与McAb竞争结合P1抗原肽(图4)。
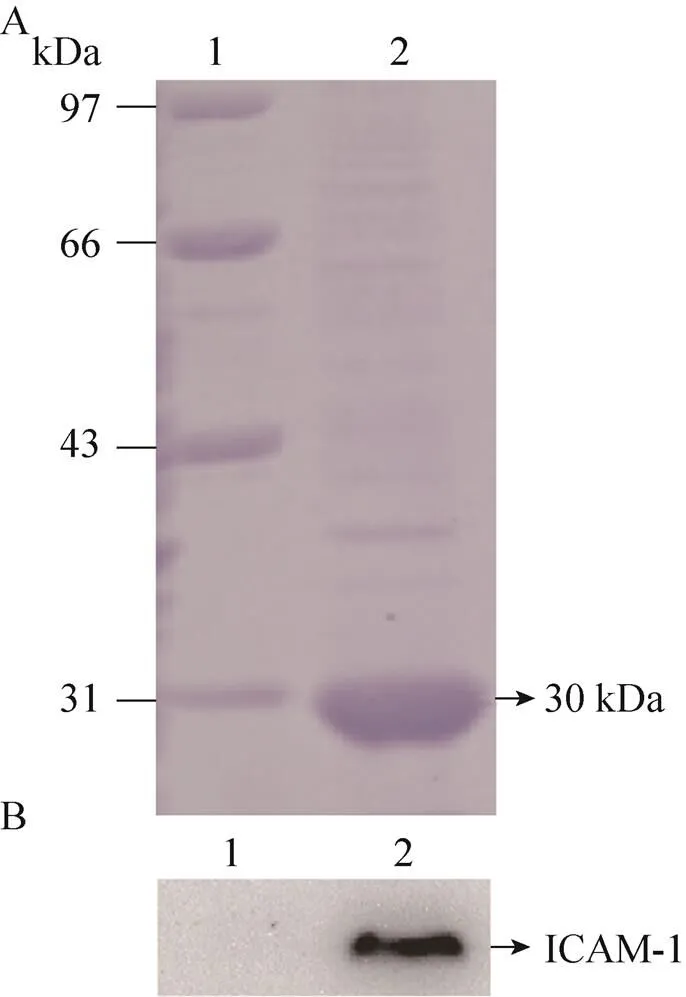
图3 抗ICAM-1 scFv的分离纯化与鉴定
利用Rose Bengal对黏附细胞进行染色,计算细胞黏附率。2 μg和5 μg scFv组的黏附率分别为30.39%与26.47%;同剂量McAb组的黏附率分别为27.45%与25.49%,PBS对照组为40.19% (图5)。细胞黏附抑制实验表明,scFv和McAb都能抑制单核细胞与人血管内皮细胞间的黏附,黏附抑制作用与其浓度呈正相关,与PBS对照组相比,差异显著。这表明所制备的抗ICAM-1 scFv具有较好的抗细胞黏附活性。
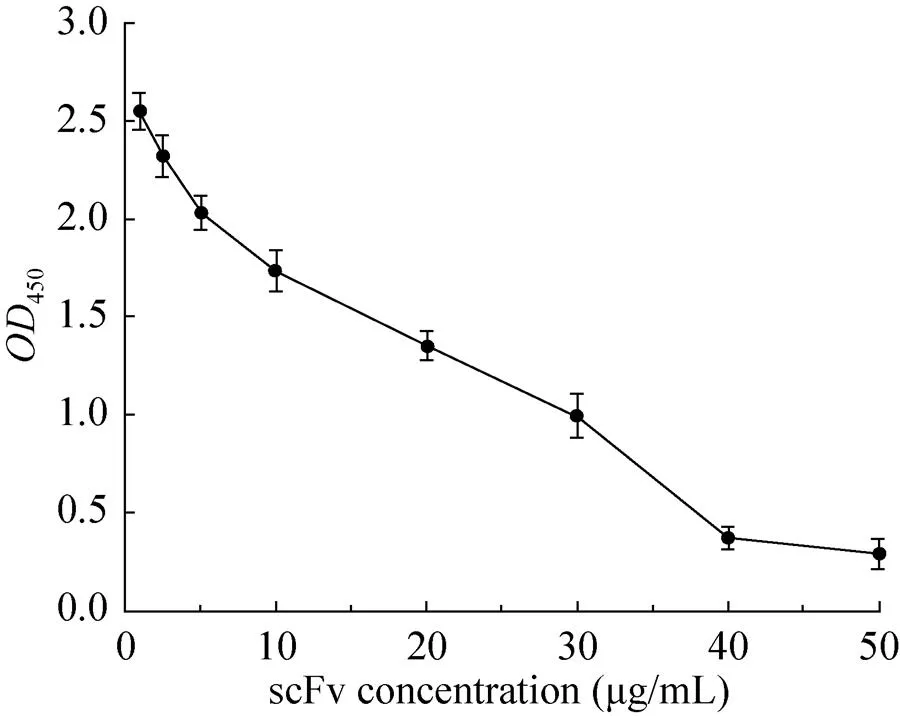
图4 竞争ELISA实验
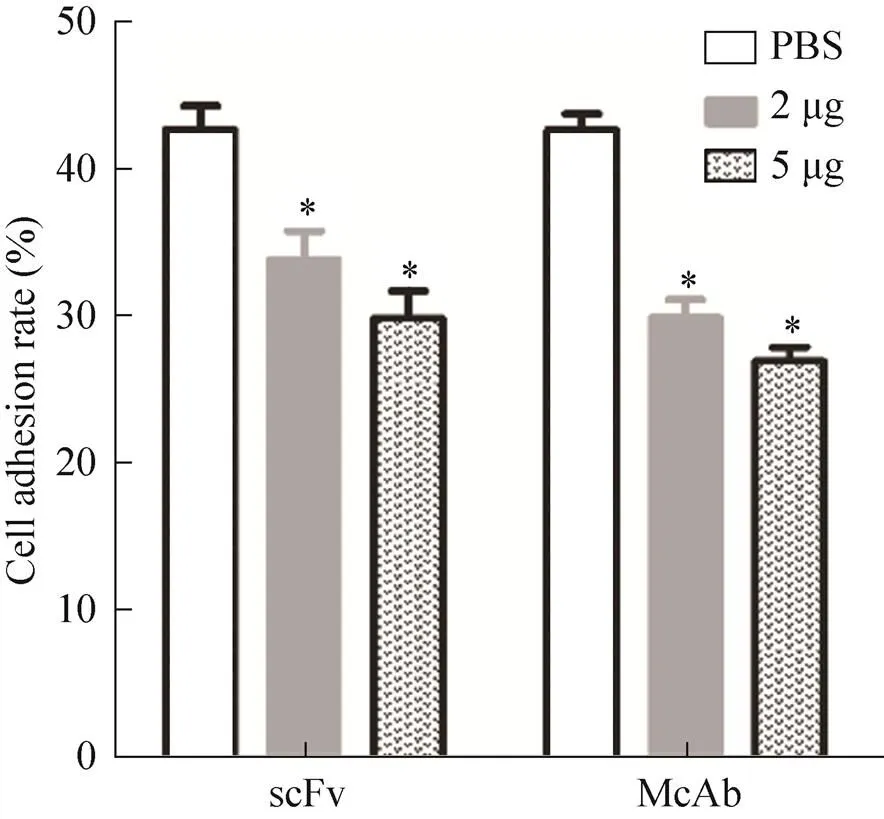
图5 细胞黏附抑制实验
3 讨论
黏附分子介导的细胞黏附是机体生理和病理过程的基本现象和共同过程。由细胞间黏附分子-1 (ICAM-1) 和淋巴细胞功能性相关抗原(LFA-1)相互作用介导的炎症级联反应过程在炎症性疾病的发生与发展中发挥重要作用[2,5]。应用新型抗黏附分子抗体特异性阻断上述作用已经成为炎症相关性疾病治疗的新热点,并成功应用于烧伤、移植排斥反应、缺血再灌注损伤、类风湿性关节炎等多种疾病的临床治疗[5,16]。美国FDA已经批准Enlimomab、Efalizumab等抗黏附分子抗体进入Ⅱ期临床研究[17-19]。
噬菌体展示技术是一种可以不经免疫动物和细胞融合等过程,通过抗体片段的克隆选择,可以快速制备出几乎所有抗原的人源化抗体的技术[20-23]。因此,为快速制备人源抗ICAM-1 scFv,本研究利用Tomlinson I+J噬菌体抗体库,采用固相筛选法,以P1抗原肽为包被抗原,经过4轮亲和富集筛选使特异性噬菌体抗体得到了2 000倍的富集。通过ELISA方法对第4轮亲和富集后的部分单克隆菌落进行抗体活性的初步鉴定,成功筛出4株阳性克隆。通过PCR鉴定反应、ELISA抗原交叉反应和Dot blotting实验,最终获得了1株既能与P1抗原肽特异结合又能与人ICAM-1抗原特异结合的阳性克隆J-A1。J-A1工程菌经IPTG诱导表达,成功进行了scFv的可溶性表达,继而采用HisTrap亲和层析柱进行分离纯化。采用Western blotting实验、竞争ELISA实验和细胞黏附抑制实验进行了scFv生物学活性的初步鉴定。上述实验表明,纯化的scFv具有与人ICAM-1抗原特异性结合的特性且结合强度与scFv浓度呈正相关;scFv能够明显抑制人血管内皮细胞和单核细胞间的黏附,其抗黏附作用随scFv浓度的增高而增强,但单链抗体的黏附抑制作用稍弱于单克隆抗体。
BLAST进行J-A1序列分析表明,J-A1含有完整的单链抗体恒定区和可变区,与已报道的抗ICAM-1 scFv氨基酸序列相比[24],J-A1的互补决定区(Complementary-determining region,CDR)序列与其差异较大,尤其是重链可变区中的CDR3区和轻链可变区中的CDR1区。由于抗原-抗体的特异性结合与抗体轻链和重链的CDR区环状结构的氨基酸序列密切相关[25],故此CDR区氨基酸序列差异可能是导致scFv亲和力差异的关键,进一步优化CDR区氨基酸序列可能是提高抗ICAM-1 scFv生物学活性的重要策略。
与本室曾采用的以大肠杆菌原核表达系统制备抗ICAM-1 scFv相比[24,26],利用噬菌体展示技术制备scFv更加简便易行并具有更高的产量和生物学活性。在后续的研究中,我们将继续深入研究以提高抗ICAM-1 scFv的稳定性和亲和性,使其具有更佳的生物学活性,探索抗ICAM-1 scFv在炎症相关性疾病治疗中的应用前景。
致 谢 衷心感谢中国科学院过程工程研究所生化工程国家重点实验室生物药物工程研究部主任刘瑞田教授在噬菌体展示技术方面给予的悉心指导和无私帮助!
[1] Hua SS. Targeting sites of inflammation: intercellular adhesion molecule-1 as a target for novel inflammatory therapies. Front Pharmacol, 2013, 4: 127.
[2] Li JL, Zhai XH. The biological functions of integrin LFA-1 and its ligand ICAM-1 and the related diseases. Chin J Cell Biol, 2013, 35(8): 1225–1231 (in Chinese). 李金丽, 翟心慧. 整合素LFA-1与其配体ICAM-1的生理功能及相关疾病. 中国细胞生物学学报, 2013, 35(8): 1225–1231.
[3] Lai ZH, Xie YL, Ma C, et al. The biological functions of cell adhesion molecules in monocyte migration. Chin J Cell Mol Immunol, 2015, 31(11): 1571–1575 (in Chinese). 赖志豪, 谢玉龙, 马超, 等. 细胞黏附分子在单核细胞迁移中的作用. 细胞与分子免疫学杂志, 2015, 31(11): 1571–1575.
[4] Anderson ME, Siahaan TJ. Targeting ICAM-1/LFA-1 interaction for controlling autoimmune diseases: designing peptide and small molecule inhibitors. Peptides, 2003, 24(3): 487–501.
[5] Chai JY, Fang PH. The therapeutics advance for anti-ICAM-1 monoclonal antibody. Chin J Cell Mol Immunol, 2011, 21(17): 1372–1374 (in Chinese). 柴锦燕, 方佩华. 抗 ICAM-1单克隆抗体在治疗方面的研究进展. 细胞与分子免疫学杂志, 2011, 21(17): 1372–1374.
[6] Wichert S, Juliusson G, Johansson A, et al. A single-arm, open-label, phase 2 clinical trial evaluating disease response following treatment with BI-505, a human anti-intercellular adhesion molecule-1 monoclonal antibody, in patients with smoldering multiple myeloma. PLoS ONE, 2017, 12(2): e0171205.
[7] Lobatón T, Vermeire S, Van Assche G, et al. Review article: anti-adhesion therapies for inflammatory bowel disease. Aliment Pharmacol Ther, 2014, 39(6): 579–594.
[8] Ma Y, Zou QM. Single chain antibody and its application in biomedicine. Immunol J, 2006, 22(3): 1–5 (in Chinese).马颖, 邹全明. 单链抗体及其在生物医学中的应用. 免疫学杂志, 2006, 22(3): 1–5.
[9] Wang XY, Yu P. Construction of single-chain Fv antibody and its application in the medicine. J Pathog Biol, 2009, 4(10): 790–792 (in Chinese).汪希雅, 余平. 单链抗体的构建及其在医学上的应用. 中国病原生物学杂志, 2009, 4(10): 790–792.
[10] Hao WB, Xu WW, Chen BH, et al. Preparation and identification of phage-displayed ICAM-1 mimic peptide. Chin J Cell Mol Immunol, 2003, 19(1): 77–79 (in Chinese). 郝文波, 徐伟文, 陈白虹, 等. 噬菌体展示ICAM-1模拟肽的制备及活性鉴定. 细胞与分子免疫学杂志, 2003, 19(1): 77–79.
[11] Li YH, Meng RQ, Zhu P, et al. The bio-activities of monoclonal antibodies against intercellular adhesion molecule-1. Chin J Prev Vet Med, 2012, 34(5): 397–400 (in Chinese). 李月红, 孟锐奇, 朱平, 等. 抗ICAM-1单克隆抗体的生物学功能研究. 中国预防兽医学报, 2012, 34(5): 397–400.
[12] Chai H, Yu JW, Ma JL, et al. Effect of berberine in tumor necrosis factor-α induced inflammation. J Zhejiang Chin Med Univ, 2011, 35(4): 489–491 (in Chinese). 柴惠, 余军伟, 马建龙, 等. 黄连素对肿瘤坏死因子TNF-α介导的炎症作用机理研究. 浙江中医药大学学报, 2011, 35(4): 489–491.
[13] Zhao Y, Wang QM, Fu XQ, et al. Construction of phage display antibody library to MCF-7 cells and screening of single-chain antibodies against breast cancer cells. Chin J Biotech, 2004, 20(5): 667–672 (in Chinese).赵岩, 王清明, 付学奇, 等. 噬菌体抗体库的构建及抗乳腺癌细胞单链抗体的筛选. 生物工程学报, 2004, 20(5): 667–672.
[14] Jiang JH, Sun FM, Han Y, et al. Screening and characterization of human anti-GPC3 single chain Fv antibody fragment selected by phage display. Acta Pharm Sin, 2017, 52 (12): 1877–1883 (in Chinese).蒋家豪, 孙福谋, 韩月, 等. 噬菌体展示全人源抗 GPC3 的单链抗体的筛选及鉴定. 药学学报, 2017, 52 (12): 1877–1883.
[15] Zhang JB, Guo F, Huang XQ, et al. A novel Omp25-binding peptide screened by phage display can inhibit Brucella abortus 2308 infectionand. J Med Microbiol, 2014, 63(6): 780–787.
[16] Wang F, Zhou T, Song W, et al. Anti-adhesion therapy and human antibody. Immunol J, 2002, 18(3): 46–48 (in Chinese). 王锋, 周同, 宋巍, 等. 抗粘附治疗与人抗体研究进展. 免疫学杂志, 2002, 18(3): 46–48.
[17] Schneider D, Berrouschot J, Brandt T, et al. Safety, pharmacokinetics and biological activity of enlimomab (anti-ICAM-1 antibody): an open-label, dose escalation study in patients hospitalized for acute stroke. Eur Neurol, 1998, 40(2):78–83.
[18] Aditya KG, Andrea MC. Efalizumab in the treatment of psoriasis. J Cutan Med Surg, 2006, 10(2): 57–68.
[19] Zoppo GJ. Acute anti-inflammatory approaches to ischemic strok. Ann N Y Acad Sci, 2010, 1207: 143–148.
[20] Ge LP, Ding N, Lan GC, et al. Current situation and prospects of therapeutic antibody. Chin Biotechnol, 2013, 33(9): 85–93 (in Chinese). 葛良鹏, 丁宁, 兰国成, 等. 治疗性抗体的研究现状与未来. 中国生物工程杂志, 2013, 33(9): 85–93.
[21] Ebrahimizadeh W, Rajabibazl M. Bacteriophage vehicles for phage display: biology, mechanism, and application. Curr Microbiol, 2014, 69(2): 109–120.
[22] Liu Y, Chen XX, Wang YX, et al. Screening and biological characteristics identification of human anti-CD147 single chain antibody fragments. Immunol J, 2018, 34(1): 59–64 (in Chinese).刘妍, 陈秀秀, 王欲晓, 等. 抗CD147人源单链抗体的筛选及生物特性初步鉴定. 免疫学杂志, 2018, 34(1): 59–64.
[23] Lin Y, Yan XY. Progression and direction of humanized antibody research. Chin J Biotech, 2004, 20(1): 1–5 (in Chinese).林芸, 阎锡蕴. 人源化抗体研究历程及发展趋势. 生物工程学报, 2004, 20(1): 1–5.
[24] Sun H, Wan ZH, Zhang GL, et al. Construction of expression vector for anti-human intercellular adhesion molecule-1 single chain fragment variable and its expression in. Chin J Biol, 2008, 21(5): 405–409 (in Chinese).孙红, 万忠海, 张国利, 等. 抗人ICAM-1单链抗体表达载体的构建及在大肠杆菌中的表达. 中国生物制品学杂志, 2008, 21(5): 405–409.
[25] Dai HP. Genesis, development and application prospect of antibody library: a review. Chin J Biotech, 2011, 27(5): 690−697 (in Chinese).戴和平. 抗体库的起源、发展及应用前景. 生物工程学报, 2011, 27(5): 690−697.
[26] Sun H, Wu GM, Chen YY, et al. Expression, production, and renaturation of a functional single-chain variable antibody fragment (scFv) against human ICAM-1. Braz J Med Biol Res, 2014, 47(7): 540–547.
(本文责编 陈宏宇)
Preparation and identification of anti-human ICAM-1 scFv
Yunyu Chen1,2, Hong Sun2,3, Gang Liu1, Huabo Hu1, Guoli Zhang2, Xiaoping Liu1, and Yuhuan Yue2
1,,,241002,,2,,130122,,3,,150025,,
To screen the specific anti-human intercellular adhesion molecule-1 (ICAM-1) single chain fragment variable (scFv) using phage display library technology and to identify its biological activity. P1 peptide was used as antigen, and the phage antibodies against human ICAM-1 antigen were panned by four binding-eluting-amplifying cycles using Tomlinson I+J phage display library. After four rounds of selective enrichment screening, the positive clones were determined by PCR, enzyme linked immunosorbent assay (ELISA)-based antigenic cross reaction and Dot blotting. Then the binding specificity and biological activity of purified scFv were identified by Western blotting, competitive ELISA and cell adhesion inhibition assay respectively. Furthermore, four positive clones were first panned through P1 peptide coated-ELISA assay, and then J-A1 was obtained and identified by PCR, ELISA-based antigenic cross reaction and Dot blotting, which could show a specific binding between P1 peptide and human ICAM-1 protein antigen. Subsequently, the purified scFv showed a satisfactory specificity and anti-adhesive activity in competitive ELISA and the cell adhesion inhibition assay. The specific anti-human ICAM-1 scFv was prepared successfully from Tomlinson I+J phage display library, which pave the way for further application of anti-human ICAM-1 scFv for inflammation diseases therapeutics.
phage display technology, intercellular adhesion molecule, ICAM-1, scFv, humanized antibody
March 12, 2018;
May 2, 2018
National Natural Science Foundation of China (Nos. 81703546, 81272485), Anhui Provincial Natural Science Foundation (No. 1808085QH265), Jilin Province Science and Technology Development Program (No. 20160520045JH), The Doctoral Starting-up Fund of Wannan Medical College (No. RCQD201617), National Key Research and Development Program of China (No. 2016YFD0501002).
Yuhuan Yue. Tel: +86-431-86985962; E-mail: yhyue2013@163.com
Xiaoping Liu. Tel: +86-553-3932601; E-mail: liuxiaoping@wnmc.edu.cn
国家自然科学基金 (Nos. 81703546,81272485),安徽省自然科学基金 (No. 1808085QH265),吉林省科技发展计划 (No. 20160520045JH),皖南医学院博士科研启动基金 (No. RCQD201617),国家重点研发计划“宠物病毒性传染病血液生物制品研究与产品创制” (No. 2016YFD0501002) 资助。
2018-06-19
10.13345/j.cjb.180083
http://kns.cnki.net/kcms/detail/11.1998.Q.20180516.1027.003.html

