IFN-γ激活ERK/Jak2-STAT信号通路诱导乳腺癌细胞过表达PD-L1和上皮-间质转化
严玉荣,赵晨辰,杨睿,周婷,许娜
IFN-γ激活ERK/Jak2-STAT信号通路诱导乳腺癌细胞过表达PD-L1和上皮-间质转化
严玉荣,赵晨辰,杨睿,周婷,许娜
武汉科技大学 生命科学与健康学院,湖北 武汉 430065

严玉荣, 赵晨辰, 杨睿, 等. IFN-γ激活ERK/Jak2-STAT信号通路诱导乳腺癌细胞过表达PD-L1和上皮-间质转化. 生物工程学报, 2018, 34(12): 2007–2015.Yan YR, Zhao CC, Yang R, et al. IFN-γ induces overexpression of PD-L1 and epithelial-mesenchymal transformation of breast cancer cells through activating ERK/Jak2-STAT signaling pathways. Chin J Biotech, 2018, 34(12): 2007–2015.
旨在探讨IFN-γ诱导乳腺癌细胞株MDA-MB-231表面程序性死亡配体 (PD-L1)的表达、对上皮间质转化的影响及其分子机制。用不同浓度IFN-γ作用MDA-MB-231细胞后,利用蛋白质免疫印迹检测PD-L1、细胞迁移相关蛋白 (E-钙黏蛋白、N-钙黏蛋白、波形蛋白)、ERK、p-ERK、Jak2及p-Jak2的表达水平;通过细胞划痕实验和Transwell实验检测细胞迁移能力;利用免疫荧光实验进一步检测细胞迁移相关蛋白的表达量。结果表明,IFN-γ可上调PD-L1的表达,使细胞划痕融合率显著增高,细胞迁移速率显著加快;波形蛋白和N-钙黏蛋白的表达量升高,E-钙黏蛋白表达量下降;ERK、p-ERK、Jak2及p-Jak2表达水平显著增加。加U0126后PD-L1、ERK及p-ERK表达水平下降,而加入AG490后,PD-L1、Jak2、p-Jak2表达水平下降。结果表明IFN-γ能上调乳腺癌细胞PD-L1表达水平,促进肿瘤细胞迁移,促使细胞从上皮向间质转化,而这一过程可能与ERK及Jak2-STAT信号通路相关。
IFN-γ,乳腺癌,PD-L1,上皮-间质转化,ERK,Jak2
乳腺癌是全世界女性中最常见的恶性肿瘤之一,全球每年约有120万人被确诊为乳腺癌,高达50万人死于乳腺癌[1]。其中乳腺癌细胞的转移以及肿瘤复发是导致患者死亡的一个主要原因, 所以探讨乳腺癌转移的相关机制对于治疗乳腺癌具有十分重要的意义。
干扰素-γ (Interferon-γ,IFN-γ) 是一种多效应的细胞因子,能够参与体内获得性免疫和固有免疫应答,在多种肿瘤中发挥抗肿瘤作用[2-5]。但同时也有研究发现,在某些情况下IFN-γ对肿瘤的发生发展具有促进作用[6-7]。
程序性死亡配体-1 (Programmed cell death ligand 1,PD-L1) 是由290个氨基酸亚基组成的跨膜分子,属于B7家族的成员。主要表达于成熟的免疫细胞和膜细胞表面,且在多种肿瘤细胞表面高表达[8-9],而PD-L1的高表达被证明与肿瘤转移有关[10-11]。
上皮-间质转化(Epithelial-mesenchymal transition,EMT) 是癌症转移早期的关键步骤之一。在EMT的生理病理过程中,上皮细胞与周围间充质细胞发生相互作用,并获得一定的间质表型,包括形态学、极性、表面标记和相关转录因子的变化[12-14]。一旦癌细胞获得间充质表型,它们就能够迁移到基质和器官,最终导致肿瘤转移和复发[15-16]。
已有研究表明基底样乳腺癌细胞系的MDA-MB-231在IFN-γ的诱导下PD-L1的表达上调[17],Sun等在最新的研究中发现,IFN-γ可以通过转化生长因子β1(Transforming growth factor-β1,TGF-β1)激活的相关途径导致奶牛乳腺上皮细胞的恶性转化[18],而IFN-γ诱导的乳腺癌细胞高表达的PD-L1与乳腺癌细胞上皮间质转化的机制尚不明确。因此本研究旨在检测IFN-γ诱导的乳腺癌细胞表面PD-L1的表达和乳腺癌细胞上皮间质转化所涉及到的相关信号通路之间的关系,为乳腺癌的治疗提供方向。
1 材料与方法
1.1 主要材料
MDA-MB-231细胞株购于上海细胞库。DMEM培养基(Hyclone,美国);胎牛血清(Ginimi,美国);IFN-γ (Recombinant Human Interferon-γ,Gibco公司;胰蛋白酶(Biosharp,中国);RIPA裂解液、SDS-PAGE蛋白上样缓冲液、蛋白Marker (Thermo scientific,中国);PMSF (Amresco,美国);Western及IP细胞裂解液(碧云天,中国);BCA试剂盒(碧云天,中国);Jak2、p-Jak2、ERK、p-ERK、PD-L1单克隆抗体、N-钙黏蛋白(N-cadherin) 单克隆抗体、波形蛋白(Vimentin) 和E-钙黏蛋白(E-cadherin) 单克隆抗体(Cell Signaling Technology,美国);CY3标记的波形蛋白二抗和FITC标记的E-钙黏蛋白二抗(BOSTER,美国);PVDF膜(Bio-Rad,美国);AG490 (Selleck,美国);U0126 (Sigma,美国);transwell小室(Corning,美国)。倒置荧光显微镜(Olympus,日本);多功能酶标仪(Molecular Devices,美国);电泳仪、凝胶成像系统(Bio-Rad,美国);细胞培养箱(ASTEC,日本)。
1.2 方法
1.2.1 实验分组与处理
将MDA-MB-231细胞接种至6孔板,待细胞长至70%–80%时,弃去原有培养基,加入新培养基,用IFN-γ 处理培养基使IFN-γ在培养基的 浓度分别为0 (NC组)、1、10、50 ng/mL,培养48 h。
1.2.2 PD-L1过表达
按照实验1.2.1分组处理细胞,收集各组细胞,用RIPA裂解细胞后,提取总蛋白。通过BCA试剂盒测定各组蛋白浓度,加入1︰1 000稀释的一抗PD-L1单克隆抗体,4 ℃过夜,TBST缓冲液洗膜(5 min×3次),加1︰2 000稀释的兔二抗,室温摇床孵育2 h,TBST缓冲液洗膜(5 min×3次),扫膜成像,检测各组细胞中PD-L1的表达量。
1.2.3 细胞划痕实验
将MDA-MB-231细胞接种至6孔板,待细胞长至70%–80%时,用20 μL的枪头划一条直线,PBS清洗细胞,加入2 mL含10%胎牛血清的培养基,用IFN-γ处理使IFN-γ在培养基中的浓度分别为0、1、10、50 ng/mL,在显微镜下分别拍摄加入IFN-γ后培养0、24、48 h细胞划痕宽度。该实验重复3次。
1.2.4 Transwell实验
解决看病难、看病贵的问题一直是广大农民最迫切的需求之一,新型农村合作医疗的不断实施已取得了明显的效果。作为农村社会保障体系的重要组成部分,完善新型农村合作医疗供给体制,对于农村的经济与社会的发展以及农业现代化的实施具有重要的意义。近年来,新型农村合作医疗供给体制不断完善,受到了广大农民的欢迎,但是,在实施的过程中仍然暴露出了些许问题,需要在今后的实施中进行体制创新,加以完善。本文在总结学术界的探讨以及实地调研的基础上,更加深入的提出建设性的建议。
将长至70%–80%的MDA-MB-231细胞消化下来,制成单细胞悬液,按每孔5×105个细胞重悬于200 μL含1%胎牛血清培养基中,并分别 加入IFN-γ (使IFN-γ在培养基的浓度分别为0、 1、10、50 ng/mL),将此培养基加入到上室,下室加含10%胎牛血清的培养基600 μL,培养24 h。取出小室,用棉签将上室内细胞擦去,用4%多聚甲醛固定10 min,0.1%结晶紫染色15 min,PBS洗3次,显微镜拍照。染色细胞用10% 醋酸溶解,酶标仪测570 nm处吸光度。
1.2.5 蛋白免疫印迹法
按照实验1.2.1分组处理细胞,根据实验1.2.2的方法检测N-钙粘蛋白、波形蛋白和E-钙粘蛋白的表达量。
1.2.6 免疫荧光实验
按照实验1.2.1分组处理细胞后,弃原培养基,PBS洗一遍,4%多聚甲醛固定10 min;PBS洗一遍,0.1% Triton通透10 min,PBS洗一遍。5% BSA封闭10 min;PBS洗一遍,加1︰200稀释的一抗波形蛋白和E-钙黏蛋白单克隆抗体,室温孵育1.5 h,PBS洗一遍,加1︰200稀释的CY3标记的波形蛋白二抗和FITC标记的E-钙黏蛋白二抗孵育20 min,弃掉二抗,PBS洗一遍,加DAPI染色10 min,荧光显微镜拍照。
1.2.7 信号通路
按照实验1.2.1分组处理细胞48 h后,根据实验1.2.2的方法检测 ERK、p-ERK、Jak2及p-Jak2表达量。将单细胞悬液接种至6孔板分为NC组、IFN-γ组(10 ng/mL)、U0126组(20 μmol/L,1 h)、AG490组(100 μmol/L,24 h) 培养48 h,然后收集蛋白,根据实验1.2.2的方法检测各组细胞中ERK、p-ERK、Jak2、p-Jak2及PD-L1表达量。
蛋白质印记成像和细胞划痕宽度均用ImageJ软件分析,所有图像均采用Origin8.0软件分析,统计数据以平均值±方差的形式表示。采用检验方法进行组间比较,<0.05为差异显著。
2 结果与分析
2.1 IFN-γ诱导MDA-MB-231细胞过表达PD-L1
与未加IFN-γ的对照组比较,用不同浓度的IFN-γ处理细胞后,随着IFN-γ浓度的增加,PD-L1 的蛋白表达量逐渐上升(<0.05),这表明IFN-γ能诱导MDA-MB-231细胞过表达PD-L1 (图1)。
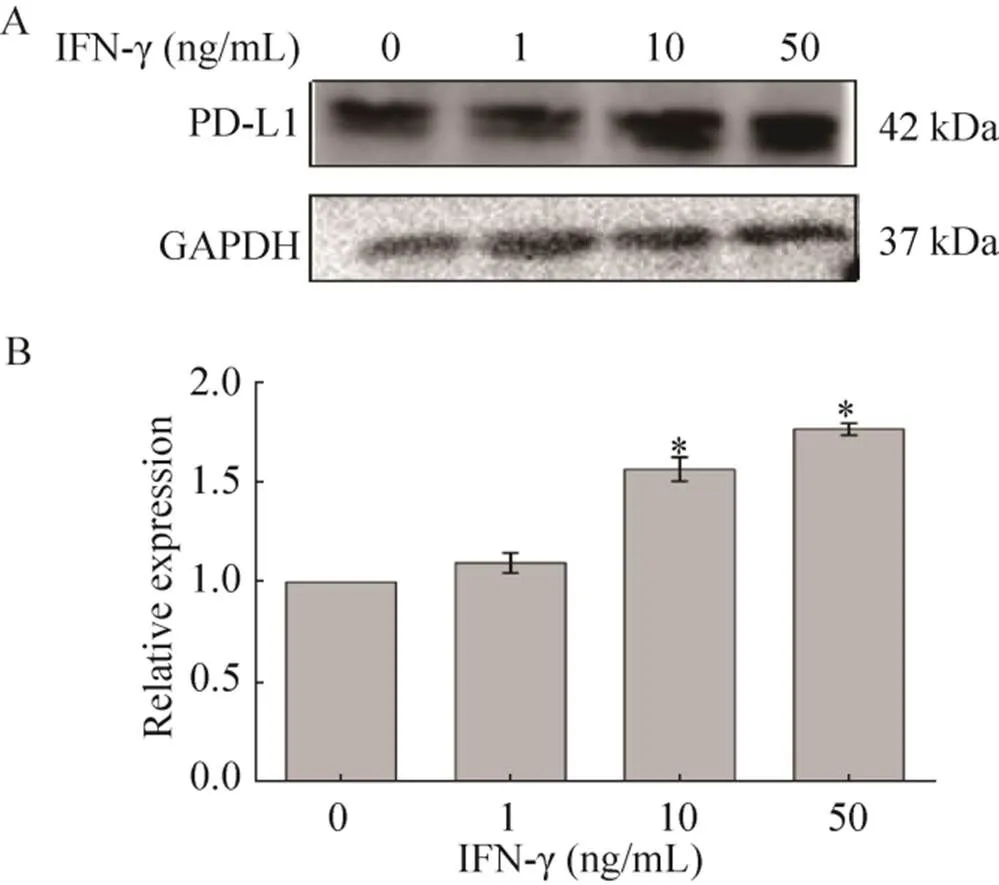
图1 IFN-γ诱导PD-L1在MDA-MB-231细胞系中的表达
2.2 IFN-γ促进MDA-MB-231细胞迁移
通过细胞划痕实验检测PD-L1过表达对MDA-MB-231细胞迁移的影响 (图2)。在IFN-γ刺激48 h后,与对照组NC相比,PD-L1过表达组(IFN-γ处理组) 的细胞迁移能力显著增强, 50 ng/mL IFN-γ处理组细胞划痕宽度仅剩余约20%,而对照组NC的宽度剩余约70%。
Transwell迁移实验结果 (图3) 显示IFN-γ显著增强MDA-MB-231 细胞穿过小室的能力,而且该效应呈浓度依赖性。与NC组相比,1、10、50 ng/mL IFN-γ处理后,MDA-MB-231细胞迁移的能力分别增加约2倍(<0.05)、3倍(<0.01)、6倍(<0.01)。
细胞划痕实验和Transwell实验均表明IFN-γ诱导MDA-MB-231细胞过表达的PD-L1能够显著提高细胞的迁移能力。
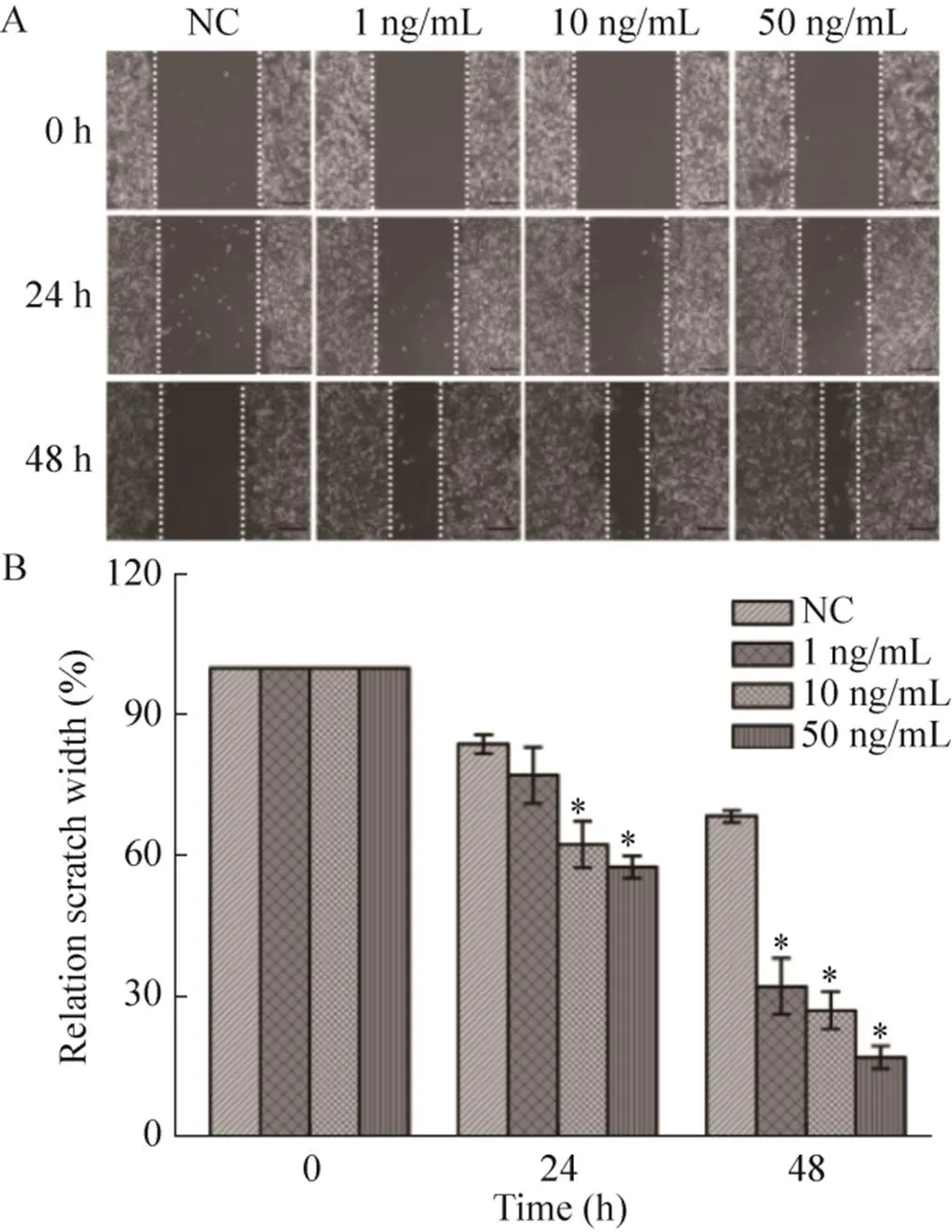
图2 细胞划痕实验结果表明IFN-γ促进细胞迁移

图3 Transwell实验结果表明IFN-γ促进细胞迁移
2.3 IFN-γ促进MDA-MB-231细胞的上皮-间质转化
蛋白免疫印迹实验结果 (图4) 显示,与NC组相比,用50 ng/mL的IFN-γ处理组中,E-钙粘蛋白表达量下调最多,约降低了60% (<0.05),波形蛋白表达量上调约1.6倍(<0.05);10 ng/mL的IFN-γ处理细胞后的N-钙粘蛋白表达量上调最多,约1.7倍(<0.05)。这表明IFN-γ诱导乳腺癌细胞由上皮样向间质样转化。
免疫荧光实验结果 (图5) 显示,与NC组相比,用不同浓度的IFN-γ处理细胞后,E-钙粘蛋白的荧光强度随药物作用浓度以及作用时间的增加而降低;而波形蛋白随药物作用浓度以及作用时间的增加而升高。进一步表明IFN-γ诱导乳腺癌细胞由上皮样向间质样转化。
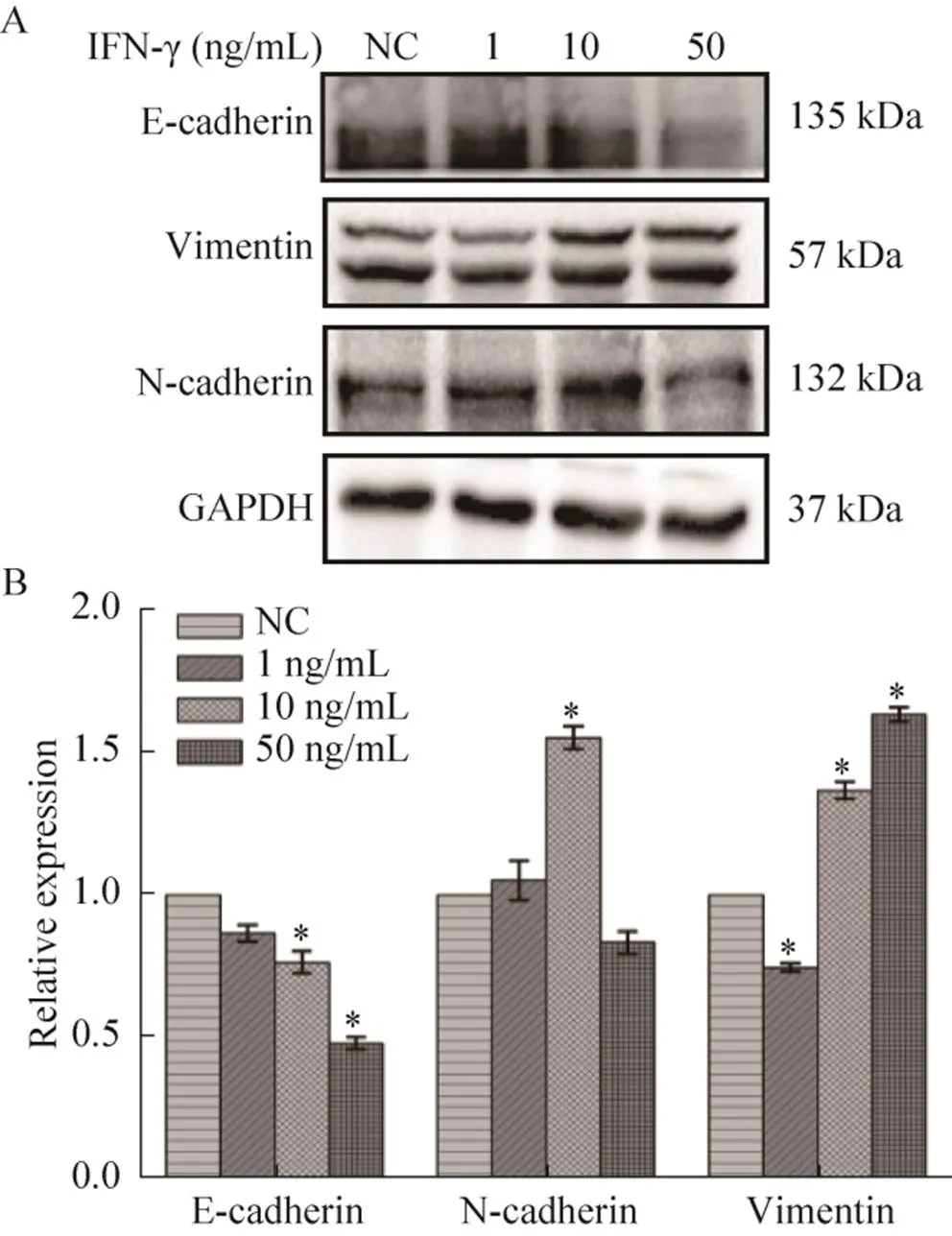
图4 IFN-γ处理后,细胞迁移相关蛋白的表达图
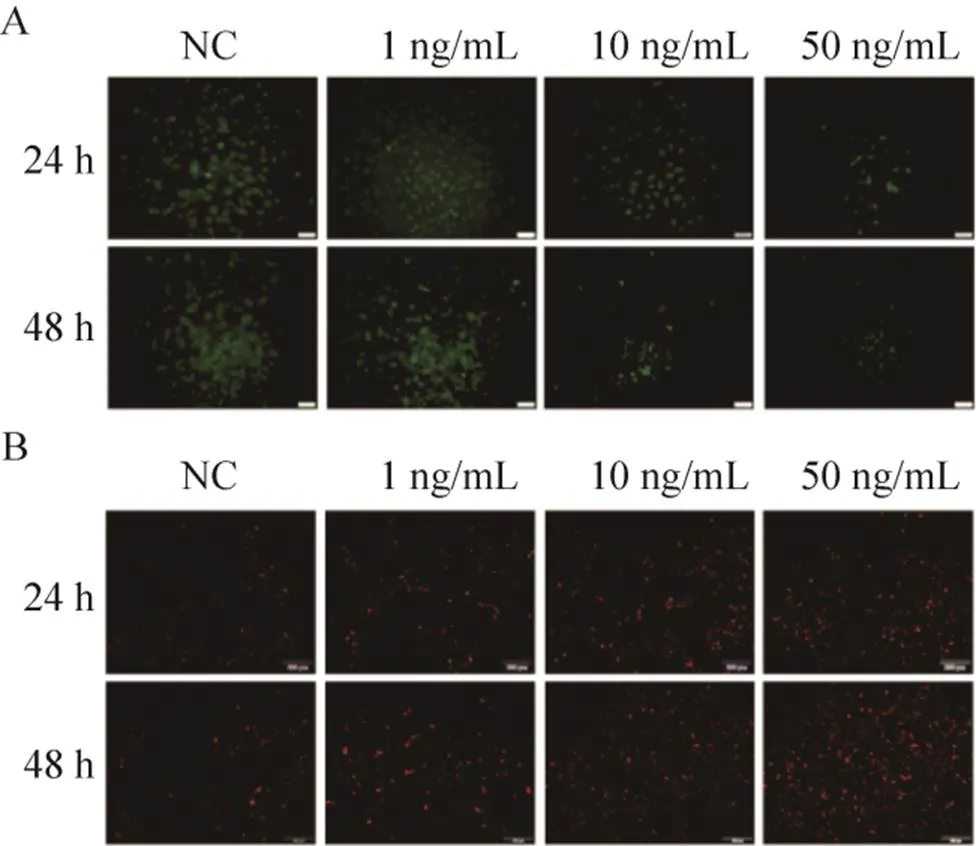
图5 IFN-γ处理后细胞迁移相关蛋白的免疫荧光染色图
2.4 IFN-γ诱导PD-L1表达和细胞迁移的分子机制
蛋白质印记实验表明在乳腺癌细胞MDA- MB-231中,ERK、Jak2、p-ERK及p-Jak2表达量随着IFN-γ作用浓度的升高而上调 (图6A)。与对照组相比,IFN-γ浓度为50 ng/mL时,ERK的表达量上调约1.8倍(<0.05),p-ERK的表达量上调约2.5倍(<0.01),Jak2及p-Jak2蛋白表达量均上调约2倍(<0.01)。根据实验结果选取IFN-γ浓度为10 ng/mL进行信号通路相关抑制剂实验。加入抑制剂U0126 (ERK抑制剂) 和AG490 (Jak2抑制剂) 后能显著抑制这4种蛋白及PD-L1的表达 (图6C),表明IFN-γ诱导的乳腺癌细胞PD-L1的上调可能是通过激活ERK及Jak2信号通路来调节,并且ERK抑制剂同时抑制了Jak2及其磷酸化的表达,而Jak2抑制剂也同时降低了ERK及其磷酸化的表达,说明IFN-γ诱导的乳腺癌细胞PD-L1的上调可能是通过ERK/Jak2-STAT信号通路共同调节。

图6 IFN-γ通过ERK/Jak2-STAT途径诱导MDA-MB-231细胞中的PD-L1表达
3 讨论
乳腺癌是一种严重威胁女性生命健康的恶性肿瘤之一,其发病率居于女性恶性肿瘤之首[19],乳腺癌的浸润和转移是影响患者生存的主要原因。抑制乳腺癌细胞的增殖与转移并诱导乳腺癌细胞的凋亡是当前乳腺癌研究的热点之一[20]。MDA-MB-231细胞是三阴性高转移的人乳腺癌细胞系,该类乳腺癌更易复发和转移[21]。PD-L1抑制剂是肿瘤免疫治疗的关键药物之一,通过PD-1/PD-L1途径抑制T细胞的活化致使肿瘤免疫耐受,因此阻断这一信号通路成为目前研究的热点。
干扰素是一类具有多种生物学活性的蛋白质,可分为3大类:Ⅰ型、Ⅱ型和Ⅲ型干扰素。IFN-γ是Ⅱ型干扰素家族中的成员,具有广泛的免疫调节作用。并且IFN-γ在肿瘤中的免疫作用是通过激活免疫细胞如树突状细胞、自然杀伤细胞以及细胞毒性T淋巴细胞等细胞直接杀伤肿瘤细胞,或者通过增强抗原提呈作用以及调节细胞代谢等间接地抑制肿瘤的进展[22]。但同时也有诸多报道IFN-γ对肿瘤的发生发展具有促进作用[6-7],在本研究中通过使用不同浓度IFN-γ刺激乳腺癌细胞,观察到乳腺癌细胞的迁移速度明显加快。
PD-L1 (B7-H1),也称为CD274,由CD274基因编码,属于B7家族的成员。它通过与在T细胞上表达的受体PD-1相互作用负性调节T细胞的活化和一系列功能。因此,它在抑制T细胞介导的抗肿瘤免疫应答中起着重要的作用[23]。研究发现IFN-γ能诱导大多数肿瘤细胞表面过表 达PD-L1,包括胰腺癌、胃癌、肺癌、子宫颈癌等[9-11,24]。而在我们的研究中也发现乳腺癌细胞系在IFN-γ的刺激下高表达PD-L1,与先前研究 相符。
已有很多研究表明,上皮-间质转化在乳腺癌转移过程中起着关键作用[25-26]。EMT的特征是上皮分化标志物E-钙粘蛋白的缺失和间充质标志物如波形蛋白和N-钙黏蛋白的上调[27]。在EMT过程中,肿瘤细胞失去细胞极性,细胞之间的连接变松,EMT的这个过程是癌细胞转移的关键步骤。在本研究中也同样发现IFN-γ能够刺激乳腺癌细胞发生EMT。
丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK) 信号通路是真核细胞介导细胞外信号到细胞内反应的重要信号传导系统。包括4条信号通路,其中细胞外信号调节激酶(Extracellular regulated protein kinases,ERK) 途径在信号传递过程中起重要作用,在很多肿瘤中,ERK 信号通路通常是被过度激活的[28]。研究证实,ERK信号通路在调节乳腺癌细胞的增殖、存活及侵袭力中发挥重要作用[29]。在本研究中用IFN-γ刺激乳腺癌细胞也检测到ERK及其磷酸化的高表达,而加入抑制剂U0126后,高表达的水平被明显抑制,PD-L1的表达也受到抑制,结果表明IFN-γ促进乳腺癌的发展可能与ERK信号通路有关。
Janus激酶-信号转导和转录激活子(Janus kinase-signal transducer and activator of transcription,Jak-STAT) 信号通路是由多种细胞因子共用调控的信号传导通路,在调节人体免疫力方面发挥着十分重要的作用[30]。IFN-γ是此信号通路的重要激活剂,其与受体结合后,调控PD-L1及各类基因的表达[31-33]。在本研究中也证实了IFN-γ诱导的乳腺癌细胞高表达Jak2,而加入Jak2抑制剂AG490处理乳腺癌细胞后,观察到PD-L1、Jak2及其磷酸化水平显著降低。并且有研究表明Jak 2-STAT与ERK信号通路存在级联效应[34],因此本研究用U0126处理细胞后,观察Jak2 及其磷酸化水平,同时也观察AG490对ERK信号通路蛋白的影响。结果显示,ERK被抑制后,Jak2及其磷酸化水平也降低,反过来抑制Jak2后,ERK及其磷酸化水平同时降低,这些表明IFN-γ对乳腺癌的促进作用可能是由ERK/Jak2- STAT信号通路共同调节。
本实验证明用不同浓度IFN-γ刺激乳腺癌细胞可上调PD-L1的表达,使细胞由上皮向间质样转化,从而降低肿瘤细胞的自身免疫原性,促使肿瘤细胞逃避机体的免疫系统的攻击,而先前有诸多的研究表明IFN-γ能够抑制乳腺癌细胞的增殖[22,28],本研究表明IFN-γ并非都是抑制肿瘤增殖,也可能在一定程度上促进了肿瘤的免疫逃逸,因此在临床上使用IFN-γ治疗肿瘤时应谨慎对待。近年来放疗、化疗以及生物治疗在临床中的广泛应用,使得乳腺癌的治疗效果明显提高,但三阴乳腺癌及已发生转移的乳腺癌,仍然是治疗的难点,PD-L1的检测可以指导临床化疗药物的选择,为乳腺癌的肿瘤免疫治疗提供了新思路。
4 结论
本研究通过用不同浓度IFN-γ刺激乳腺癌细胞可上调PD-L1的表达,IFN-γ也能促使细胞由上皮向间质样转化,而高表达的PD-L1能显著提高细胞的迁移能力,这一过程可能与ERK/Jak2- STAT信号通路相关,揭示了IFN-γ对乳腺癌细胞的促进作用,有助于进一步了解乳腺癌发生和发展的机制。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012 CA: A Cancer J, 65(2): 87–108.
[2] Zhang L, Cui H, Zhang RY, et al. Hepatocellular carcinoma cell lines exhibit sensitivity differences in response to IFN-γ treatment. Chin Hepatol, 2013, 18(8): 517–521 (in Chinese).张玲, 崔宏, 张瑞阳, 等. 不同肝癌细胞系对IFN-γ治疗的敏感性. 肝脏, 2013, 18(8): 517–521.
[3] Li SP, Wang Z, He JD, et al. Function of interferon-γ induced HepG2 cell apoptosis via inhibiting autophagy. Chin J Clin Pharmacol, 2017, 33(4): 343–346 (in Chinese). 李世朋, 王振, 何金丹, 等. 干扰素γ抑制自噬诱导肝癌HepG2细胞凋亡的作用. 中国临床药理学杂志, 2017, 33(4): 343–346.
[4] Zhou L, Yu JP, Li H, et al. Clinical observation of CH-296 and IFN-γ in cytokine-induced killer cells in patients with advanced malignant solid tumors. Chin J Clin Oncol, 2013, 40(3): 161–163 (in Chinese). 周莉, 于津浦, 李慧, 等. CH-296和IFN-γ共同培养的CIK细胞治疗晚期恶性实体瘤临床观察. 中国肿瘤临床, 2013, 40(3): 161–163.
[5] Han J, Sun BC, Ma YM, et al. Effects and mechanism of interferon-gamma on vasculogenic mimicry of melanoma cells. Tianjin Med, 2015, 43(5): 453–456 (in Chinese). 韩健, 孙保存, 马跃美, 等. 干扰素-γ对黑色素瘤细胞血管生成拟态的影响及机制. 天津医药, 2015, 43(5): 453–456.
[6] Chen SF, Hou JY, Wu SY, et al. Interferon-γ up-regulates programmed death ligand 1 in human gastric cancer cells. China Pathophysiol, 2013, 29(11): 1952–1956 (in Chinese). 陈淑芬, 侯婧瑛, 吴淑云, 等. IFN-γ上调人胃癌细胞株PD-L1表达. 中国病理生理杂志, 2013, 29(11): 1952–1956.
[7] He YF, Wang XH, Zhang GM, et al. Sustained low-level expression of interferon-γ promotes tumor development: potential insights in tumor prevention and tumor immunotherapy. Cancer Immunol Immunother, 2005, 54(9): 891–897.
[8] Sun XH. The expression and correlation analysis of FOXP3, PD-1 and PD-L1 in the tissue of cervical cancer [D]. Zhengzhou University, 2016 (in Chinese).孙晓慧. FOXP3、PD-1及PD-L1在宫颈癌组织中的表达及其相关性分析[D]. 郑州大学, 2016.
[9] Zhang FB, Qiao JX, Wang YN, et al. Expression and clinical significance of PD-1/PD-L1 in gastric cancer tissues. Chin J Cancer Biother, 2018(2): 170–176 (in Chinese).张风宾, 乔静雪, 王英南, 等. PD-1/PD-L1在胃癌组织中的表达及其临床意义. 中国肿瘤生物治疗杂志, 2018(2): 170–176.
[10] Slater NA, Googe PB. PD-L1 expression in cutaneous squamous cell carcinoma correlates with risk of metastasis. J Cutaneous Pathol, 2016, 43(8): 663–670.
[11] Li H, Fan LJ, Li JP, et al. PD-L1 affected STAT3 inhibited proliferation of vascular endothelial cells. Biotechnology, 2017, 27(3): 289–294, 258 (in Chinese). 李慧, 范丽娟, 李佳蓬, 等. PD-L1通过STAT3抑制血管内皮细胞增殖迁移. 生物技术, 2017, 27(3): 289–294, 258.
[12] Acloque H, Adams MS, Fishwick K, et al. Epithelial-mesenchymal transitions: the importance of changing cell state in development and disease. J Clin Invest, 2009, 119(6): 1438–1449.
[13] Yan S, Jiang H, Fang S, et al. MicroRNA-340 inhibits esophageal cancer cell growth and invasion by targeting phosphoserine aminotransferase. Cell Physiol Biochem, 2015, 37(1): 375–386.
[14] Niu HY, Gong L, Tian XF, et al. Low expression of miR-491 promotes esophageal cancer cell invasion by targeting TPX2. Cell Physiol Biochem, 2015, 36(6): 2263–2273.
[15] Ye X, Weinberg RA, et al. Epithelial-mesenchymal plasticity: a central regulator of cancer progression. Trends Cell Biol, 2015, 25(11): 675–686.
[16] Liu PF, Gao Y, Huan J, et al. Upregulation of PAX2 promotes the metastasis of esophageal cancer through interleukin-5. Cell Physiol Biochem, 2015, 35(2): 740–754.
[17] Soliman H, Khalil F, Antonia S. PD-L1 expression is increased in a subset of basal type breast cancer cells. PLoS ONE, 2014, 9(2): e88557.
[18] Sun JRN, Li HM, Su Y, et al. Effects of Interferon-γ (IFN-γ) on the transdifferentiation of mammary epithelial cells in dairy cows. J Anhui Agric Sci, 2017, 45(4): 99–101 (in Chinese). 孙俊若男, 李海明, 苏韵, 等. IFN-γ对奶牛乳腺上皮细胞转分化的影响. 安徽农业科学, 2017, 45(4): 99–101.
[19] Kohler BA, Sherman RL, Nadia H, et al. Annual report to the Nation on the status of cancer, 1975–2011, featuring incidence of breast cancer subtypes by race/ethnicity, poverty, and state. Breast Diseases A Year Book Quarterly, 2016, 27(1): 36–38.
[20] Li YY, Fu S, Wang XP, et al. Down-regulation of C9orf86 in human breast cancer cells inhibits cell proliferation, invasion and tumor growth and correlates with survival of breast cancer patients. PLoS ONE, 2013, 8(8): e71764.
[21] Bauer KR, Brown M, Cress RD, et al. Descriptive analysis of estrogen receptor (ER)-negative, progesterone receptor (PR)-negative, and HER2-negative invasive breast cancer, the so-called triple-negative phenotype: a population-based study from the California cancer Registry. Cancer, 2010, 109(9): 1721–1728.
[22] Tate DJ Jr, Patterson JR, Velasco-Gonzalez C, et al. Interferon-gamma-induced nitric oxide inhibits the proliferation of murine renal cell carcinoma cells. Int J Biol Sci, 2012, 8(8): 1109–1120.
[23] Ceeraz S, Nowak EC, Noelle RJ. B7 family checkpoint regulators in immune regulation and disease. Trends Immunol, 2013, 34(11): 556–563.
[24] Archana A, Terence F, Lu D, et al. Programmed death-ligand 1 (PD-L1) characterization of circulating tumor cells (CTCs) in muscle invasive and metastatic bladder cancer patients. Bmc Cancer, 2016, 16(1): 744.
[25] Thiery JP, Acloque H, Huang RYJ, et al. Epithelial-mesenchymal transitions in development and disease. Cell, 2009, 139(5): 871–890.
[26] Da Cunha IW, Souza MJL, Da Costa WH, et al. Epithelial-mesenchymal transition (EMT) phenotype at invasion front of squamous cell carcinoma of the penis influences oncological outcomes. Urologic Oncol: Semin Orig Invest, 2016, 34(10): 433.e19–433.e26.
[27] Gheldof A, Berx G. Cadherins and epithelial-to-mesenchymal transition. Progr Mol Biol Trans Sci, 2013, 116: 317–336.
[28] Zhang X, Ma L, Qi J, et al. MAPK/ERK signaling pathway-induced hyper-O-GlcNAcylation enhances cancer malignancy. Mol Celll Biochem, 2015, 410(1/2): 101–110.
[29] Zhang F, Li N. Role of ERK/MAPK pathway in treatment of breast tumors. Chin J Cancer Biother, 2007, 14(5): 497–500 (in Chinese). 张丰, 李楠. ERK/MAPK信号传导途径在乳腺肿瘤治疗中的意义. 中国肿瘤生物治疗杂志, 2007, 14(5): 497–500.
[30] van Allen EM, Golay HG, Liu Y, et al. Long-term benefit of PD-L1 blockade in lung cancer associated with JAK3 activation. Cancer Immunol Res, 2015, 3(8): 855–863.
[31] Concha-Benavente F, Srivastava RM, Trivedi S, et al. Identification of the cell-intrinsic and -extrinsic pathways downstream of EGFR and IFNγ that induce PD-L1 expression in head and neck cancer. Cancer Res, 2016, 76(5): 1031–1043.
[32] Clarke DL, Clifford RL, Jindarat S, et al. TNFα and IFNγ synergistically enhance transcriptional activation ofin human airway smooth muscle cells via STAT-1, NF-κB, and the transcriptional coactivator CREB-binding protein. J Biol Chem, 2010, 285(38): 29101–29110.
[33] Wildner G, Kaufmann U. What causes relapses of autoimmune diseases? The etiological role of autoreactive T cells. Autoimmun Rev, 2013, 12(11): 1070–1075.
[34] Chen HF, Zhang YM, Deng HY. Effect of Janus kinase inhibition on extracellular signal-regulated protein kinase during invasion and metastasis of human breast cancer cell MDA-MB-231. Academ J Second Milit Med Univ, 2008, 29(8): 900–903 (in Chinese). 陈红芳, 张亚梅, 邓华瑜. 乳腺癌细胞MDA-MB-231侵袭转移中JAK抑制对ERK的作用及意义. 第二军医大学学报, 2008, 29(8): 900–903.
(本文责编 郝丽芳)
IFN-γ induces overexpression of PD-L1 and epithelial- mesenchymal transformation of breast cancer cells through activating ERK/Jak2-STAT signaling pathways
Yurong Yan, Chenchen Zhao, Rui Yang, Ting Zhou, and Na Xu
School of Life Sciences and Health, Wuhan University of Science and Technology, Wuhan 430065, Hubei, China
To investigate the effect of INF-γ on the expression of programmed death ligand 1 (PD-L1), epithelial-mesenchymal transition (EMT) and the potential mechanism in breast cancer cell line MDA-MB-231, the cells were treated with different concentrations of INF-γ. The expressions of proteins, including PD-L1, cell-migration-related proteins (E-cadherin, N-cadherin and vimentin), ERK, p-ERK, Jak2, and p-Jak2 were detected by Western blotting analysis and immunofluorescent staining assay. Cell migration was studied through cell wound healing assay and transwell assay. IFN-γ could up-regulate the expressions of PD-L1 in MDA-MB-231 cells. The cell migration rate was significantly increased after adding IFN-γ. The expression levels of vimentin and N-cadherin were increased whereas the expression of E-cadherin was decreased after adding IFN-γ. The expression levels of ERK, p-ERK, Jak2 and p-Jak2 were significantly increased and this phenomenon was inhibited when adding ERK inhibitor U0126 or Jak2 inhibitor AG490. These results demonstrate that IFN-γ could up-regulate the expression of PD-L1, promote cell migration and transmission, and facilitate epithelial-mesenchymal transformation of breast cancer cells and this process may be related with ERK and Jak2-STAT signaling pathways.
IFN-γ, breast cancer, PD-L1, epithelial-mesenchymal transition, ERK, Jak2
February 25, 2018;
July 9, 2018
National Natural Science Foundation of China (No. 31700824).
Na Xu. E-mail: naxu@wust.edu.cn
10.13345/j.cjb.180070
国家自然科学基金 (No. 31700824) 资助。

