定向进化和噬菌体展示:生物方法开启化学新时代
——2018年诺贝尔化学奖简介
郭晓强
北京大学 深圳医院,广东 深圳 518036
2018年诺贝尔化学奖授予三位科学家,美国加州理工学院弗朗西丝•汉密尔顿•阿诺德(Frances Hamilton Arnold)由于“酶定向进化”方面的贡献分享1/2,美国密苏里大学哥伦比亚分校乔治•皮尔森•史密斯(George Pearson Smith)和英国剑桥大学分子生物学MRC实验室格雷戈里•保罗•温特爵士(Sir Gregory Paul Winter)则由于“肽和抗体噬菌体展示”方面的贡献而分享另外1/2(图1)[1-2]。
1 进化原理
今天,地球上千差万别的物种都是上百万年进化的结果。进化的实现需要两个前提:一是变异(mutation);二是选择(selection)。变异是进化的前提和基础,它为选择提供了尽可能多的材料;而选择是进化的动力和保证,借助选择才能实现“优胜劣汰”。然而,自然界进化往往是随机过程,依据自然环境变化选择或淘汰特定群体;而定向进化则是人为设定标准的选择,在这里“定向”可理解为“设定方向”之意。定向进化原理很早就被人类应用于生产和生活,如动植物驯化和育种等。这里试举一例来理解定向进化原理。
抗倒伏是评价小麦性能的一个重要指标,而抗倒伏与植株高度相关。假定现有一小麦品种,植株高100 cm,其他方面都较为理想,但抗倒伏能力弱,因此想采用定向进化策略将其改造为高80 cm的抗倒伏品种。首先采用紫外线或X射线照射诱导小麦DNA变异,然后对后代小麦高度进行观察,发现大部分小麦仍100 cm,但少部分出现高度变化,最高达到110 cm,最低90 cm,则根据定向标准(矮化)保留90 cm小麦,其他淘汰。由于仍未达到要求,需重复操作,对90 cm小麦进一步诱发突变并对后代筛选。此时若有80 cm小麦出现,则意味着通过两轮操作完成定向进化任务;若没有,最低只有85 cm,则继续重复上述操作——对85 cm小麦采用诱变-筛选操作,直到出现80 cm小麦为止(图2)。

图1 2018年诺贝尔化学奖获得者[2]
2 分子定向进化

图2 定向进化
物种驯化是从宏观层面实现定向进化,这一策略是否在分子水平同样适用尚未确定。20世纪80年代,德国化学家艾根(Manfred Eigen,1967年诺贝尔化学奖获得者)开始从分子层面研究生命起源和进化[3]。艾根认为,生命产生(从非生命过渡到生命)是一个极为漫长的过程,尽管概率极低,但仍可实现,其原因和动力就在于进化。如将这一策略从自然界转移到实验室,进化速度(变异加选择)将大大加快,以前几万年才能实现的目标将有望在几天内达成(幸运的话)。在艾根看来,相对于从一个足够大样本一次筛选到理想目标,从一个小样本采用多轮筛选、逐步逼近定向目标的策略更可行,从而意味着多轮进化方案更优(图2)。艾根只从理论上阐述了分子定向进化原理,阿诺德则首次在实验室完成该过程。
3 酶定向进化策略
定向进化前提是变异,因此变异制备就成为该策略首要解决的难题。
3.1 DNA点突变
1956年7月15号,阿诺德出生于美国匹兹堡,父亲是著名核物理学家威廉•阿诺德(William Howard Arnold,1974年当选为美国工程院院士)。这样的家庭背景对阿诺德的成长具有重要影响。1979年,阿诺德从普林斯顿大学获得机械工程学位,此时她的远大理想是希望通过开发新技术造福人类。阿诺德最初想利用太阳能发电,因此在当地一家太阳能研究所短暂工作一段时间;后来又转向生物能源,进入加州大学伯克利分校化学工程系攻读博士学位。意外的是,20世纪80年代初国际油价大跌,生物能源研究几乎降到冰点,因此阿诺德不得不转换方向,进入到生物技术这一新兴领域。她采用亲和层析进行蛋白质分离纯化,并于1985年获得博士学位。经历短暂的博士后研究工作后,阿诺德于1986年加入加州理工学院并建立实验室,开启独立的科研生涯,研究聚焦于一类在工业或医学具有广泛应用潜力的特殊蛋白质——酶。
酶是一类重要的生物催化剂,也是众多生命过程维持的基础[4]。相对于工业常用小分子催化剂,酶具有催化效率高、特异性好等优点,因此得到工业界的极大青睐。然而,酶还存在稳定性差(易降解)和反应条件苛刻(工业环境下酶活性低)等诸多不足,从而大大限制了它的应用,因此酶的改造就成为增加其应用普适性的一个重要发展方向。
20世纪80年代末,科学界主要采用理性设计策略进行蛋白质改造。这一策略在新药发明方面取得重要成功,其通过对药物前导小分子官能团的替换和修饰等操作而获得疗效更好的药物。然而,这一策略应用于蛋白质改造时效果并不理想,原因在于蛋白质属于大分子化合物,通常含有几百甚至上千个氨基酸,影响活性的通常是结构域(包含多个氨基酸),构成蛋白质的氨基酸种类又有20种之多,因此理性设计极难实现目标。在阿诺德看来,与自然界相比,人的智慧还十分渺小,毕竟天然酶都是进化的结果,而非人为设计的产物[5]。因此,阿诺德决定转换思路,采用定向进化策略进行酶的改造。那就是制造出尽可能多的酶变异体,然后从中筛选到理想的酶。为此她需要做上百万次廉价、快速的实验,而其中只有一次成功机会,但她只关注那一次成功,不在乎999 999次的失败。这一策略有点类似“大海捞针”,因此许多科学家并不看好,但阿诺德坚信只要这个“针”理论上存在,总有可能“捞”到。
阿诺德首先需要解决“海”的问题,即酶突变体制备。为此她采用了两种策略[6]:第一种为定点突变(site-directed mutagenesis),在引物设计过程中人为引入错配碱基,再借助聚合酶链式反应(polymerase chain reaction,PCR)获得特定碱基位点突变的DNA;第二种为随机突变(random mutagenesis),利用保真度较低DNA聚合酶进行PCR,可产生碱基位点的随机突变。通过这两种策略,阿诺德获得了积累多个点突变的酶变异体库,为下一步的选择奠定了基础。阿诺德的策略产生的主要是DNA点突变,不久另一种大片段变异策略对此进行了有益补充。
3.2 DNA改组
斯特默 (Willem Pim Stemmer,1957—2013)是一位荷兰分子生物学家,在阿姆斯特丹大学就读期间就对生物学产生浓厚兴趣,因此1980年他获得硕士学位后进入美国威斯康星大学攻读分子生物学的博士学位,主要研究病原体与宿主间的相互作用。斯特默不仅是一位科学家,也是一位实业家。毕业后他进入企业任职,最初在Hybritech抗体公司工作,20世纪90年代加入位于加利福尼亚帕洛阿尔托的Affymax公司,并在这里发明了一种新的DNA突变方法。
斯特默首先收集了不同物种来源的同种酶DNA,然后借助DNA酶Ⅰ部分消化产生大量10~50个碱基对(base pair,bp)大小的DNA片段。复性过程(DNA单链形成双链)中,这些具有同源性的单链DNA片段可随机形成重组双链,进一步借助PCR可最终实现大量体外重组DNA(图3)[7],该方法被称为D N A改组(D N A shuffling,“shuffling”本意是“重新洗牌”)。DNA改组由于模拟高等生物有性生殖减数分裂过程中等位基因DNA片段间互换,有时又称有性PCR(sexual PCR)。DNA改组还有另一种实现方法,使用限制性内切酶在相同位置将同源基因进行剪切产生DNA片段,再用DNA连接酶将这些片段随机连接成重组DNA分子,最终利用PCR进行扩增[8]。
点突变和改组都是制造DNA变异的重要手段,实际应用过程中往往联合使用,成为定向进化的基础。遗憾的是,斯特默由于2013年去世而丧失分享诺贝尔奖的资格[9]。

图3 斯特默和DNA改组[8-9]
3.3 选择
变异制备仅仅完成定向进化的第一步,理想的筛选系统对最终的成功也至关重要。筛选步骤过于繁琐将极大地消耗精力并增加工作负担,造成目标失败的概率大增。
最常用的策略为细胞生存力。如果一个酶具有催化有毒物质降解的能力,则可利用该有毒物质进行筛选。斯特默最初决定筛选到高活性β-内酰胺酶,而该酶主要催化β-内酰胺环裂解,因此可导致含有β-内酰胺环的抗生素如青霉素类和头孢菌素类等的抗菌活性丧失。斯特默将不同β-内酰胺酶变异体转入大肠杆菌,在转基因大肠杆菌培养基中加入高浓度头孢噻肟作为筛选剂,凡可生存下来的细菌则意味着表达高活性β-内酰胺酶。经过多轮突变和筛选(逐渐增加头孢噻肟浓度),斯特默最终实现β-内酰胺酶定向进化目标[10]。
根据酶催化产物引起的颜色变化或表型差异,研究人员可借助视觉进行筛选。为了获得在高浓度二甲基甲酰胺(dimethylformamide,DMF)中仍保留高活性的枯草杆菌蛋白酶,阿诺德将多种枯草杆菌蛋白酶变异DNA转入大肠杆菌;将大肠杆菌放置在含有DMF和酪蛋白的培养基中,分泌出的蛋白酶可水解酪蛋白,因此产生肉眼可见的晕环(halos)结构,而晕环大小与酶活性正相关,据此鉴定出高活性酶;对筛选到的酶对应DNA进一步突变,重新产生大量蛋白酶变异体,再根据晕环大小筛选更高活性酶;重复操作,直到找到符合预期活性的酶为止(图4)。经过三轮筛选,阿诺德最终得到一种包含10个点突变、比天然酶活性高256倍的蛋白酶[6]。
此外,还可根据产物特征利用分光光度计、流式细胞仪等方式进行筛选。为了适应工业需求,筛选过程中往往还需人为增加其他选择压力,如阿诺德使用的有机溶剂,以及高温、高盐等非天然环境。这些条件的选择依据酶将来的应用环境而定。
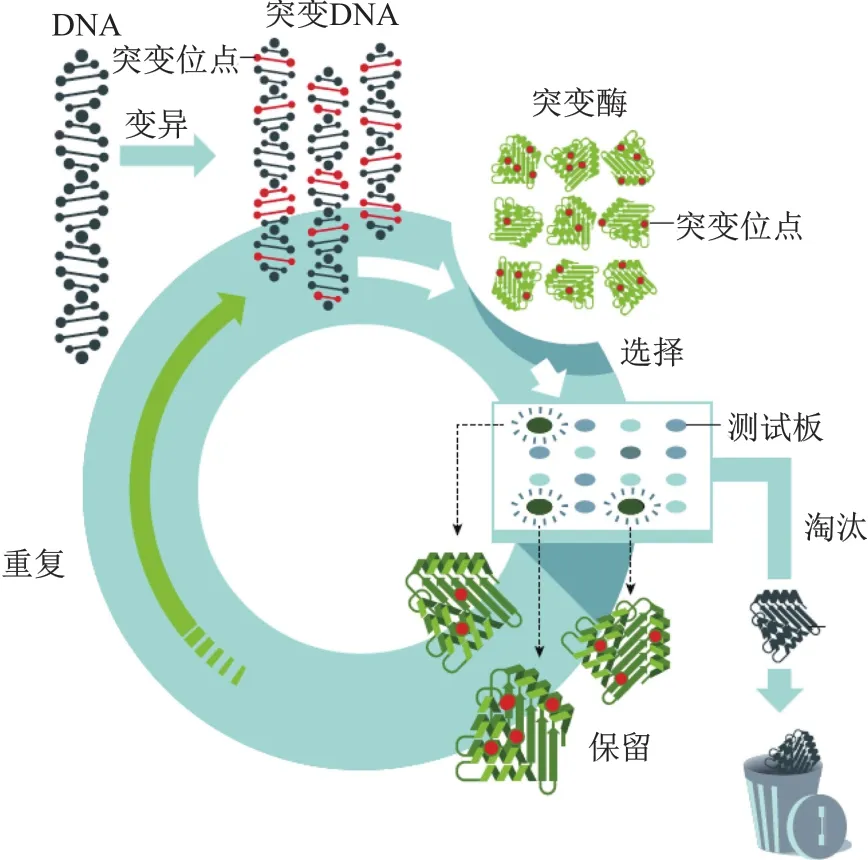
图4 酶的定向进化[1]
4 酶定向进化的应用
定向进化为酶的改造提供了一种全新方案。经过定向进化获得的酶具有众多优点,如活性高、稳定性好和适应性广等。此外,还进化出许多催化新型化学反应的酶,进一步拓展了酶的应用领域。今天,基于定向进化得到的酶已在环境治理、生物能源、生物塑料等方面得到广泛应用[11],这里试举几例。
4.1 生物能源
由于化石能源(如石油等)不可再生和造成环境污染等问题,大家开始寻找替代能源,而以异丁醇为代表的生物能源是目前的一个重要方向。在利用大肠杆菌生产异丁醇过程中遇到一个重大挑战——天然异丁醇合成相关酶以NADPH为辅因子,而大肠杆菌自身生成NADH,为此采用定向进化的方法对异丁醇合成相关酶进行改造,有效地解决了这一难题(利用NADH作辅因子)[12],为将来生物能源的应用奠定了重要基础。
4.2 药物生产
许多作为药物的有机化合物都存在手性特征,著名的例子如沙利度胺(Thalidomide,又名反应停),其R型有镇静作用,而其手性异构体S型则具有致畸作用,因此需要选择性合成。传统化学合成方法在这方面存在一定缺陷,而酶催化反应本身具有手性选择性,因此具有先天优势。借助定向进化对酶进行改造,将为许多手性药物的生产提供新选择[13]。
4.3 新化学反应
细胞色素P450(CYPs)是一个蛋白超家族,以血红素作为辅因子,因最大吸收波长为450 nm,故得名。细胞色素P450家族对底物特异性要求低,因此为它们的改造提供了先天条件。阿诺德和同事采用定向策略使改造后的细胞色素P450可高效催化烯烃环丙烷化反应,这种改造使酶的吸收波长从450 nm向411 nm偏移,因此进化酶通常称为细胞色素P411[14]。阿诺德采用酶定向进化技术实现了高效催化C—Si键的形成这一自然界罕见的化学反应[15],从而为有机硅生产提供了一种绿色方式。
5 噬菌体展示技术
1972年,美国斯坦福大学生物化学家伯格(Paul Berg)首次在体外将猿猴病毒SV40的DNA片段与λ噬菌体的DNA片段实现了连接,产生第一个人工重组DNA,他也由于这项奠基性贡献而分享1980年诺贝尔化学奖。1973年,伯耶(Herbert Boyer)和科恩(Stanley Cohen)进一步将携带抗药基因的人工重组DNA转入大肠杆菌,首次完成基因工程,同时推动了产业化的到来。1976年第一个基因工程公司基因泰克(Genentech)成立,并于1978年首次采用基因工程完成人类胰岛素的合成。基因工程的巨大成功也使众多科学家加入到这一研究行列。
1941年3月10日,史密斯出生于美国康涅狄格州诺沃克(Norwalk),从哈弗福德学院(Haverford College)获得生物学学士学位,并有一年时间在高中担任老师和实验室技术员。他在哈佛大学获得细菌学和免疫学博士学位后进入威斯康星大学,跟随著名生物学家奥利弗•史密斯(Oliver Smithies,2007年诺贝尔生理学或医学奖获得者)进行博士后研究,1975年加入密苏里大学哥伦比亚分校,工作至今。1983—1984年他来到杜克大学与韦伯斯特(Robert Webster)合作,从而开启了他的噬菌体展示之路。20世纪80年代,史密斯很想解决一个技术难题,那就是如何从蛋白质信息找到对应的基因信息(DNA序列)。这一问题在今天看来很容易解决,在当时却非常棘手。大肠杆菌作为宿主存在一定缺陷,合成的外源蛋白或者定位于细胞内,或者分泌到细胞外,从而很难将蛋白与大肠杆菌实现对应关系,史密斯因此将目光投向了更简单的生物——噬菌体。
噬菌体,顾名思义,就是一类感染细菌的病毒。它们结构简单,培养方便,因此在生物学实验室得到广泛应用。早在1930年代末,加州理工学院德裔美国生物学家德尔布吕克(Max Ludwig Henning Delbrück,1906—1981)就开始关注细菌和噬菌体。1941年的一次学术会议上,德尔布吕克与印第安纳大学鲁里亚(Salvador Edward Luria,1912—1991)相识,从而开启以噬菌体为模式生物的遗传学研究。一系列开创性的实验为噬菌体成为分子生物学研究的实验工具奠定了坚实的基础,并吸引众多科学家加入这一领域,形成著名的“噬菌体研究小组”。1943年,华盛顿大学赫尔希(Alfred Day Hershey,1908—1997)也加入噬菌体小组,并于1952年以噬菌体为模型采用同位素标记实验证明DNA是遗传物质。1969年,德尔布吕克、鲁里亚和赫尔希由于“病毒复制机制和遗传结构”的发现而分享诺贝尔生理学或医学奖。此外,沃森(James Dewey Watson)是鲁里亚的第一位研究生,正是沃森在噬菌体研究过程中发现了遗传物质的重要性而转向DNA研究,并于1953年提出DNA双螺旋模型,从而宣告分子生物学时代的到来。
噬菌体有许多类型,而史密斯选择的是丝状噬菌体(filamentous phage)。这是一类外形呈丝状或线状的噬菌体(图5),常见种类包括M13和f1等。它们通常含有单链DNA,主要感染革兰氏阴性菌,著名的如大肠杆菌等。丝状噬菌体的基因III编码一种外壳蛋白,称为蛋白III(pIII)。蛋白III定位于噬菌体末端,主要负责结合并感染细菌。史密斯发现,若在噬菌体基因III内部插入一小段外源基因,并不影响噬菌体感染效率,但同时可将外源蛋白一同携带到噬菌体表面。1985年,史密斯首先实现了这一想法,称为噬菌体展示技术[16]。
噬菌体展示技术的优势一目了然,那就是为基因克隆和蛋白质相互作用的研究提供了一个理想实验系统。假定我们分离到一种重要蛋白质,并且制备出该蛋白的单克隆抗体,现在想知道该蛋白的编码基因;此时可用蛋白抗体为诱饵(附着于固体支持物),从表达不同外源蛋白的噬菌体中精确找到携带目标蛋白的噬菌体(非携带目标蛋白噬菌体通过洗脱被去除),进一步对此噬菌体中外源基因部分进行测序就可确定DNA序列(图5)。再比如,现已知一种蛋白或多肽,想研究它的相互作用蛋白,此时就可用该蛋白作为钓饵附着于固体表面,而将其他潜在蛋白片段对应基因插入噬菌体基因III,采用相似策略可鉴定出相互作用蛋白及对应基因。史密斯的研究小组采用这种方法鉴定出蛋白质相互作用过程中关键氨基酸的信息[17]。真正使噬菌体展示技术发扬光大的则是随后在人抗体制备中的应用。

图5 噬菌体展示技术
6 抗体噬菌体展示
抗体(antibody,Ab),又称免疫球蛋白(immunoglobulin,Ig),是一类由免疫细胞分泌并特异性识别和结合细菌和病毒等病原体特定分子(称为抗原,antigen)的蛋白质。20世纪50年代末,科学家初步解析了抗体的结构,发现所有抗体基本结构都是相同的,呈“Y”字型(图6)。抗体由四条多肽链构成,两条相同重链和两条相同轻链,它们之间通过二硫键相连。重链一般含1个可变区和3个连续的恒定区;而轻链通常含1个可变区和1个恒定区。重链可变区和邻近的恒定区与轻链构成了抗原结合片段(antigen-binding fragment,Fab)区,是抗体发挥生物学功能的结构基础(图6)。
抗体由于和特定分子特异性结合的特性而使其在物质检测和纯化、疾病诊断和治疗等方面具有广泛应用。最初抗体制备采用抗原免疫动物(如兔和羊等)策略,但往往得到多克隆抗体,因此限制了其应用。1975年,剑桥大学分子生物学实验室(Laboratory of Molecular Biology,LMB)科赫勒(Georges Köhler,1946—1995)和米尔斯坦(César Milstein,1927—2002)成功开发出小鼠杂交瘤技术制备单克隆抗体[18],为抗体的应用带来一场革命,两位科学家也因此分享1984年的诺贝尔生理学或医学奖。
鼠源单克隆抗体应用于人类疾病的治疗时遭遇重大障碍。由于鼠和人的差异,鼠源单克隆抗体进入人体后可激发免疫应答,最终被破坏而使药效难以发挥。为解决这一难题,研究人员采取了多项策略(图6)[19]。最初用鼠抗体可变区和人抗体恒定区融合,产生嵌合型抗体(chimeric antibody),这种方法可使抗体中人成分达到65 %,增加了抗体的治疗效果。治疗结肠癌和非小细胞肺癌的表皮生长因子(epidermal growth factor receptor,EGFR)抗体——西妥昔单抗 (Cetuximab) (商品名爱必妥,Erbitux)就属嵌合型抗体。后来,又开发出以人抗体为基础,将抗体高度可变区替换为小鼠片段的人源化抗体(humanized antibody),这种策略可使抗体中人成分占到95 %。治疗乳腺癌的人表皮生长因子2(human epidermal growth factor receptor 2,HER2)抗体——曲妥珠单抗(Trastuzumab)(商品名赫赛汀,Herceptin)、治疗肾癌等的血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)抗体——贝伐单抗(Bevacizumab)(商品名阿瓦斯汀,Avastin)等都是人源化单抗。然而,这些抗体毕竟还保留小鼠的成分,具有潜在副作用,因此开发百分百人抗体就成为抗体公司的一个重要方向。温特采用噬菌体展示技术巧妙地解决了这一问题。
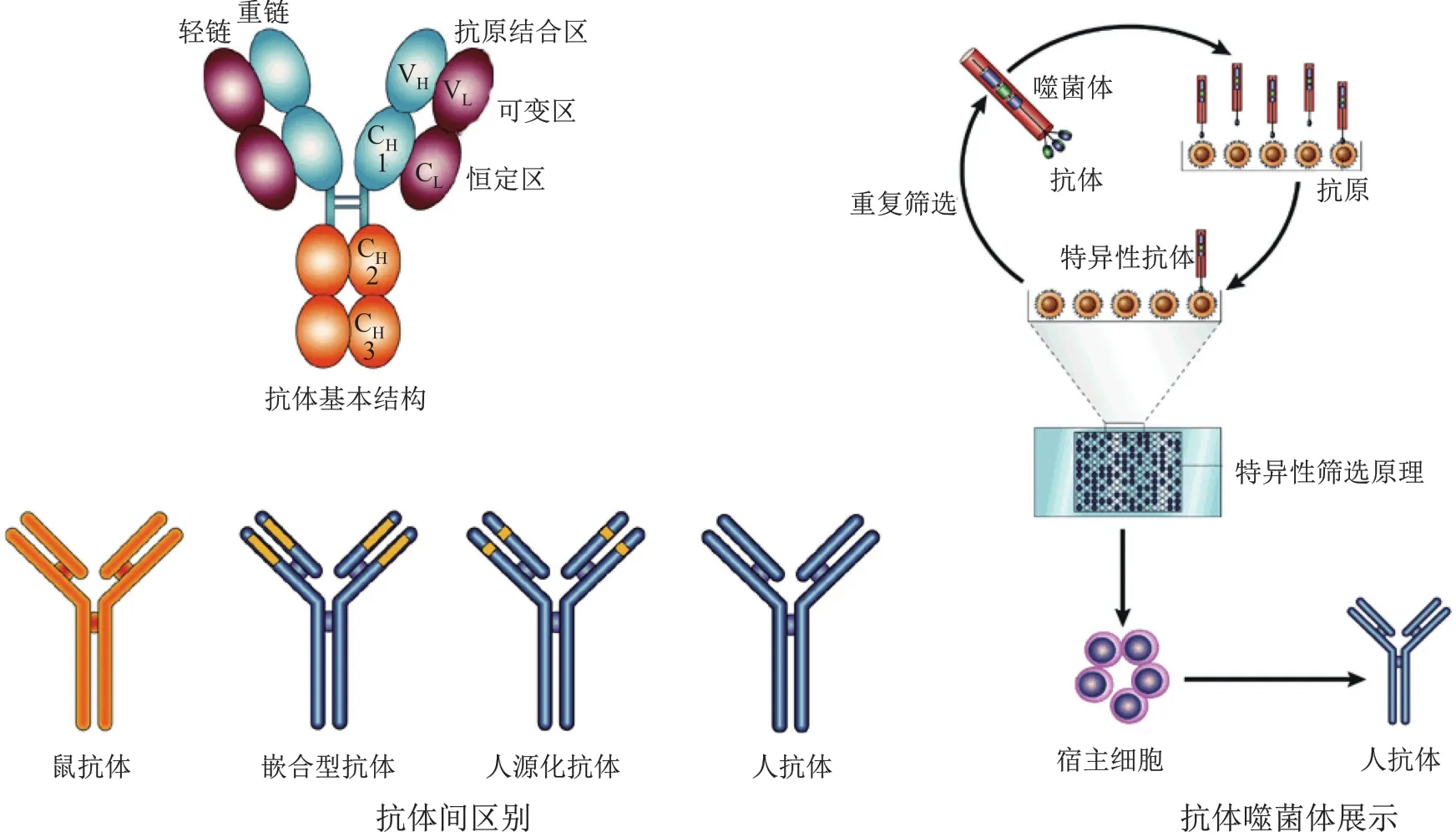
图6 抗体噬菌体展示制备人抗体
1951年4月10日,温特出生于英国莱斯特。他在剑桥三一学院完成学业,并于1977年从LMB获理学博士学位,在此期间见证了小鼠单克隆抗体制备技术的发明过程,因此对抗体产生浓厚兴趣。1989年,温特与同事建立剑桥抗体技术公司(Cambridge Antibody Technology,CAT),致力于对传统小鼠单克隆抗体的改进。
1990年,温特对噬菌体展示技术进行改进。他反其道而行之,不再利用抗体寻找蛋白,而是从蛋白出发筛选特异性抗体。由于噬菌体基因组较小,对外源基因容纳能力有限,不适用于完整抗体的展示,温特和同事用单链可变片段(single-chain variable fragment,scFv)进行代替。所谓scFv,是指抗体重链和轻链可变区(识别抗原的最关键区域)用多肽进行连接,亦可完成对抗原的特异性识别和结合。温特和同事用鸡蛋白溶菌酶免疫小鼠,然后收集小鼠B细胞,并把scFv基因插入丝状噬菌体基因III,最终筛选到鸡蛋白溶菌酶高亲和力scFv。该scFv不与人和火鸡溶菌酶发生交叉反应,进一步说明其高特异性[20],从而意味着噬菌体展示技术在抗体筛选中的可行性。
第二年,温特又对抗体噬菌体展示技术进行完善[21]。一方面建立了小鼠scFv基因库,增加选择机会;另一方面还加入定向进化理念。由于抗体生成本身就是一个进化过程(B细胞已产生尽可能多的基因变异抗体,而抗原只负责筛选过程),定向进化选择也就顺理成章。温特首先利用噬菌体展示技术获得高结合力的scFv片段,进一步采用重链可变区和轻链可变区DNA改组技术增加变异体容量(其中包含免疫后小鼠原本不存在的scFv),经过多轮筛选获得更理想的scFv。同一年,温特小组还首次建立人scFv库[22],并证明噬菌体展示技术同样适用于人抗体的制备,从而为人抗体的生产提供了一个全新方式。多家公司纷纷加入这一领域,投入大量人力和物力,随后一系列人抗体被制备并开始临床试验。
7 抗体噬菌体展示应用
肿瘤坏死因子α(tumor necrosis factor-alpha,TNFα)是一种细胞因子,通过与其受体结合而诱导炎症反应,进而参与诸多自身免疫性疾病,包括类风湿关节炎、强直性脊柱炎、炎性肠病、银屑病和难治性哮喘等,因此抑制TNFα被看作治疗这些疾病的重要手段。
1993年,包括剑桥抗体公司在内的多家公司开始合作,利用噬菌体展示技术制备TNFα人抗体,最初获得的抗体命名为D2E7[23]。2002年,TNFα人抗体D2E7被美国FDA批准应用于类风湿性关节炎的临床治疗,后又陆续批准应用于银屑病与炎症性肠病等治疗。D2E7也因此正式改名为阿达木单抗(adalimumab),商品名修美乐(Humira),意为“类风湿关节炎应用的人单克隆抗体”(human monoclonal antibody in rheumatoid arthritis)。阿达木单抗成为第一个临床应用的人抗体。自2002年以来,已累计创造近1 000亿美元价值,仅2016年就达160亿美元,且一直引领畅销药物排行榜,创造了新药销售的一个奇迹。
阿达木单抗的成功激起医药界对人抗体的巨大热情,从而使越来越多的人抗体应用于临床,如治疗和预防炭疽杆菌感染疾病的拉克昔布单抗(Raxibacumab)、治疗系统性红斑狼疮的贝利木单抗(Belimumab)、治疗转移性鳞状非小细胞肺癌的耐昔妥珠单抗(Necitumumab),以及治疗胃癌、肺癌和结直肠癌等的雷莫芦单抗(Ramucirumab)等[24]。因此,人抗体将来有望在解除毒素、抗击免疫疾病和治疗癌症等多个方面发挥更大作用。
8 小结
蛋白质作为一类重要的生物大分子具有广泛应用,而酶定向进化和抗体噬菌体展示(可看作结合蛋白定向进化)因此可看作蛋白质改造工程。改造后的酶已在生物燃料、无机材料、精细化工、日用消费、实验室试剂、药物中间体以及临床应用药物等生产方面得到广泛应用,特别是定向进化酶的工业生产符合绿色化学要求,如减少无机催化剂的使用和不必要对映体的生成,降低能源消耗等。抗体作为临床最常用的药物,其应用范围也越来越广。2018年诺贝尔生理学或医学奖也是授予一类单克隆抗体在癌症治疗中的应用,而噬菌体展示获得人抗体最大程度地减少了抗体应用过程中产生的副作用,具有重大的医学价值。
继去年诺贝尔化学奖授予冷冻电镜后,今年 “不出意外”地又授予生物学领域,一方面凸显生物学的快速发展和新进展的层出不穷,另一方面也展示了化学的开放性和包容性。只要对推动化学发展有益,并对改善人类生活有用的发现都值得授予诺贝尔化学奖。
(2018年11月12日收稿)■

