复方丹参注射液对重症急性胰腺炎肺损伤大鼠CYLD/NF-κB信号的影响*
马 丹 包先丽 叶 霜 陶 然
(1.北京市和平里医院,北京 100013;2.北京安贞医院,北京 100029)
重症急性胰腺炎(SAP)属于临床常见急性腹部病症之一,不仅造成胰腺炎症损伤,还会累及重要器官受损,其中急性肺损伤(ALI)在SAP早期最为常见,是导致SAP患者死亡的重要原因[1],因此探究SAP-ALI发病机制,对于预防以及治疗SAP-ALI,改善患者预后均十分重要。研究显示核因子-κB(NF-κB)参与ALI的发生,抑制NF-κB通路后可减轻ALI炎症损伤[2]。 圆柱瘤蛋白(CYLD)为 NF-κB 负调节因子,有学者研究显示CYLD在ALI过程中发挥负调控作用[3]。以上研究表明CYLD/NF-κB可能作为SAPALI治疗靶点。本研究旨在探究复方丹参注射液对SAP-ALI大鼠的保护作用,以及在CYLD/NF-κB通路的作用机制。现报告如下。
1 材料与方法
1.1 实验动物
SPF清洁级雄性SD大鼠购自中国中医科学院中药研究所,体质量 260 g,8~10周龄,合格证号:SYXK(京)2016-0013。
1.2 试药与仪器
复方丹参注射液,四川升和药业股份有限公司,批号:20161016;地塞米松注射液,广西万德药业股份有限公司,批号:20160918;苏木素、伊红染液购自美国Sigma公司;BCA蛋白测定试剂盒购自美国Sigma-Aldrich公司;山羊血清、5%脱脂牛奶购自美国Gibco公司;兔抗鼠 CYLD、p65、p-p65、IκBα、p-IκBα 抗体均购自美国 Sigma-Aldrich 公司;TNF-α、IL-1β、IL-6 酶联免疫吸附(ELISA)试剂盒购自美国Rche公司。低温离心机购于Eppendorf公司;倒置显微镜、凝胶成像系统购自日本Olympus公司。
1.3 模型制备
根据文献法[4]制备SAP-ALI大鼠,制备前大鼠自由饮水,禁食12 h,腹腔注射2%戊巴比妥钠麻醉,随后固定于手术台,常规消毒、铺巾后,于腹正中做一切口,暴露十二指肠,并将其提出体外,识别胰胆管汇入十二指肠系膜乳头开口处,在其下缘肠壁处选取无血管区,用注射器针头穿刺后,将5 cm硬膜外导管置入,朝向开口方向缓慢推进5 cm后,缝扎胰胆管下段以及硬膜外导管,于导管末端连接输液转换器,泵入5%0.1 mL/kg牛黄胆酸钠,流速控制在0.2 mL/min,2 min后见胰胆管以及主胰管扩张后,维持10 min,将缝扎线去除,并将导管退出,封闭穿刺孔,复位十二指肠后逐层关腹。假手术组仅翻动十二指肠、胰腺,不穿刺注药。造模后48 h内观察到大鼠进食减少、饮水增多、毛色灰暗、背部弓起、耳缘静脉突起加粗,并伴有眼球变浊暗淡等症状,同时肺部听诊可闻杂音,且呼吸急促,则判定造模成功。共60只大鼠造模成功。
1.4 分组及给药
造模后,将模型制备成功的大鼠随机分为模型组、SM低、中、高剂量组、地塞米松组,每组12只。造模后6 h后开始给药,复方丹参注射液(SM)低、中、高剂量组:经尾静脉注射 3、6、12 mL/kg,每日 1 次,连续给药7 d。地塞米松组:经尾静脉注射地塞米松2 mg/kg,每日1次,连续给药7 d。模型组:将等剂量生理盐水以相同的方法进行尾静脉注射,每日1次,连续注射7 d。
1.5 标本采集与检测
末次给药后6 h,大鼠经腹腔注射3%戊巴比妥钠麻醉,处死后,抽取腹水,采集腹动脉血3 mL,获取左肺进行支气管肺泡灌洗(BAL);同时获得右肺上叶组织,置于PBS溶液中洗涤后置于4%多聚甲醛中固定;取右肺中叶以评估肺湿/干质量比;迅速切除胰腺、右肺下叶组织,冻存于-80℃,进行后续蛋白免疫印迹分析等。
1.5.1 胰腺、肺组织病理学检查 将右肺上叶组织置于4%多聚甲醛中固定24 h,石蜡包埋制备5 μm切片。脱蜡、脱水后,进行苏木精-伊红(HE)染色后,于显微镜下进行组织病理学检查。收集图像后参考Schmidt病理评分法[5],对胰腺组织进行评分。0分表示无明显病理学变化,1分表示水肿局限或弥漫性叶间隙扩张、2~10个小叶或血管周围出现炎性细胞浸润;2分表示水肿扩张至小叶间,11~20个小叶或血管周围出现炎性细胞浸润;3分表示水肿呈弥漫性间隙扩张,21~30个小叶或血管周围出现炎性细胞浸润;4分表示水肿呈弥漫性间隙扩张,超过30个小叶或血管周围出现炎性细胞浸润。采用Holfbauer评分法[6]对肺组织病理情况进行评分,主要从水肿、出血、炎症浸润等进行评定:肺部无病变为0分;25%视野出现以上病变为1分,50%视野出现病变为2分,75%视野存在以上病变为3分;整个视野均出现以上病变为4分。
1.5.2 腹水量、肺组织干湿比重测定 处死大鼠后,抽取腹水,观察颜色,并对体积进行测定;取胰腺、右下叶肺组织置于电子天平中称重,此时所测质量为湿重,置于80℃恒温箱内烘烤,直至质量不再发生变化,此时所测重量为干重,计算干湿重比值(W/D)。
1.5.3 动脉血气指标测定 采用全自动血气分析检测仪检测腹动脉血中氧分压(PaO2)、二氧化碳分压(PaCO2),计算氧合指数(OI)。
1.5.4 蛋白免疫印迹法检测CYLD/NF-κB信号通路蛋白检测 取出保存肺组织,添加RIPA裂解缓冲液,提取总蛋白。BCA蛋白测定试剂盒测定蛋白质浓度。SDS-PAGE电泳结束后,转移至PDVF膜上。置于4℃下加入一抗孵育过夜。洗涤后加入二抗常温孵育3 h。采用化学发光试剂显影后,使用Quantity One软件分析相对蛋白表达水平。
1.5.5 免疫组化检测CYLD/NF-κB信号通路蛋白表达 常规制备肺组织石蜡切片(4 μm),脱蜡脱水后置于柠檬酸钠中孵育20 min,添加3%过氧化氢中孵育10 min,10%山羊血清孵育30 min。加入一抗后置于4℃孵育过夜。将PBS孵育的切片作为阴性对照,添加二抗孵育30 min,随后添加链霉亲和素过氧化物酶孵育15 min。然后用PBS洗涤后添加DAB溶液,显微镜下观察显色后水洗,添加苏木精进行复染,氨水返蓝后用自来水冲洗,添加二甲苯透明处理,并用中性树脂封片,显微镜下进行观察肺组织形态结构变化,标尺为100 μm。
1.5.6 大鼠BAL中性粒细胞(PMN)计数 将收集的BAL置于4℃、3000 r/min离心10 min后,保存上清液。利用血细胞自动分析仪对BAL中PMN进行计数。
1.5.7 BAL 中 TNF-ɑ、IL-1β、IL-6、SOD、MDA 含量测定 收集 BAL, 参照 TNF-ɑ、IL-1β、IL-6 ELISA 试剂盒说明书进行操作;采用硫代巴比妥酸法测定MDA水平;亚硝酸盐法测定SOD水平。
1.6 统计学处理
2 结 果
2.1 各组胰腺、肺组织病理性形态学观察
HE染色显示假手术组胰腺组织细胞正常,间质未出现炎性细胞浸润、充血以及坏死组织;模型组胰腺腺泡细胞出现大量坏死,结构模糊、融合至一片,小叶结构模糊,出现大量炎症细胞浸润,间隔明显变宽;见图1。SM组、地塞米松组均得到明显改善,且随着处理计量的增加,组织逐渐恢复正常。假手术组肺泡结构完整,肺间质未出现水肿、炎性细胞浸润等;模型组肺泡壁变厚、间隔变宽,肺间质充血伴随炎性细胞浸润,SM组、地塞米松组均得到明显改善,且随着处理计量的增加,组织逐渐恢复正常。见图2。
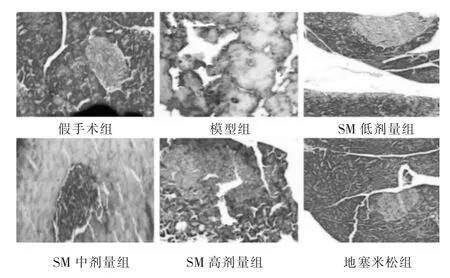
图1 各组胰腺组织病理学检查(HE染色,100倍)
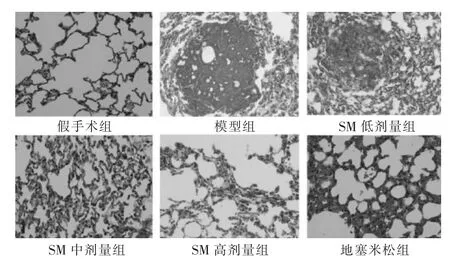
图2 各组肺组织病理学检查(HE染色,200倍)
与假手术组相比,模型组大鼠胰腺、肺组织病理评分升高,差异有统计学意义(P<0.05);与模型组相比,SM组、地塞米松组胰腺、肺组织病理评分均降低,随着给药剂量的升高,胰腺、肺组织病理评分逐渐降低,差异有统计学意义(P<0.05)。 见表1。
表1 各组大鼠胰腺组织、肺组织病理评分比较(分,±s)
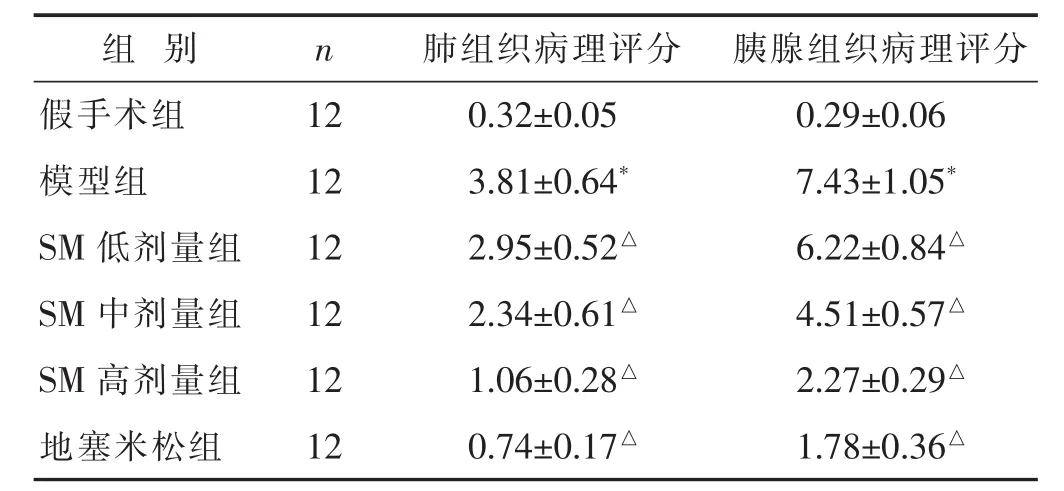
表1 各组大鼠胰腺组织、肺组织病理评分比较(分,±s)
与假手术组比较,*P<0.05;与模型组比较,△P<0.05。下同
组 别 n 肺组织病理评分 胰腺组织病理评分假手术组 1 2 0.3 2±0.0 5 0.2 9±0.0 6模型组 1 2 3.8 1±0.6 4* 7.4 3±1.0 5*S M低剂量组 1 2 2.9 5±0.5 2△ 6.2 2±0.8 4△S M中剂量组 1 2 2.3 4±0.6 1△ 4.5 1±0.5 7△S M高剂量组 1 2 1.0 6±0.2 8△ 2.2 7±0.2 9△地塞米松组 1 2 0.7 4±0.1 7△ 1.7 8±0.3 6△
2.2 各组大鼠腹水量、W/D、PMN比较
见表2。与假手术组比较,模型组腹水量、胰腺、肺组织W/D均升高,差异有统计学意义(P<0.05)。与模型组相比,地塞米松组、SM各组腹水量、胰腺、肺组织W/D降低,具有剂量依赖性,差异有统计学意义(P<0.05)。
表2 各组腹水量、W/D、PMN水平比较(±s)
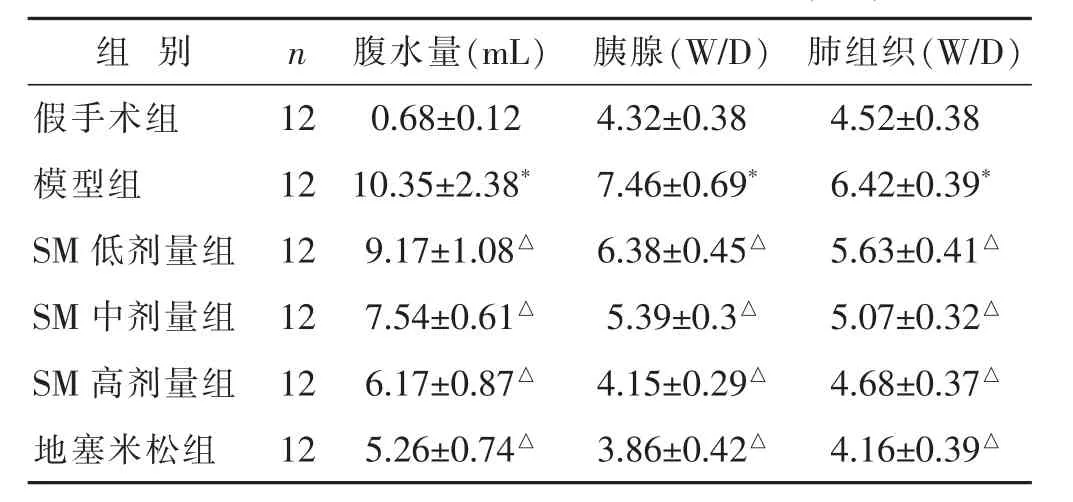
表2 各组腹水量、W/D、PMN水平比较(±s)
组 别 n 腹水量(m L)胰腺(W/D) 肺组织(W/D)假手术组 1 2 0.6 8±0.1 2模型组 1 2 1 0.3 5±2.3 8*4.3 2±0.3 8 4.5 2±0.3 8 7.4 6±0.6 9* 6.4 2±0.3 9*S M低剂量组 1 2 9.1 7±1.0 8△S M中剂量组 1 2 7.5 4±0.6 1△6.3 8±0.4 5△ 5.6 3±0.4 1△5.3 9±0.3△ 5.0 7±0.3 2△S M高剂量组 1 2 6.1 7±0.8 7△4.1 5±0.2 9△ 4.6 8±0.3 7△地塞米松组 1 2 5.2 6±0.7 4△3.8 6±0.4 2△ 4.1 6±0.3 9△
2.3 各组动脉血气相关指标比较
见表3。与假手术组比较,模型组PaCO2升高,PaO2、OI降低,差异有统计学意义(P<0.05)。与模型组比较,地塞米松组、SM各组PaCO2降低,PaO2、OI升高,具有剂量依赖性,差异有统计学意义(P<0.05)。
表3 各组大鼠 PaCO2、PaO2、OI水平比较(mmHg,±s)
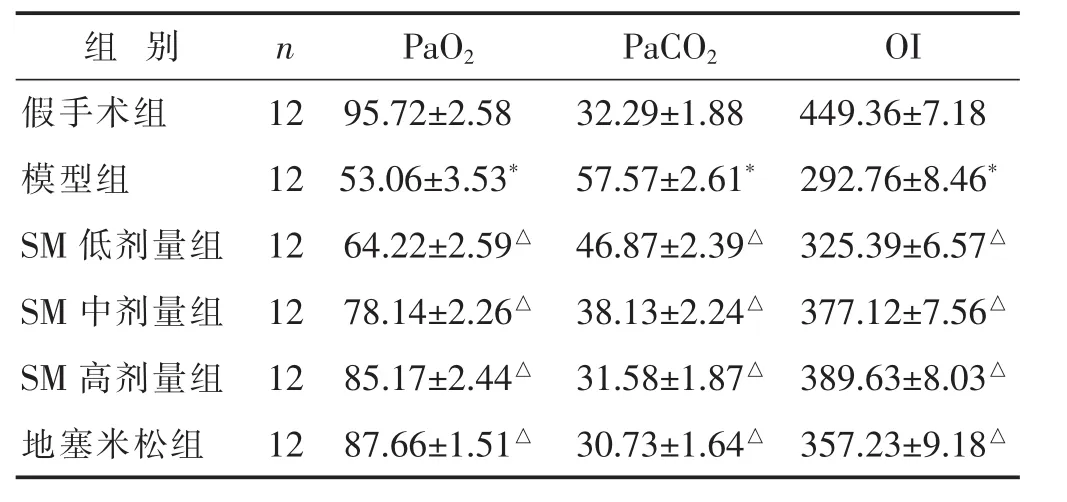
表3 各组大鼠 PaCO2、PaO2、OI水平比较(mmHg,±s)
组别 n P a O 2 P a C O 2 O I假手术组 1 2 9 5.7 2±2.5 8模型组 1 2 5 3.0 6±3.5 3*3 2.2 9±1.8 8 4 4 9.3 6±7.1 8 5 7.5 7±2.6 1* 2 9 2.7 6±8.4 6*S M低剂量组 1 2 6 4.2 2±2.5 9△S M中剂量组 1 2 7 8.1 4±2.2 6△4 6.8 7±2.3 9△ 3 2 5.3 9±6.5 7△3 8.1 3±2.2 4△ 3 7 7.1 2±7.5 6△S M高剂量组 1 2 8 5.1 7±2.4 4△3 1.5 8±1.8 7△ 3 8 9.6 3±8.0 3△地塞米松组 1 2 8 7.6 6±1.5 1△3 0.7 3±1.6 4△ 3 5 7.2 3±9.1 8△
2.4 各组大鼠肺组织CYLD、NF-κB通路蛋白检测比较
见图3、表4。与假手术组比较,模型组p-p65、p-IκBα蛋白表达升高,CYLD蛋白表达降低,差异有统计学意义(P<0.05)。与模型组比较,地塞米松组、SM各组p-p65、p-IκBα蛋白表达降低,CYLD蛋白表达升高,具有剂量依赖性,差异有统计学意义(P<0.05)。各组间p65、IκBα蛋白表达无明显变化,差异无统计学意义(P>0.05)。
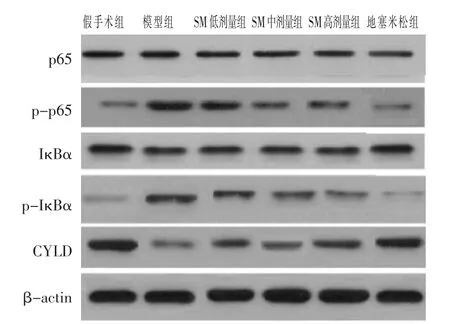
图3 各组CYLD、NF-κB通路蛋白表达
表4 各组大鼠肺组织 p65、p-p65、IκBα、p-IκBα、CYLD通路蛋白比较(±s)
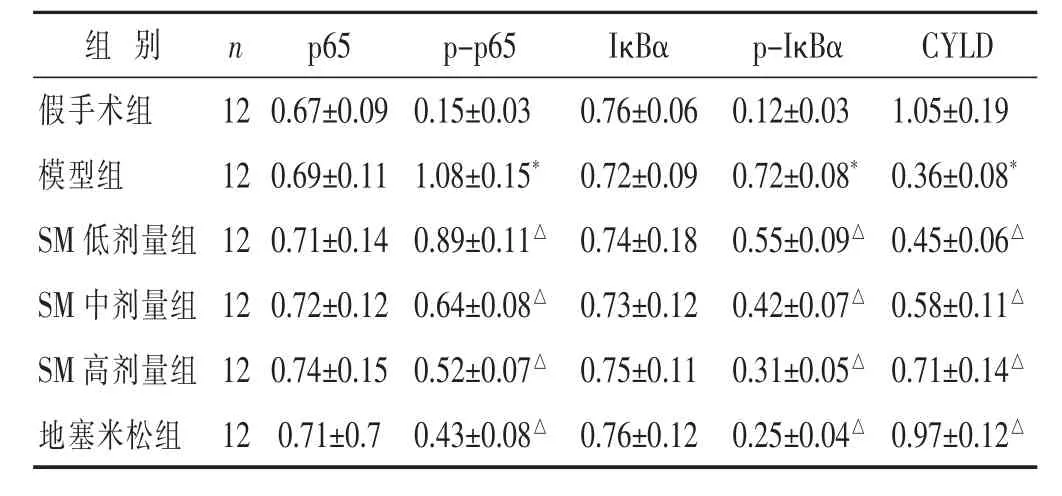
表4 各组大鼠肺组织 p65、p-p65、IκBα、p-IκBα、CYLD通路蛋白比较(±s)
组 别 n假手术组 1 2模型组 1 2 S M低剂量组 1 2 p-I κ B α C Y L D 0.1 2±0.0 3 1.0 5±0.1 9 0.7 2±0.0 8* 0.3 6±0.0 8*0.5 5±0.0 9△ 0.4 5±0.0 6△S M 中剂量组 1 2 0.7 2±0.1 2 0.6 4±0.0 8△ 0.7 3±0.1 2 0.4 2±0.0 7△ 0.5 8±0.1 1△S M 高剂量组 1 2 0.7 4±0.1 5 0.5 2±0.0 7△ 0.7 5±0.1 1 0.3 1±0.0 5△ 0.7 1±0.1 4△地塞米松组 1 2 0.7 1±0.7 0.4 3±0.0 8△ 0.7 6±0.1 2 0.2 5±0.0 4△ 0.9 7±0.1 2△p 6 5 p-p 6 5 I κ B α 0.6 7±0.0 9 0.1 5±0.0 3 0.7 6±0.0 6 0.6 9±0.1 1 1.0 8±0.1 5* 0.7 2±0.0 9 0.7 1±0.1 4 0.8 9±0.1 1△ 0.7 4±0.1 8
2.5 大鼠肺组织CYLD、NF-κB通路蛋白阳性表达率检测比较
见图4~图6、表5。与假手术组比较,模型组pp65、p-IκBα蛋白阳性表达率升高,CYLD蛋白阳性表达率降低,差异有统计学意义(P<0.05)。与模型组相比,地塞米松组、SM各组p-p65、p-IκBα蛋白阳性表达率降低,CYLD蛋白阳性表达率升高,具有剂量依赖性,差异有统计学意义(P<0.05)。

图4 各组p-p65在肺组织中的表达(免疫组化染色,400倍)
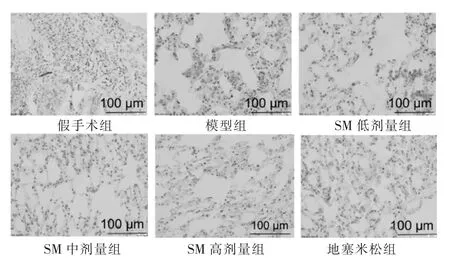
图5 各组p-IκBα在肺组织中的表达(免疫组化染色,400倍)
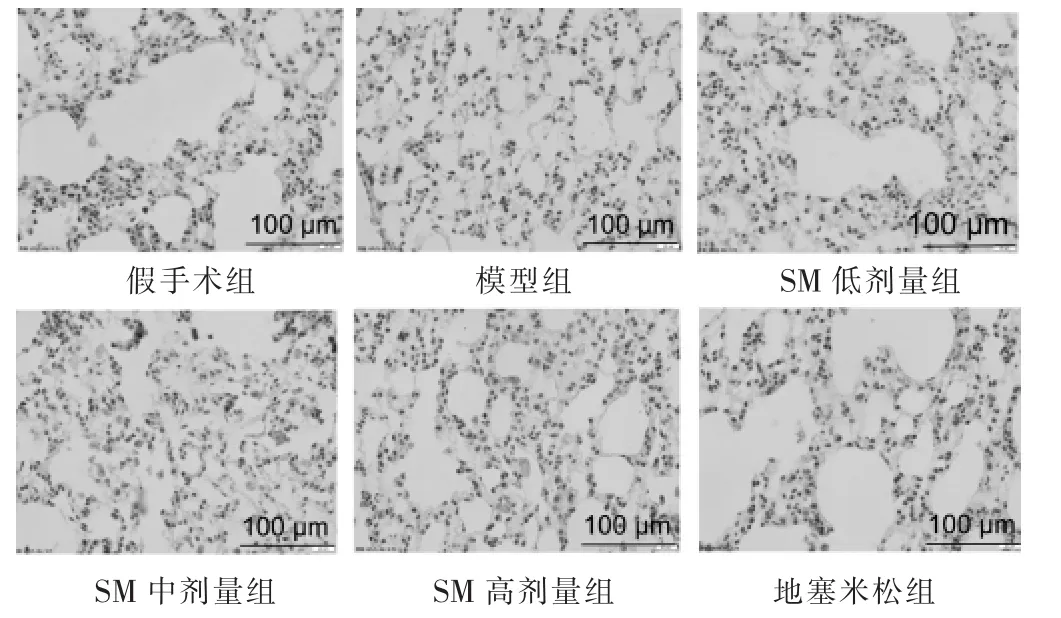
图6 各组CYLD在肺组织中的表达(免疫组化染色,400倍)
表5 各组p-p65、p-IκBα、CYLD 蛋白阳性表达率比较(%,±s)
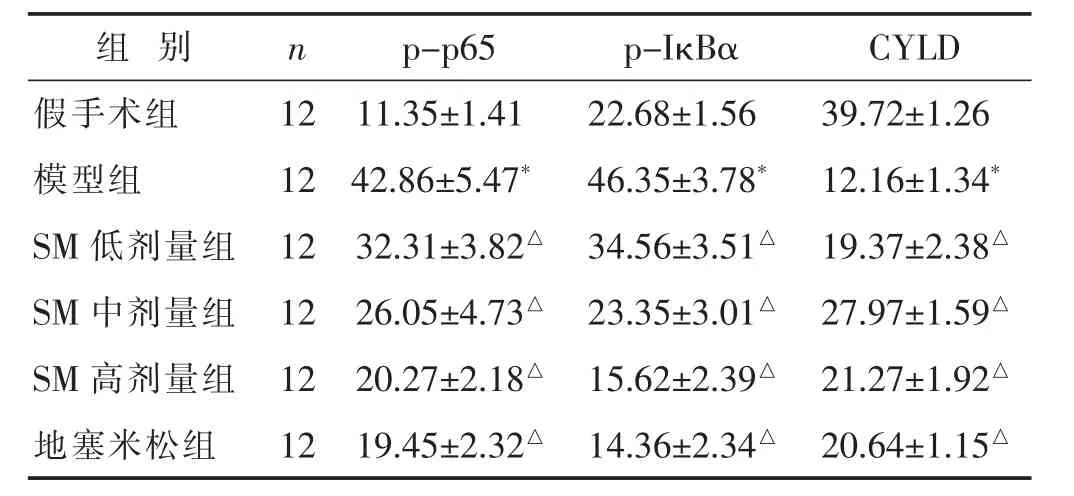
表5 各组p-p65、p-IκBα、CYLD 蛋白阳性表达率比较(%,±s)
组别 n p-p 6 5 p-I κ B α C Y L D假手术组 1 2 1 1.3 5±1.4 1模型组 1 2 4 2.8 6±5.4 7*2 2.6 8±1.5 6 3 9.7 2±1.2 6 4 6.3 5±3.7 8* 1 2.1 6±1.3 4*S M低剂量组 1 2 3 2.3 1±3.8 2△S M中剂量组 1 2 2 6.0 5±4.7 3△3 4.5 6±3.5 1△ 1 9.3 7±2.3 8△2 3.3 5±3.0 1△ 2 7.9 7±1.5 9△S M高剂量组 1 2 2 0.2 7±2.1 8△1 5.6 2±2.3 9△ 2 1.2 7±1.9 2△地塞米松组 1 2 1 9.4 5±2.3 2△1 4.3 6±2.3 4△ 2 0.6 4±1.1 5△
2.6 各组大鼠肺组织中 TNF-ɑ、IL-1β、IL-6、SOD、MDA水平比较
见表6。与假手术组比较,模型组PMN、TNF-ɑ、IL-1β、IL-6、MDA水平升高,SOD水平降低,差异有统计学意义(P<0.05)。与模型组相比,地塞米松组、SM各组 PMN、TNF-α、IL-1β、IL-6、MDA 水平降低,SOD水平升高,具有剂量依赖性,差异有统计学意义(P<0.05)。
3 讨 论
本研究通过逆行胰胆管穿刺法制备SAP-ALI模型,结果显示胰腺、肺组织病理评分、腹水量、胰腺、肺组织 W/D、PaCO2均升高,PaO2、OI降低,HE 染色显示胰腺腺泡细胞大量坏死,出现大量炎症细胞浸润;肺泡壁变厚、间隔变宽,肺间质充血伴随炎性细胞浸润。表明模型大鼠胰腺、肺组织均出现严重炎症性损伤和组织病理改变,提示动物模型制备成功。因此,改善SAPALI关键在于控制肺组织炎症反应。
表6 各组大鼠肺组织中 PMN、TNF-α、IL-1β、IL-6、SOD、MDA 水平测定比较(±s)
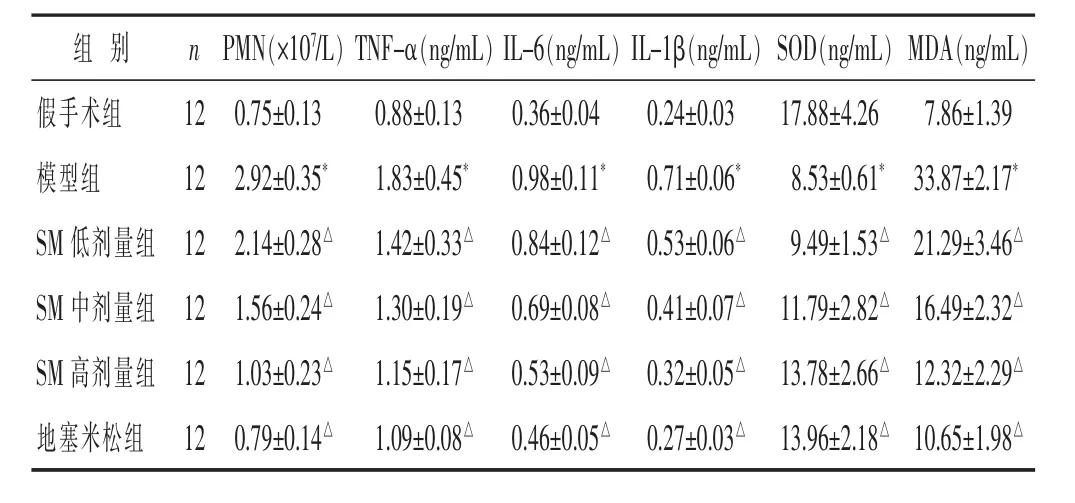
表6 各组大鼠肺组织中 PMN、TNF-α、IL-1β、IL-6、SOD、MDA 水平测定比较(±s)
组 别 n假手术组 1 2模型组 1 2 S M低剂量组 1 2 I L-1 β(n g/m L)0.2 4±0.0 3 0.7 1±0.0 6*0.5 3±0.0 6△S M 中剂量组 1 2 1.5 6±0.2 4△ 1.3 0±0.1 9△ 0.6 9±0.0 8△ 0.4 1±0.0 7△S M 高剂量组 1 2 1.0 3±0.2 3△ 1.1 5±0.1 7△ 0.5 3±0.0 9△ 0.3 2±0.0 5△地塞米松组 1 2 0.7 9±0.1 4△ 1.0 9±0.0 8△ 0.4 6±0.0 5△ 0.2 7±0.0 3△P M N(×1 0 7/L)T N F-α(n g/m L)I L-6(n g/m L)0.7 5±0.1 3 0.8 8±0.1 3 0.3 6±0.0 4 2.9 2±0.3 5* 1.8 3±0.4 5* 0.9 8±0.1 1*2.1 4±0.2 8△ 1.4 2±0.3 3△ 0.8 4±0.1 2△S O D(n g/m L)M D A(n g/m L)1 7.8 8±4.2 6 7.8 6±1.3 9 8.5 3±0.6 1* 3 3.8 7±2.1 7*9.4 9±1.5 3△ 2 1.2 9±3.4 6△1 1.7 9±2.8 2△ 1 6.4 9±2.3 2△1 3.7 8±2.6 6△ 1 2.3 2±2.2 9△1 3.9 6±2.1 8△ 1 0.6 5±1.9 8△
丹参为复方丹参注射液的主要成分,临床药理试验均证实丹参具有抗血栓、抗氧化、抗心肌缺血、调节血脂的功效,一般用于冠心病、心肌梗死、脑缺血等心脑血管疾病[7-8]。近期研究显示其也可用于在肺部病变治疗,陈杰文等研究显示丹参可通过抗氧化作用改善微循环,降低血清中炎症因子浓度,进而缓解肺损伤[9]。杜识博等研究显示,丹参可通过降低CRP等炎性物质的产生,减轻患者局部炎症损伤,改善肺功能[10]。以上临床研究均提示丹参对ALI具有一定的保护作用。但有关丹参在SAP-ALI的作用机制目前尚不清楚。本研究结果显示给予复方丹参液治疗后SAP-ALI大鼠胰腺、肺组织损伤有所改善,腹水量、胰腺、肺组织W/D、PaCO2均降低,PaO2、OI升高,提示复方丹参注射液对SAP-ALI肺组织损伤具有改善作用,但其作用机制尚不明确。
研究显示NF-κB信号通路激活在ALI中占有重要地位,抑制该通路的活化可能为治疗ALI的靶点[11]。NF-κB一般情况下被IκBα抑制,以非活性状态存在于细胞质中,在外界刺激下IκB发生磷酸化被激活,NF-κB抑制作用被解除,磷酸化后进入细胞核内,促进靶基因的转录[12-13]。苏中昊等研究显示内毒素致ALI大鼠NF-κB激活后可导致肺组织损伤,而经宣白承气汤治疗后可明显缓解肺损伤[14]。冯洋等研究显示阻断NF-κB 信号通路激活后,可预防 ALI的发生、发展[15]。本研究结果显示模型组大鼠p-p65、p-IκBα蛋白表达升高,说明NF-κB通路被激活,给予复方丹参注射液后,大鼠p-p65、p-IκBα蛋白表达明显降低,表明复方丹参注射液可能通过抑制NF-κB信号通路活性,缓解肺部炎症损伤。CYLD为肿瘤抑制蛋白,研究显示CYLD蛋白功能缺失后会导致NF-κB信号通路过度激活,进而导致各种炎症的发生[16]。CYLD能够将泛素化底物中的多聚泛素链解除,因此其可抑制-IκBα激酶复合物,进而抑制NF-κB信号通路激活,为该信号通路的负调控因子[17]。近期研究显示抑制CYLD后可引发SAP-ALI,进而引发炎症反应[18]。本研究显示模型组大鼠蛋白表达降低,给予复方丹参注射液后,CYLD蛋白明显升高,提示复方丹参注射液可能通过激活CYLD蛋白活性,抑制NF-κB信号通路,缓解肺部炎症损伤。
PMN浸润与肺组织炎症性损伤密切有关,抑制PMN可显著降低动物模型中的肺损伤严重程度[19]。肺泡巨噬细胞是肺组织中先天性免疫细胞,可产生过量的TNF-α、IL-1β、IL-6等促炎性细胞因子,引发炎症反应[20]。SOD属于机体内重要的抗氧化酶,主要作用为清除体内多余的自由基,MDA反映机体内脂质过氧化的程度,间接地反映出组织损伤的程度[21]。本研究发现,模型组BAL中PMN数量显著升高,且肺组织TNF-α、IL-1β、IL-6、MDA 水平显著增加,SOD 水平明显降低,进一步证实SAP-ALI大鼠肺组织炎性损伤。经复方丹参注射液治疗后,BAL中炎症细胞因子水平、MDA均显著降低,SOD水平显著升高,提示复方丹参注射液可能通过减少肺组织中炎症细胞因子,抑制肺组织中性粒细胞浸润,缓解氧化应激作用,从而减轻肺组织炎症反应,缓解肺组织损伤。
综上所述,复方丹参注射液能够缓解SAP-ALI肺部炎症损伤,同时激活CYLD蛋白表达,抑制NF-κB号通路活性,推测复方丹参注射液改善SAP-ALI肺损伤可能与激活CYLD蛋白、抑制NF-κB信号通路有关。但SAP-ALI肺损伤机制较复杂,本研究中复方丹参注射液仅能部分缓解肺组织炎症反应,而非逆转SAP-ALI引发肺损伤,这可能还与其他因素有关,需要深入探究,以期为疾病的治疗提供更有力依据。

