大黄素对缺氧条件下人脐静脉内皮细胞焦亡的影响*
王 凯 施 思 雷少青 夏中元
(武汉大学人民医院,湖北 武汉 430060)
血管内皮细胞为血管腔内的单层扁平细胞,可通过收缩和舒张调节血管内血流量,控制血管通透性,调节内环境,维持正常的生理功能[1]。内皮细胞可以通过调节血管内外液体和物质跨膜转运而调节血液和组织液之间的物质交换[2]。在心血管疾病如高血压、动脉粥样硬化发生发展过程中,缺氧可以通过促进氧化应激、脂质堆积和炎症反应增加血管内皮细胞损伤程度,促进疾病的发展[3-4]。因此减轻缺氧造成的血管内皮细胞损伤可以减轻疾病的严重程度。
细胞焦亡是一种炎症反应相关的程序性细胞死亡方式,是在沙门菌感染巨噬细胞时被发现的[5],可由细菌、病毒感染等一系列病理刺激激发,常伴有Caspase-1活化,以及大量炎性因子的产生[6]。细胞焦亡发生过程中,会在细胞膜上形成孔道,这些孔道会使细胞内渗透压增加,细胞吸水肿胀,最终细胞膜破裂,细胞内容物释放到细胞外[7]。
大黄素是存在于大黄和许多其他植物中的天然的蒽醌,为中药大黄的主要有效单体,具有抗炎症、抗氧化作用[8-9]。目前对于大黄素在缺氧条件下对细胞焦亡的影响暂未见文献报道,本实验拟在离体培养的人脐静脉内皮细胞(HUVEC)中建立缺氧模型,观察大黄素对缺氧条件下细胞焦亡的影响及探讨其可能存在的机制。现报告如下。
1 材料与方法
1.1 材 料 HUVEC 购 自 YRGene(NC006),RPMI 1640培养基、胰酶为美国Hyclone公司产品,胎牛血清FBS为美国sciencell公司产品,大黄素和活性氧(ROS)检测试剂盒为美国Sigma公司产品,CCK-8试剂盒为日本同仁公司产品,核苷酸结合寡聚化结构域样受体蛋白 3(NLRP3)抗体、Caspase-1抗体和 IL-1β 抗体为英国abcam公司产品,内参β-actin为美国CST公司产品,羊抗兔荧光二抗为美国Millpore公司产品。
1.2 细胞培养 HUVEC细胞在37℃、5%CO2培养箱中用含10%胎牛血清的1640培养基进行培养。待细胞密度为90%左右时,吸干皿内原培养基,用PBS洗3遍,加0.25%的胰酶将贴壁细胞消化分离,轻轻吹打均匀,使细胞彻底从培养皿底壁脱落,进行传代培养。取处于对数期、生长状态良好的细胞进行实验。
1.3 分组方法 将HUVEC随机分为4组。1)对照组:正常培养内皮细胞。2)缺氧12 h组:内皮细胞置于含有5%CO2+95%N2的三气培养箱内经过缺氧处理12 h。3)缺氧24 h组:内皮细胞置于含有5%CO2+95%N2的三气培养箱内经过缺氧24 h处理。4)EMO处理组:内皮细胞预先加入大黄素处理24 h后,再置于含有5%CO2+95%N2三气培养箱内缺氧24 h。
1.4 细胞活力检测 取HUVEC细胞悬液加入96孔板(每孔约1×104个细胞),培养24 h后加入不同浓度的大黄素溶液(0、20、40、60、80、100 μmol/L),持续培养24 h,换液后,每个孔分别加入10%的CCK-8溶液100 μL,在培养箱中孵育1 h,用酶标仪检测450 nm出的吸光度(A),计算细胞存活率。另外取对照组、缺氧12 h组、缺氧24 h组、EMO处理组细胞悬液,检测各组吸光度,计算细胞活力,细胞活力(%)=[A(加药)-A(空白)]÷[A(未加药)-A(空白)]×100%。
1.5 活性氧检测 在6孔板中分别培养对照组、缺氧12 h组、缺氧24 h组、EMO处理组细胞 (处理方式如1.3中所述)。按照ROS检测试剂盒说明书操作步骤,收集细胞后,加入 DCFH-DA(1 mmol/L)工作液,在37℃,5%CO2的环境中避光温育30 min,检测各组细胞的ROS水平。
1.6 Western blotting法检测蛋白表达 取4组培养的细胞,去除培养基后,经PBS洗2次,加入细胞裂解液裂解细胞,收集蛋白,经BCA法测定蛋白浓度后,取20 μg上样,经SDS-PAGE电泳、转膜。用5%脱脂牛奶封闭 1 h。 分别用抗体 NLRP3 (1∶500)、Caspase-1 (1∶500)、IL-1β(1∶1000)以及内参 β-actin(1∶1000)进行4℃孵育过夜。用TBST洗膜3次,每次10 min,加入荧光二抗(1∶10000),室温孵育 1 h。洗膜 3 次,每次 10 min,使用Odyssey双色红外激光扫描显影仪(Li-Cor公司,美国)扫描荧光蛋白条带,用Odyssey系统软件进行结果分析,通过目的蛋白条带灰度值与内参β-actin条带灰度值的比值表示目的蛋白的表达水平。
1.7 统计学处理 应用SPSS22.0统计软件。计量资料以(±s)表示,两组比较采用t检验,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组细胞活性比较 见表1,表2。当大黄素浓度在0~60 μmol/L之间时,细胞活力逐渐增加,当大黄素浓度为60 μmol/L时,细胞活力明显升高,与0 μmol/L相比差异有统计学意义(P<0.05),当大黄素浓度高于80μmol/L时,细胞活力明显下降,与0μmol/L和60μmol/L相比差异有统计学意义(P<0.05),见表1,故选择60 μmol/L预处理24 h进行后续实验。如表2所示,缺氧12 h组细胞活力无明显变化,与对照组相比差异无统计学意义(P>0.05),而缺氧24 h组细胞活力明显下降,与对照组相比较差异有统计学意义(P<0.05),经大黄素处理后,细胞活力明显升高,与缺氧24 h组相比,差异有统计学意义(P<0.05)。
表1 不同浓度大黄素作用下的细胞活力(±s)
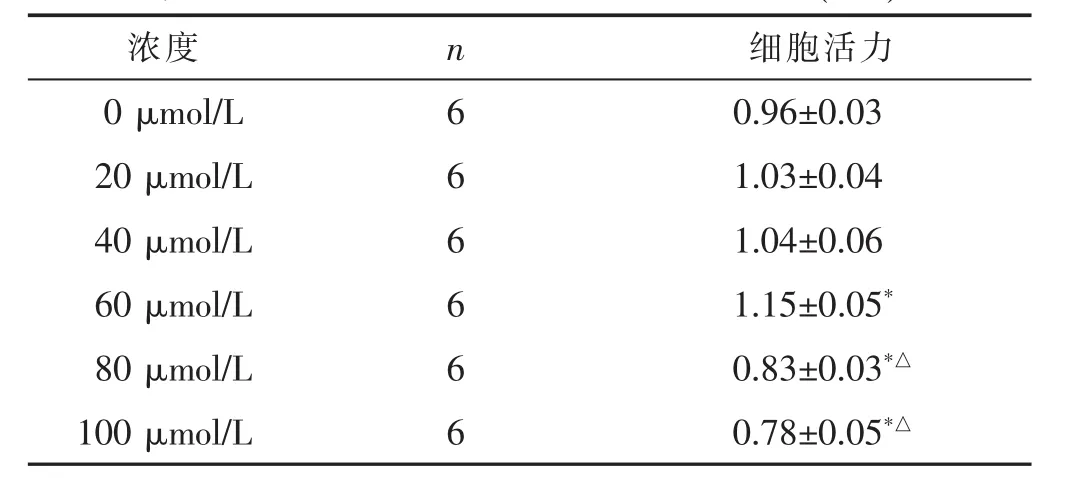
表1 不同浓度大黄素作用下的细胞活力(±s)
与 0 μmol/L 比较,*P<0.05;与 60 μmol/L 比较,△P<0.05
?
表2 各组细胞活力比较(±s)
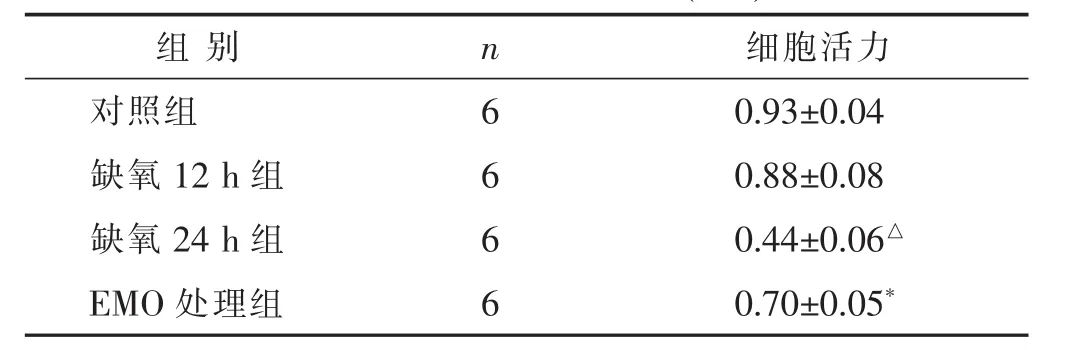
表2 各组细胞活力比较(±s)
与缺氧24 h组比较,*P<0.05;与对照组比较,△P<0.05。下同
细胞活力0.9 3±0.0 4缺氧 1 2 h组 6 0.8 8±0.0 8缺氧 2 4 h 组 6 0.4 4±0.0 6△E M O 处理组 6 0.7 0±0.0 5*组别 n对照组 6
2.2 各组ROS水平比较 见表3。缺氧12 h组ROS水平升高不明显,与对照组差异无统计学意义 (P>0.05),而在缺氧24 h组中,ROS水平明显升高,与对照组差异有统计学意义 (P<0.05);EMO处理组ROS水平明显下降,与缺氧24 h组差异具有统计学意义(P<0.05)。
表3 各组细胞上清ROS水平比较(±s)

表3 各组细胞上清ROS水平比较(±s)
R O S水平8 4.9 3±7.9 1缺氧 1 2 h组 6 9 4.7 3±7.3 1缺氧 2 4 h 组 6 1 2 8.3 1±1.4 2△E M O 处理组 6 1 0 1.7 1±1.9 7*组别 n对照组 6
2.3 各组焦亡蛋白表达水平比较 见图1、表4。缺氧12 h 组 NLRP3、Caspase-1、IL-1β 蛋白表达水平变化不明显,与正常对照组相比差异无统计学意义(P>0.05), 而在缺氧 24 h 组中 NLRP3、Caspase-1、IL-1β表达蛋白水平明显升高,与正常对照组相比差异有统计学意义 (P<0.05);EMO 处理组 NLRP3、caspase-1、IL-1β蛋白表达水平明显下降,与缺氧24 h组相比差异有统计学意义(P<0.05)。

图1 各组细胞NLRP3、Caspase-1、IL-1β蛋白相对表达情况
表4 各组细胞中NLRP3、Caspase-1、IL-1β蛋白相对表达水平比较(±s)

表4 各组细胞中NLRP3、Caspase-1、IL-1β蛋白相对表达水平比较(±s)
组别 n I L-1 β N L R P 3 C a s p a s e-1对照组 6 1.0 0±0.0 0缺氧 1 2 h组 6 1.0 9±0.0 7缺氧 2 4 h 组 6 1.6 4±0.0 9△1.0 0±0.0 0 1.0 0±0.0 0 1.0 6±0.0 8 1.1 3±0.0 9 2.0 9±0.1 9△ 1.7 6±0.1 1△E M O 处理组 6 1.3 2±0.0 9*1.6 8±0.0 7* 1.4 7±0.0 5*
3 讨 论
缺氧导致的血管内皮细胞结构和功能受损是促进多种心血管疾病的发生和发展的重要因素[10]。本实验通过体外建立细胞缺氧模型,模拟在体血管内皮细胞缺血缺氧环境,有利于排除其他在体因素的干扰,可以较为准确地研究缺氧单一因素对内皮细胞的影响。在缺氧条件下,可以通过多种途径使内皮细胞ROS产生增多[11-12]。ROS是细胞代谢过程中产生的一系列活性氧簇,ROS可通过半胱天冬氨酸蛋白酶、溶酶体蛋白酶或是内切核酸酶引起3种类型的程序性细胞死亡,分别是细胞凋亡、自噬和细胞焦亡[13]。细胞焦亡作为一种程序性的细胞死亡方式,主要通过激活NOD样受体(NLRs),尤其是NLRP3炎性小体而发挥作用。在细胞缺氧后,细胞内产生的ROS激活NLRP3炎性小体,激活的NLRP3炎性小体一方面可以激活IL-1β,进而引起细胞焦亡加重细胞损伤。
大黄素作为蒽醌衍生物可以使胞浆中Ca2+浓度降低和 ROS 的产生[14],减少 Caspase-1 和 IL-1β 的活化,减轻细胞焦亡,减轻细胞损伤。目前有学者认为,Caspase-1的激活是IL-1β活化以及焦亡发生的关键步骤,但是Caspase-1是如何激活IL-1β和焦亡,目前尚未见文献报道。本研究结果表明,与正常氧浓度培养的细胞相比,细胞在缺氧条件下,ROS产生增加,进而激活Caspase-1前体蛋白,活化的Caspase-1剪切加工IL-1β,进而使IL-1β活化,导致细胞焦亡增加。缺氧细胞进过大黄素处理后,细胞内ROS水平下降,Caspase-1和IL-1β活化减少,细胞焦亡减少,损伤减轻。
综上所述,本研究结果表明缺氧诱导焦亡发生,而大黄素可以通过抑制缺氧细胞ROS的产生,抑制NLRP3炎性小体和Caspase-1活化,减少焦亡发生。本研究结果提示,大黄素对缺氧血管内皮细胞有保护作用,可以减少血管内皮细胞损伤,进而发挥其对心血管疾病的防治作用。

