3M PetrifilmTM 快速测试片与国标法检测饮料中霉菌和酵母的比较
周锦祯,徐红,陈玲,刘婷婷,郭伟鹏
(1.华南应用微生物国家重点实验室;广东省菌种保藏与应用重点实验室;广东省微生物应用新技术公共实验室;广东省微生物分析检测中心;广东省微生物研究所,广东广州 510070)
(2.乐百氏(广东)食品饮料有限公司中心实验室,广东中山 528400)
霉菌和酵母广泛分布于自然界,如空气、水和土壤。其中有些霉菌和酵母对人类是有益的,常被用于酿造、发酵食品等工业。但在某些情况下,霉菌和酵母也可造成食品腐败变质,有的还能产生真菌毒素。因此,霉菌和酵母是评价食品卫生质量的指示菌。
近年来,饮料工业发展迅速,功能性饮料更是保持较高的增长速度, 获得较大发展[1]。饮料作为一种特殊的食品,由于防腐剂的限量加入,以及受限于生产杀菌工艺,易受微生物污染,尤其是霉菌与酵母,会导致饮料变质,如变色、沉淀,浑浊和涨罐等,其污染的来源来自于原料、设备、车间环境[2,3]等等。因此,加强对饮料中霉菌和酵母的监控显得尤为重要。3M PetrifilmTM快速测试片微生物检测产品作为微生物快速检测技术之一,在全球食品检测领域得到广泛使用。其中3M PetrifilmTM快速霉菌酵母测试片可用于食品和饮料行业中的霉菌和酵母的计数,与传统的方法相比其培养时间由5 d缩短为48 h,特别适合大批量样品食品样品中的快速检测,由于没有培养基消毒与配置环节,操作程序也更加简便,有助于提高微生物实验质量和提高工作效率[4~6]。但由于其不是我国食品微生物检验的国家标准,所以也无法在检测机构和食品企业中得到大规模的应用。本实验选择白色念珠菌(Candida albicans)、拟热带假丝酵母(Candida tropicalis)、汉逊德巴利酵母(Debaryomyces hansenii)、绿木霉(Trichoderma virens)、炭黑曲霉(Aspergillus carbonarius)5个标准菌株,分别采用3M PetrifilmTM快速测试片法(以下简称:测试片法)和国标法对某维生素饮料进行霉菌和酵母计数试验,结果用以验证3M PetrifilmTM快速测试片法(以下简称:测试片法)的重复性、特异性及其与国标法的比较试验,以确认两种方法是否存在显著性差异,为企业建立快速测试片法作为日常监控霉菌和酵母的检测方法。
1 材料与方法
1.1 材料
1.1.1 样品
市售某功能维生素饮料。
1.1.2 培养基
3M PetrifilmTM快速霉菌酵母测试片,美国3M公司生产;马铃薯葡萄糖琼脂培养基(PDA),由广东环凯微生物科技有限公司生产。
1.1.3 实验菌种
通过筛选实验选择可在某饮料产品中存活的霉菌或酵母,最终确认选取以下菌株进行本次实验:标准菌株:白色念珠菌Candida albicans(ATCC 10231)、拟热带假丝酵母Candida tropicalis(GIM 2.112)、汉逊德巴利酵母Debaryomyces hansenii(GIM 2.184)、绿木霉 Trichoderma virens(GIM 3.548)、炭黑曲霉Aspergillus carbonarius(GIM 3.146),以上菌株均来源于广东省微生物菌种保藏中心(国家专利菌种保藏平台)。分离菌株(来源:乐百氏(广东)食品饮料有限公司中心实验室):蜡样芽孢杆菌 Bacillus cereus(Wild Type)、坚强芽孢杆菌Bacillus firmus (Wild Type)、枯草芽孢杆菌Bacillus subtilis(Wild Type)。
1.1.4 实验设备及材料
恒温培养箱、恒温水浴箱、振荡器、微量移液器及无菌吸头、无菌锥形瓶、无菌培养皿、无菌试管等均购自广东环凯微生物科技有限公司。
1.2 试验方法
1.2.1 菌株适用性试验
将试验菌株白色念珠菌Candida albicans(ATCC 10231)、拟热带假丝酵母 Candida tropicalis(GIM 2.112)、汉逊德巴利酵母Debaryomyces hansenii(GIM 2.184)、绿木霉 Trichoderma virens(GIM 3.548)、炭黑曲霉Aspergillus carbonarius (GIM 3.146)制成一定浓度的菌悬液加入100 mL样品饮料中,制成终浓度为10~150 CFU/mL的样品,放置于28 ℃培养箱中培养5 d,观察结果,以验证样品对所测试菌株是否有生长抑制性。
1.2.2 重复性试验
实验参照SN/T1800-2006食品和动物饲料微生物学30 ℃菌落计数方法中重复性要求进行快速测试片法检测霉菌和酵母的实验,对结果进行分析。
重复性:使用相同方法,由同一操作者使用同一设备在短时间内的两次独立的单次试验结果的绝对差值,不应大于重复性限,r=0.25,以10为底的每毫升中微生物计数的对数。
检验结果解释:第一结果:105=100000,第一结果和第二结果之间的差值不应大于0.25 log10单位,第二结果:log104.7=56000或log5.25=17800。如果第一结果不低于56000或不高于178000,则第一结果和第二结果之间是差值是可以接受的。
方法:将试验菌株制成一定浓度的菌悬液,加入100 mL样品饮料中,制成终浓度为10~150 CFU/mL的待测样品。用测试片法对加标样品进行霉菌和酵母的检测,每个样品由同一操作者使用同一设备在短时间内进行两次独立的单次试验,分析结果。
1.2.3 快速测试片对所选菌株的的特异性试验
试验使用芽孢、霉菌、酵母分别制成单一菌悬液或混合菌悬液使用测试片法进行霉菌计数和酵母计数的检测,同时使用平板计数方法进行检测,对结果进行分析。试验中所选用的芽孢菌株:蜡样芽孢杆菌(Bacillus cereus (Wild Type)、强壮类芽孢杆菌Paenibacillusehimensis(Wild Type)、枯草芽孢杆菌Bacillus subtilis(Wild Type),主要是考虑产品中或生产环境中可能出现的菌。霉菌和酵母制备出低浓度水平(10~150 CFU/mL)的菌悬液,芽孢制备成高浓度水平(100~1500 CFU/mL)的菌悬液。
1.2.4 比较试验
将试验菌株制成一定浓度的菌悬液,加入100 mL饮料中,制成终浓度为10~150 CFU/mL的待测样品。使用测试片法和国标检验方法GB 4789.15-2016 第一法[6]分别对样品进行霉菌计数和酵母计数检测,每个样品分别使用两种方法重复检测10次,培养计数,使用F检验、t检验统计分析两种检测方法结果间的差异。
测试片法:按产品使用操作说明,取1 mL待测样品置于快速测试片中,置于25 ℃培养,观察结果。
国标法:按国标操作方法,取1 mL待测样品于平皿内,倾注马拉松葡萄糖琼脂,置于 28 ℃培养,观察结果。
结果统计分析[7]:试验结果用SPSS软件进行统计,给定显著性水平α(本实验α=0.05)后,SPSS软件中的统计决策通过以下两步完成:
第一步,利用F检验判断两总体的方差是否相等,并据此决定抽样分布方差和自由度的估算方法和计算结果。如果F检验统计量的概率p值(显著性sig值),小于显著性水平α(0.05),则应拒绝原假设,认为两总体方差有显著差异,反之,如果概率p值大于显著性水平α(0.05),则不应拒绝原假设,认为两总体方差无显著差异。
第二步,利用t检验判断两总体均值是否存在显著性差异,如果t检验统计量的概率p值(显著性sig值),小于显著性水平α(0.05),则应拒绝原假设,认为两总体均值有显著差异,反之,如果概率p值大于显著性水平α(0.05),则不应拒绝原假设,认为两总体均值无显著差异。
2 结果与分析
2.1 菌株适用性试验结果
由表1知,白色念珠菌Candida albicans(ATCC 10231)、拟热带假丝酵母Candida tropicalis(GIM 2.112)、汉逊德巴利酵母Debaryomyces hansenii(GIM 2.184)、绿木霉Trichoderma virens(GIM 3.548)、炭黑曲霉Aspergillus carbonarius(GIM 3.146)在该饮料中25 ℃培养5 d后,加入酵母的样品呈浑浊生长,经镜检为酵母,加入霉菌的样品有白色絮状物生长,经镜检为霉菌菌丝,结果表明所测试菌株均能在样品中生长良好,样品对所选菌株无生长抑制性。

表1 菌株预选试验结果Table 1 Strain preselection test results
2.2 测试片法重复性试验结果
由表2可知,参照SN/T1800-2006食品和动物饲料微生物学30 ℃菌落计数方法中重复性要求,同一操作者使用快速测试片对样品饮料使用同一设备在短时间内进行两次独立的单次试验,结果表明第二次测试的结果均在第一次的可接受范围内,则第一次结果和第二次结果之间的差值是可以接受的。

表2 重复性试验结果Table 2 Repeatability test results
2.3 测试片法对所选菌株的的特异性测试结果
由表3测试结果可知,对所选择的菌株进行测试,所添加的高浓度芽孢等细菌均不会对快速测试片进行霉菌和酵母的检测造成明显的干扰,测试片法具有较强特异性。

表3 特异性测试结果Table 3 Specificity test results
2.4 比较试验结果
由表4可知,用测试片和国标法分别对添加菌液的样品进行霉菌和酵母计数检测,每个样品分别使用两种方法重复检测10次,培养计数,试验结果用SPSS软件进行统计,给定显著性水平α(本实验α=0.05)后,实验结果F检验统计量的概率p值(显著性sig值)分别为:0.475、0.451、0.312、0.291、0.436,均大于显著性水平α=0.05,不能拒绝方差相等的假设;方差相等时,t检验的相伴概率sig值分别为:0.384、0.116、0.155、0.675、0.059,均大于显著性水平α=0.05,不能拒绝t检验的零假设,表示两种方法总体均值无显著差异。
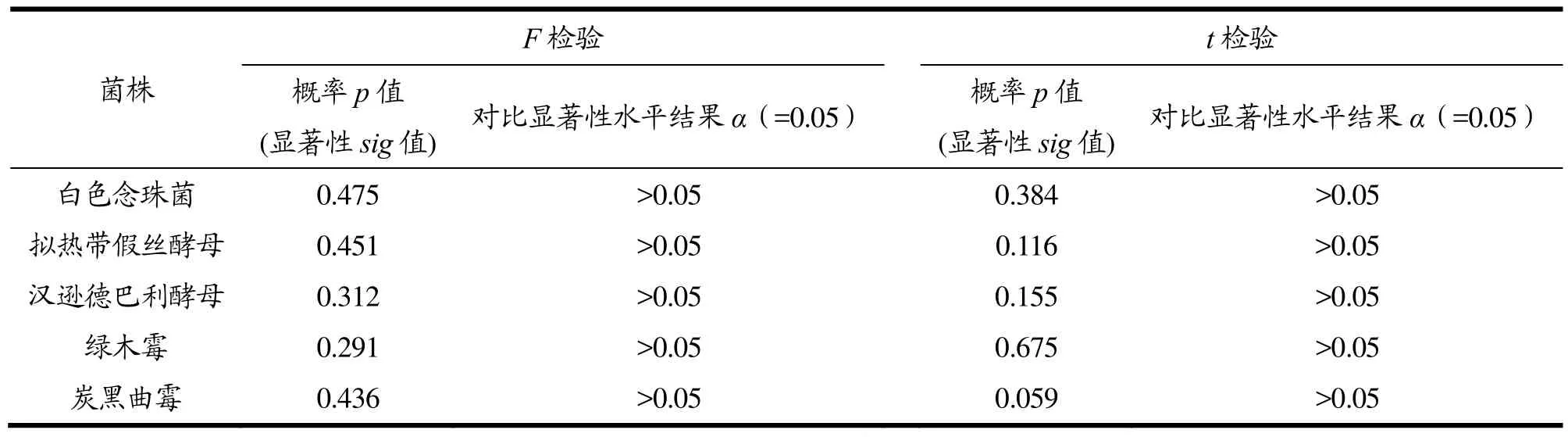
表4 F检验和t检验的试验结果Table 4 F test and t test results
3 结论
3.1 通过应用测试片法与国标法对白色念珠菌、拟热带假丝酵母、汉逊德巴利酵母、绿木霉、炭黑曲霉等菌株进行试验所得数据进行F检验、t检验统计分析,结果显示两种方法无显著性差异。本实验所用酵母和霉菌测试片,其培养基含有作为载体的冷水可溶性凝胶和对霉菌和酵母敏感的指示剂(5-溴-4-氯-3吲哚基-磷酸盐),与酵母、霉菌在培养生长过程中发生特异性显色反应,通过生长特征和颜色变化来判定霉菌和酵母的种类和数量。另外还添加氯四环素、氯霉素抑制细菌生长,酵母菌落特征为灰白色到兰绿色,较小,边缘清晰,菌落隆起,菌落颜色较为均匀一致,没有暗色中心。霉菌菌落特征为通常为兰绿色,但是也会呈现它们本身的颜色(如黑、黄、绿),以霉菌产生不同色素而定,较大,菌落扁平,边缘不清晰,有扩散,通常菌落中心颜色深暗。快速测试片检测霉菌,不易蔓延和重叠,有效地提高了判读的简便性,且可同时评估霉菌和酵母,也可以通过区别菌落形态的不同来单独监控这两种真菌。但测试片法具有一定的局限性,因测试纸片面积较小,当菌落大于250 CFU时,准确计算较困难;在48 h的时候查看酵母和霉菌结果,某些生长缓慢的酵母和霉菌可能在 48 h的时候表现模糊,为了强化判读,可以额外增加12 h的培养时间;待测样品中含有的某些有机物可能使显色减缓,使目视效果下降导致计数偏低;价格昂贵等等,这些都是值得引起注意与探讨的[8,9]。但总体而言,快速微生物测试片已经通过国际组织AOAC的认可[10],许多研究也显示快速微生物测试片与传统方法相比在统计学上无显著性差异[11~14]。
3.2 本实验菌株预选试验中白色念珠菌(Candida albicans)、拟热带假丝酵母(Candida tropicalis)、汉逊德巴利酵母(Debaryomyces hansenii)、绿木霉(Trichoderma virens)、炭黑曲霉(Aspergillus carbonarius),在该饮料中28 ℃培养5 d,均能生长良好,导致饮料浑浊或产生絮状物。果汁饮料发生变质而出现浑浊除了由化学因素引起除外,大多数由微生物污染而造成,特别是酵母以及霉菌,其中一些可能由耐热性的霉菌造成的,微生物引起的果汁饮料变质通常会出现浑浊,产生和导致有机酸的变化[15],一些霉菌(如青霉,雪白丝衣霉等)可在短时间(14 d内)将维生素饮料中维生素B3消耗殆尽[16]。
3.3 对于定量微生物检验方法,方法的特异性、灵敏度、相对真实度、阳性偏差、阴性偏差、重复性、再现性以及可变范围内的检验局限性都应予以考虑。本研究中主要考虑了特异性和重复性。在重复性试验中,参照SN/T1800-2006食品和动物饲料微生物学30 ℃菌落计数方法中重复性和复现性要求进行快速测试片法检测霉菌和酵母的实验结果进行分析,李志培等[17]就提出无论是理论计算或试验检测,会发现重复性限的范围是很宽的,所以对数据的要求并不高或不严格,可以根据实际情况采取等效的,更严格的控制方法和标准。
3.4 在特异性试验中筛选的主要是考虑产品中或生产环境中可能出现的菌。如需深入研究其特异性,需增加更多数量的目标菌。

