白乌鱼胴体粘液中耐热菌的耐热性及特征菌种鉴定
张龙翼,张崟,陈平平,陈婷婷,方鉴宇,王林果,柯欢,熊伟
(成都大学肉类加工四川省重点实验室,四川成都 610106)
鱼类的皮肤上皮组织中分布有大量粘液细胞,在应激条件下可分泌粘液于体表[1],构成对外界威胁的有效防护屏障,起到保护鱼体免遭外界环境中的病菌、寄生物和病毒侵袭等重要作用[2]。Smith等[3]对虹鳟鱼的体表粘液特性研究,认为虹鳟鱼体表粘液是不同于鱼体血液的另外一种免疫系统。Guo等[4]发现大鲵皮肤的黏液具有毒性,低剂量注射小鼠可致其出现水肿或痛觉,经腹腔给药可致小鼠死亡。Lobb等[5]从羊头鲷皮肤粘液中,分离出了2种形式的免疫球蛋白。我们课题组在对白乌鱼胴体粘液进行初步分析时发现,白乌鱼胴体粘液在经过煮沸处理后,其中仍然存在部分微生物[6],但未对这些微生物进行分离鉴定。鉴于耐热微生物关系到后期烹调或加工鱼肉产品的质量安全,所以有必要进一步明确白乌鱼胴体粘液中的耐热微生物种属。
白乌鱼(Opniocepnalusargusvar kimnra)是我国自主培育的珍稀淡水鱼种,其肉质细嫩,营养丰富,除具有较高的食用价值外,还具有一定的药用和观赏价值,未来市场潜力巨大[7]。目前,国内外对白乌鱼胴体粘液中的功效成分、微生物等方面研究相对较少。由于白乌鱼宰杀后,其表面有较多粘液,而且其中还存在能耐高温的微生物,所以如果不对其中的微生物进行分离鉴定,不仅会引起烹调或精深加工产品的食用安全隐患,而且可能会使粘液中的一些功能性微生物随着粘液的废弃而浪费。此外,微生物通常能产生酶和功能性蛋白质,但是大部分微生物的耐热性不高[8],尤其在微生物作为酶使用的时候,耐热性更加重要。因此,为了进一步分析白乌鱼胴体粘液中的特征微生物的生物特性,本文对白乌鱼胴体粘液的特征菌进行了分离纯化,并对特征菌进行了鉴定。
1 材料与方法
1.1 仪器与材料
1.1.1 实验设备
实验所用的主要仪器有THZ-98C恒温振荡器(上海一恒科学仪器有限公司);HH-6数显恒温水浴锅(常州澳华仪器有限公司);LE104E/02电子天平(梅特勒-托利多(上海)有限公司);SHB-Ⅲ型循环水式多用真空泵(北京科伟永兴仪器有限公司);智能型电热恒温鼓风干燥箱(上海琅玹实验设备有限公司);标准型超纯水机(四川沃特尔水处理设备有限公司);无菌操作台(苏州市金净净化设备科技有限公司);SPX-80型生化培养箱(北京科伟永兴仪器有限公司);UV756CRT紫外可见分光光度计(上海佑科仪器仪表有限公司);YM75ZI智能型不锈钢立式电热压力蒸汽灭菌器(上海三申医疗器械有限公司);XW-80A旋涡混合器(江苏海门市麒麟医用仪器厂);FR980凝胶成像仪(上海复日科技仪器有限公司);2720 thermal cycler PCR仪、3730XL测序仪(Applied Biosystems)。
1.1.2 实验材料
新鲜白乌鱼购自成都市龙泉驿区三联汽车城水产市场;蛋白胨购自北京奥博星生物技术有限责任公司;琼脂粉购自成都金山化学试剂有限公司;酵母提取物购自广州市华粤瑞科科学器材有限公司;氯化钠(分析纯)购自成都科龙化工试剂厂;Ezup柱式细菌基因组DNA抽提试剂盒(SK8255)、SanPrep柱式DNAJ胶回收试剂盒(SK8131)、dNTP购自生工生物工程(上海)股份有限公司。
1.2 实验方法
1.2.1 白乌鱼胴体粘液的收集
参考张龙翼等[6]的白乌鱼胴体粘液的收集方法。新鲜白乌鱼用自来水暂养,间隔半小时换一次水,连续3次,宰杀后刮去鱼鳞,然后用乳胶手套轻捋其体表,让粘液流入灭菌后的器皿中,分装后4 ℃保存备用。
1.2.2 白乌鱼胴体粘液的耐热性分析
取6份白乌鱼胴体粘液5 mL于离心管中,将其中5份离心管分别放在30 ℃、50 ℃、70 ℃、90 ℃、煮沸条件下热处理20 min。将0.5 mL纯水、0.5 mL新鲜粘液、0.5 mL 30 ℃处理粘液、0.5 mL 50 ℃处理粘液、0.5 mL 70 ℃处理粘液、0.5 mL 90 ℃处理粘液、0.5 mL煮沸处理粘液分别均匀接种到灭菌后的LB固体培养基中,再放入生化培养箱中,在 37 ℃恒温培养24 h,观察菌落生长状况,每组平行3次。
1.2.3 特征菌分离及形态观察
按无菌操作用接种环分别挑取3种单菌落进行多次平板划线培养,直至获得纯培养物,编号保藏于4 ℃冰箱。观察各菌株的平板菌落特征,以及在显微镜下菌体形态和染色特征。
1.2.4 菌株耐热性分析
以无菌操作挑取菌株,接入LB液体培养基静止培养24 h作种子液,分别取盛有50 mL无菌LB液体培养基的250 mL三角瓶5个,用1 mL无菌吸管分别准确吸取1 mL种子液加入5个三角瓶中,于37 ℃下恒温培养24 h后,放入高压灭菌锅中,分别在100 ℃、105 ℃、110 ℃、115 ℃、121 ℃温度下处理20 min,然后分别取0.5 mL均匀接种到灭菌后的LB固体培养基中,再放入生化培养箱中,在37 ℃恒温培养24 h,观察菌株生长状况,每组平行3次。
1.2.5 微生物生长曲线测定
以无菌操作分别挑取菌株,接入LB液体培养基静止培养18 h作种子液。分别取盛有50 mL无菌LB液体培养基的250 mL三角瓶16个,分别编号为0 h、0.5 h、1 h、1.5 h、2 h、3 h、4 h、6 h、8 h、10 h、12 h、14 h、16 h、18 h、20 h、24 h。用2 mL无菌吸管分别准确吸取2 mL种子液加入已编号的16个三角瓶中,于 37 ℃下振荡培养,分别按对应时间将三角瓶取出,测定OD600值。以时间为横坐标,OD600值为纵坐标,绘制生长曲线。
1.2.6 16S rDNA 鉴定
按SK8255试剂盒说明方法进行DNA提取。细菌16S rDNA引物为27F(5'-AGTTTGATCMTGGCTCAG-3')和 1492R(5'-GGTTACCTTGTTACGACTT-3')。采用16S rDNA 引物进行PCR 扩增。采用25 μL PCR扩增反应体系:10×PCR Buffer 2.5 μL,dNTP 1 μL,Taq酶(5 U/μL)0.2 μL,模板0.5 μL,16S(F)和16S(R)各0.5 μL,加双蒸水补足到25 μL。PCR 循环条件为94 ℃,4 min;20循环(94 ℃,45 s;55 ℃,45 s;72 ℃,1 min),72 ℃ 10 min,4 ℃保温。采用质量分数为1%琼脂糖电泳,150 V、100 mA 20 min电泳观察。PCR产物电泳条带切割所需DNA目的条带,根据SanPrep柱式DNA胶回收试剂盒(SK8131)说明书的详细步骤进行PCR产物的回收纯化。得到序列信息后登陆美国国家生物技术信息所(national center for biotechnology information,NCBI)页面,利用局部相似性基本查询工具(basic local alignment search tool,BLAST)对比分析所测得的序列和GenBank中现有细菌的16S rDNA序列,挑选相似性序列。
1.2.7 数据分析
利用EXCEL 2016对数据进行统计分析,并绘图。
2 结果与讨论
2.1 热处理后白乌鱼胴体粘液的变化
由于要对鱼体粘液中的杂菌进行热处理去除,所以必须对粘液进行加热。通过不同加热温度处理后的鱼体粘液见图1。图1显示,未加热鱼胴体粘液呈现淡红色,随着加热温度上升,鱼体粘液由淡红色逐渐变为淡绿色。这与我们之前报道的白乌鱼体粘液加热后的颜色变化状况一致[6]。
未加热处理的鱼胴体粘液呈淡红色,这可能是鱼在宰杀去鳞后收集粘液时,带入了一些鱼体血液所致;但是经过不同加热温度处理后的鱼胴体粘液,其颜色由淡红色逐渐变为淡绿色。血液受热通常会变成暗紫色[9],但是在粘液中的血液受热后却变为淡绿色。这与我们之前的研究现象相同[6]。对引起这一颜色变化的原因还有待进一步研究确定。

图1 热处理后鱼胴体粘液的外表特征Fig.1 Appearance of fish carcass mucus after heat treatment
2.2 热处理粘液中的微生物分析

图2 鱼胴体粘液的耐热性比较Fig.2 Comparison of heat resistance of fish carcass mucus
在对粘液热处理基础上,取0.5 mL粘液,在LB固体培养基中于37 ℃恒温培养24 h,观察微生物的生长状况(见图2)。由图2可知,随着加热温度增加,粘液中的微生物种类呈明显减少趋势。通过比较不同温度下粘液中的微生物种类发现,粘液中主要有3种菌落(命名为 S1、S2、S3),而且在 50 ℃处理粘液的培养基中有S2和S3,而在70 ℃、90 ℃和煮沸粘液的培养基中,只生长了S3,空白组中无菌落生长。
由图2中不同温度处理粘液在培养基上微生物生长状况及空白对照可知,培养基中所生长的菌落并非空气中的杂菌,而是鱼体粘液中自带微生物。由培养基中微生物种类随温度变化情况可知,50 ℃热处理导致S1菌死亡,S2和S3菌能耐50 ℃的高温处理;S3菌最耐热,在煮沸(96 ℃)温度下仍然可以存活,这与我们之前的研究结果相符[6]。
2.3 粘液中3种特征菌的分离及形态学观察

图3 平板划线培养Fig.3 Streak plate culture
为了分析粘液中3种特征菌的生物特性,对3种单菌落经过平板划线进行分离纯化(见图3)。图中的三种微生物形态显示,所分离得到的S1、S2和S3菌株无杂菌污染,分离效果好。通过观察各菌株的平板菌落特征,以及染色后在显微镜下观察菌体形态,发现S1菌株革兰氏染色呈阴性,菌体球杆状,在LB固体培养基上菌落呈微黄色,边缘整齐,表面光滑、湿润;S2 菌株革兰氏染色呈阳性,菌体球状,在LB固体培养基上菌落呈金黄色,边缘不整齐,表面粗糙、湿润有光泽;S3菌株革兰氏染色呈阳性,菌体杆状,在LB固体培养基上菌落呈白色,边缘不整齐,表面粗糙、不透明。S1、S2和S3菌株特征描述见表1。
2.4 特征菌生长曲线

图4 微生物生长曲线图Fig.4 Microorganism growth curve
为了进一步分析耐热菌的生物特性,对耐 50 ℃以上的菌株S2和S3的生长曲线进行了测定,结果见图4。图4a中数据显示,0~2 h为菌株S2的生长停滞期,细菌数量极少;2 h以后进入对数生长期,菌体数量急剧增多;14 h达到生长最高峰,12~14 h为菌株S2的生长稳定期,菌体生长缓慢;14 h之后细菌数量开始减少,菌株S2进入衰亡期。图4b中数据显示,0~1.5 h为菌株S3的生长停滞期,细菌数量极少;1.5 h以后进入对数生长期,菌体数量急剧增多;16 h达到生长最高峰,12~16 h为菌株S3的生长稳定期,菌体生长缓慢;16 h之后菌株S3进入衰亡期。
由于微生物生长曲线可表示细菌从开始生长到死亡的全过程动态,对于研究微生物生理和工业发酵具有重要指导意义。由图4中菌株S2和S3的生长曲线可知,菌株S2的对数生长期和衰亡期菌落数变化均较菌株S3快速。

表1 特征菌的形态特征Table 1 Morphological characteristics of characteristic bacteria
因此,在菌株S2培养过程中,应严格控制OD600值。根据图4的生长曲线可知,对于菌株S2,采用12~14 h的菌液作为菌种较为合适;对于菌株S3,采用12~16 h的菌液作为菌种较为合适。这个阶段下的菌株,既可以保持高的细胞活力,又可获得多的细胞数。
2.5 菌株S3耐热性比较
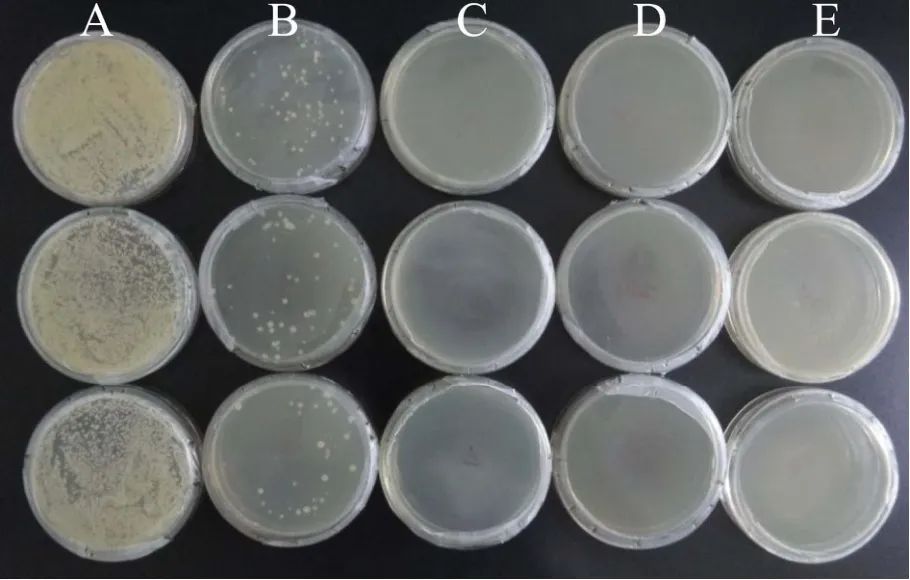
图5 不同温度处理下菌株S3耐热性比较Fig.5 Comparison of heat resistance of strain S3 under different temperature treatment
为了进一步分析菌株S3的最高耐热温度,取0.5 mL菌液,分别在100 ℃、105 ℃、110 ℃、115 ℃和121 ℃处理,然后分别接种到LB固体培养基中,再放入生化培养箱中于37 ℃恒温培养24 h,观察菌株 S3的生长状况(见图 5)。由图可知,100 ℃和105 ℃处理菌液的培养基中生长出了菌株 S3,而110 ℃、115 ℃、121 ℃处理菌液的培养基中无菌落生长。由图5中不同温度处理下菌株S3的生长状况可知,菌株S3是一种能耐受105 ℃高温高压处理20 min的耐热菌,当温度达到110 ℃时,菌株S3不能存活。因此,菌株 S3可作为物化性质类似白乌鱼粘液,且中心温度为105~110 ℃物料杀菌工艺的对象菌(指示菌),以衡量某杀菌工艺是否彻底。同时,图5的杀菌结果显示,白乌鱼体粘液即使在高温煮沸处理下,其中仍有活菌存在。因此,有必要对粘液中的微生物种属进行鉴定,以明确其是否为有害菌。
2.6 粘液中特征菌的种属鉴定
微生物的16S rDNA结构具有保守性,能反应出生物物种的亲缘关系,为生物系统的进化提供线索,也是生物物种的特征核苷酸序列。目前,16S rDNA序列分析已经成为细菌系统分类研究中最有力也是最常用的工具。通过对S1、S2和S3菌的16S rDNA进行PCR扩增,并对所得16S rDNA片段进行电泳分析,所得结果见图6。从电泳结果可知,3种菌株PCR扩增产物的分子量均为1500 bp左右。用PCR引物对PCR产物进行测序。对测序获得的菌株S1、S2和S3的16S rDNA序列,利用NCBI进行BLAST 序列相似性检索,结果见表2。

图6 16S rDNA PCR扩增产物的电泳结果Fig.6 Electrophoretic results of 16S rDNA PCR amplification products
通常在种的分类等级上,若两个分类单位间的16S rDNA序列的同源性高于97.5%,则可把这两个分类单位归于同一个种[10]。根据表2中16S rDNA序列分析结果可知,菌株S1属于不动杆菌属(Acinetobactersp.),与pittii不动杆菌(AcinetobacterpittiiStrain)的一致性为 100%;菌株 S2属于嗜根考克氏菌属(Kocuriarhizophilasp.),与嗜根考克氏菌(KocuriarhizophilaStrain)的一致性为99%;菌株S3属于芽孢杆菌属(Bacillussp.),与枯草芽孢杆菌(Bacillus subtilisStrain)的一致性为99%。因此,白乌鱼胴体粘液中的高耐热菌为枯草芽孢杆菌。鉴于枯草芽孢杆菌是需氧菌,少量存在对人体不仅无害,而且还有一定的抑菌效果,而pittii不动杆菌、嗜根考克氏菌具有潜在食品安全风险,所以对于白乌鱼的食用,应高温烹调后再食用较好。
此外,不动杆菌属细菌具有代谢多样性,产生的生物表面活性剂可以降解己内酰胺、除草剂、有机磷农药和多种石油烃组分等,在未来非常有希望应用于石油烃的修复工程[11]。嗜根考克氏菌属是药敏实验的常用靶菌之一[12],是一种可以产电的微生物,对改善和提高微生物燃料电池(Microbial fuel cells,MFCs)的产电性能具有重要意义[13]。芽孢杆菌属对水产中的有害微生物有很强的抑制作用,在鱼类养殖和鱼类疾病防治方面表现出广阔的应用前景。

表2 16S rDNA鉴定结果Table 2 16S rDNA identification results
3 结论
通过比较热处理后白乌鱼胴体粘液的外表特征,发现新鲜白乌鱼胴体粘液呈淡红色,随着处理温度的升高逐渐呈淡绿色。比较鱼胴体粘液的耐热性,发现接种了 30 ℃热处理粘液的培养基有三种菌落(S1、S2和 S3),接种了 50 ℃热处理粘液的培养基有 S2和S3两种菌,而接种了70 ℃、90 ℃和煮沸处理粘液的培养基,只生长了S3菌,空白组中无菌落生长。比较粘液中3种特征菌的形态特征,发现S1为革兰氏阴性菌,S2和S3为革兰氏染色阳性菌。比较菌株S3的耐热性,发现菌株S3在105 ℃高压灭菌锅中处理20 min之后仍能存活。通过测定菌株S2和S3的生长曲线,发现菌株S2、S3分别在培养14 h、16 h时达到生长高峰。通过16S rDNA序列测序,发现菌株S1属于不动杆菌属(Acinetobactersp.);菌株S2属于嗜根考克氏菌属(Kocuriarhizophilasp.);菌株S3 属于芽孢杆菌属(Bacillussp.)。白乌鱼胴体粘液中的高耐热菌为枯草芽孢杆菌。

