固相萃取-超高效液相色谱-三重四极杆质谱法同时测定饲料中5种雌激素
房克艳,赵超敏,邓晓军,陈沁
(1.上海大学生命科学学院,上海 200444)
(2.上海出入境检验检疫局动植物与食品检验检疫技术中心,上海 200135)
雌激素是一种具有广泛生物学活性的类固醇化合物。如雌二醇、雌三醇等,具有促进和维持女性生殖器官和第二性征的生理作用,并对内分泌、心血管、代谢系统、骨骼的生长和成熟等均有明显的影响。另外,人工合成的雌激素,如己烯雌酚、己烷雌酚、双烯雌酚等,也具有干扰激素系统功能的作用。雌激素添加到饲料中可促进雌性动物排卵以提高发情动物的数量和受胎率;还具有促进动物生长和增加脂肪沉积等作用[1]。但是,饲料中雌激素类药物的滥用或违法使用,会导致动物性食品中雌激素的残留,从而对人类健康产生危害[2]。农业部发布的《食品动物禁用的兽药及其它化合物清单》(农业部公告第193号)中[3],明确禁止使用雌激素;欧盟的报告中也表明,激素类兽药残留不仅会扰乱人体内分泌、生长发育、免疫系统和生殖系统等方面的功能,还会直接危害人们的健康甚至生命[4]。
饲料是畜禽摄入外源性雌激素的主要途径,长期饲喂含有雌激素的饲料,会使其在畜禽体内累积。若人类食用含有雌激素的动物性食品,可扰乱人体的内分泌系统,导致女性性早熟、男性生育能力下降、女性乳腺癌和宫颈癌等[5,6]。因此,要加强饲料中雌激素的检测和监管。目前对于雌激素检测方法的报道,大多为动物性食品中[7,8]和环境中[9,10],而对于饲料中雌激素的检测方法相对较少。饲料中激素检测的方法主要有气相色谱-串联质谱法[11,12]、高效液相色谱法[13,14]、酶联免疫法[15]、液相色谱-串联质谱法[16,17]。气相色谱法在检测时需要对样品进行衍生化,操作繁琐、耗时长;高效液相色谱法和酶联免疫法的灵敏度低、选择性差、受基质影响相对较大;液相色谱-串联质谱的方法分析范围广、选择性好、灵敏度高、分析结果可靠,既可定性、又可定量,是对饲料中雌激素进行快速检测分析的首选方法。对饲料中兽药的检测,目前报道最多的为雌酮,己烯雌酚,雌三醇等[10,14,18],未见有对饲料中双烯雌酚、己烯雌酚、己烷雌酚、17α-雌二醇和17β-雌二醇5种激素同时检测的报道。本文采用简单快速的固相萃取方法对饲料样品进行净化,通过优化提取和净化的前处理过程,提高回收率,降低基质效应;同时,还优化了液相色谱条件,使17α-雌二醇与同分异构体17β-雌二醇实现良好分离,建立了灵敏度高,准确、可靠的饲料中雌激素的检测方法。
1 材料与方法
1.1 仪器与试剂
超高效液相色谱配QTRAP6500质谱,购自美国AB Sciex公司;漩涡振荡器,购自德国Heidolph公司;Supelco固相萃取装置,购自美国Supelco公司;Athena C18-WP色谱柱色谱柱,购自上海安谱科学仪器有限公司;Poly-Sery Max(60 mg,30 mL)固相萃取柱,购自上海安谱科学仪器有限公司;往复式振荡器,购自日本Yamato公司;全自动氮吹仪,购自美国Caliper公司;低温离心机,购自美国Sigma公司;移液器,购自法国Gilson公司。
激素标准品:双烯雌酚(DE,纯度 96.6%)、己烯雌酚(DES,纯度 97.41%)、己烷雌酚(HEX,纯度 99.8%)、17α-雌二醇(α-E,纯度 99.7%)和 17β-雌二醇(β-E,纯度99.9%),均购自德国Dr.Ehrenstorfer公司;17β-雌二醇-D3(β-E-D3,纯度99.9%),购自美国o2si公司;己烯雌酚-D8(HEX-D8,纯度98.2%),购自加拿大TRC公司;乙醚、甲醇、三氯甲烷、叔丁基甲醚、乙腈和正己烷(HPLC级),均购自美国TEDIA公司;乙酸铵、三氯乙酸、无水氯化钠和氢氧化钠(分析纯),均购自国药集团化学试剂有限公司。
1.2 标准溶液的制备
储备液:分别准确称取双烯雌酚、己烯雌酚、己烷雌酚、17α-雌二醇、17β-雌二醇、己烯雌酚-D8和17β-雌二醇-D3各1.00 mg(精确到0.01 mg),以甲醇配制浓度为 100.0 mg/L的单标溶液,密封,于棕色瓶中-30 ℃储存。
单标中间工作液:分别移取0.1 mL100.0 mg/L的单标储备液,以甲醇配制浓度为1.0 mg/L的单标中间工作液,密封,于棕色瓶中-30 ℃储存,备用。
混合标准工作液:使用前分别移取一定量 1.0 mg/L的单标中间工作液,用甲醇配制为100.0 μg/L的混合标准溶液,密封,于棕色瓶中-4 ℃储存。用乙腈/水(1:1,V/V)配制 0,1.0,2.0,5.0,10.0 μg/L 浓度梯度的混合标准溶液,其中两种内标的添加浓度均为10.0 μg/L,现用现配。
1.3 仪器工作条件
1.3.1 色谱条件
Athena C18-WP色谱柱(2.1×150 mm,5 μm);柱温35 ℃;进样体积10 μL;流动相A为0.25‰氨水,B为100%乙腈;洗脱程序:0~3 min,35%~50% B;3.0~6.5 min,50%~55% B;6.5~7.0 min,55%~99%B;7.0~9.0 min,99% B;9.0~9.1 min,99%~50% B;9.1~10.0 min,50%~35% B,保持4 min,流速为0.30 mL/min。
1.3.2 质谱条件
电离模式:电喷雾电离负离子模式(ESI-);多反应监测(MRM);电喷雾电压(IS):-4500 V;雾化气压力(GS1):50 V;气帘气压力(CUR):35 V;辅助气流速度(GS2):60 V;离子源温度500 ℃;碰撞气(CAD):Medium;入口电压(EP):-10 V;其它条件见表1。

表1 5种雌性激素及两种内标的质谱参数Table 1 Mass spectrometry parameters for five estrogens and two internal standards
1.4 样品处理
称取5 g(精确到0.01 g)饲料样品于50 mL具塞塑料离心管中,准确加入100 μL 100.0 μg/L己烯雌酚-D8、和17β-雌二醇-D3内标,均质5 min,加入10 mL0.2 mol/L的乙酸铵缓冲溶液(pH=5.2±0.2),涡旋30 s。加入10 mL乙醚、700 μL 10%三氯乙酸,涡旋30 s,加入5.0 g无水氯化钠,涡旋30 s,振荡提取5 min,4500 r/min离心5 min,吸取乙醚层于另一试管中。乙醚重复提取一次,合并的乙醚相在常温下用氮气吹至近干。加入2 mL三氯甲烷溶解残余物,涡旋1 min,加入5 mL 1.0 mol/L氢氧化溶液,涡旋1 min,4500 r/min离心3 min,将上层水相移入另一试管中。氢氧化钠溶液重复提取一次,合并氢氧化钠溶液提取液,待净化。
1.5 净化
固相萃取柱使用前依次用5 mL甲醇、5 mL水活化,合并氢氧化钠提取液过固相萃取柱,依次用5 mL 1.0 mol/L氢氧化钠溶液和5 mL 0.1 mol/L氢氧化钠甲醇溶液/水(7:3,V/V)淋洗固相萃取柱,待溶液流过固相萃取柱后,减压抽干。加入5 mL 2%甲酸-叔丁基甲醚/甲醇溶液洗脱(9:1,V/V),收集洗脱液,流速均应控制在2 mL/min。洗脱液在低于40 ℃下,用缓和氮气流吹干,加入1 mL乙腈-水溶液(1:1,V/V)溶解残渣,加入1 mL乙腈饱和正己烷溶液,涡旋混匀30 s,转移至2 mL连盖塑料离心管中,于4 ℃ 15000 r/min离心3 min,取下层溶液过0.22 μm滤膜,待测定。
1.6 数据统计分析
数据处理采用Microsoft Excel 2010,图表的绘制采用GraphPad Prism 6和Origin 9.0软件。
2 结果与讨论
2.1 质谱条件优化
质谱条件均在兼顾所有目标化合物具有良好响应的情况下进行优化。将100.0 μg/L的单标准溶液用流动注射泵连续注射入质谱仪,分别在正、负离子模式下进行一级质谱全扫描,确定母离子。
将化合物的二级质谱丰度较高的两个碎片离子用于定性和定量(图1),再优化每一种化合物的DP、CE和CXP参数。
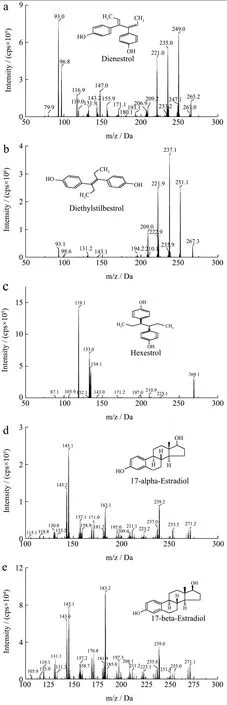
结果显示:5种雌激素在负离子模式下的质谱响应值更高。由于5种雌激素均具有羟基,呈现弱酸性,易脱氢在负离子模式下获得[M-H]-的准分子离子峰。因此,选择负离子模式进行电离。
图1 5种雌激素及2种内标的二级质谱图Fig.1 Product ion spectra of five estrogens and two internal standards
2.2 色谱条件优化
为实现5种雌激素的有效分离,在相同质谱条件下,流动相分别选择水-乙腈、水-甲醇。结果显示,用水-乙腈作为流动相,更有利于5种激素的离子化。在水相中添加一定量的氨水,有利于调节pH,改善峰形,由于5种雌激素呈现弱碱性,添加少量的碱性物质,有利于雌激素解离成离子状态,消除峰拖尾的现象。分别考察了氨水添加浓度为 0.10‰,0.15‰,0.20‰,0.25‰,0.30‰的效果。结果表明,添加浓度为0.10‰时,作用不明显;添加浓度在0.15‰~0.25‰范围内,随着氨水添加量的增多,峰型逐渐变窄且无拖尾现象;继续增加添加量时,峰形变化不明显,考虑到色谱柱的使用寿命,选择了0.25‰的添加浓度。由于17α-雌二醇和17β-雌二醇互为同分异构体,质谱条件相同,仅靠质谱条件无法实现有效分离,17α-雌二醇和17β-雌二醇的保留时间均在5~6 min,有机相所占比例在55%左右,且两个峰交接出现重叠,因此,必须优化色谱条件来获得良好的分离度。结果显示,通过优化流动相的洗脱梯度,能够实现两个峰的有效分离(图2)。另外,对比了流速为0.20 mL/min、0.25 mL/min、0.30 mL/min和0.35 mL/min的分离效果,确定流速为0.30 mL/min时的效果最佳。

图2 5种雌激素和2种内标的二级质谱提取离子流图Fig.2 MS/MS extraction ion spectra of the five estrogens and the two internal standards
2.3 样品的提取和净化方法的选择
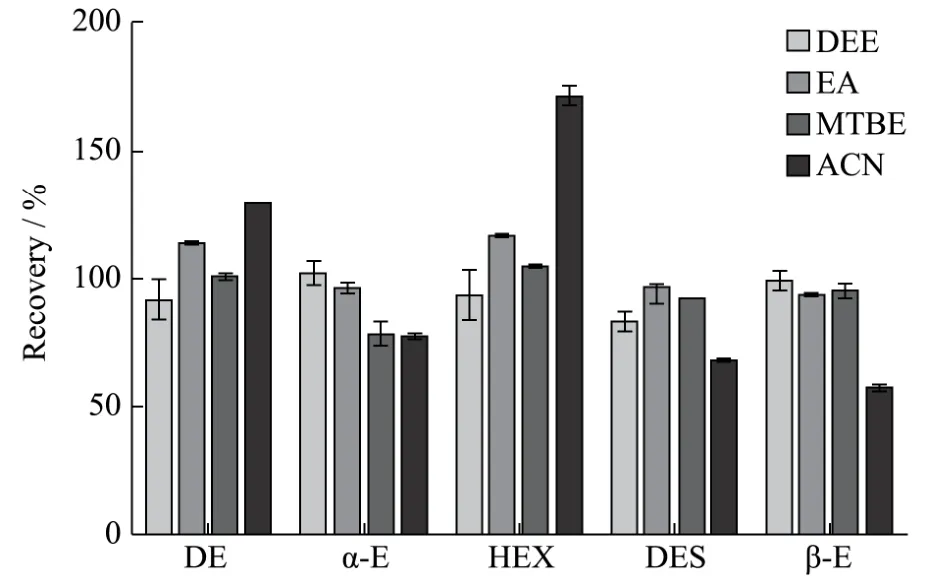
图3 不同提取溶剂对回收率的影响Fig.3 Effect of different extraction solvents on recovery
提取:由于5种雌激素在弱极性和中等极性的溶剂中均具有良好的溶解性,因此选择了乙醚(DEE)、乙酸乙酯(EA)、叔丁基甲醚(MTBE)和乙腈(ACN)作为提取溶剂进行提取。结果显示,以上4种溶剂的提取回收率分别在 85.80%~101.95%、92.86%~117.23%、75.14%~104.60%和 55.40%~174.20%(图3);乙醚和叔丁基甲醚除色素的效果良好;乙腈除蛋白能力稍强。但是,经叔丁基甲醚提取的样品,质谱响应值低,且峰形乱,表明提取时基质共提物较多;乙腈对17β-雌二醇和己烷雌酚的提取效果差,回收率低;乙酸乙酯提取液中基质共提物多,氮吹时不易吹干。考虑到回收率、基质效应和提取效率等综合效果,最终选择乙醚作为提取溶剂。
浓缩饲料、配合饲料、精料补充料等饲料中含有大量的蛋白质,如果不去除干净,不仅会产生沉淀物和气泡,堵塞固相萃取小柱,影响净化效果;而且会损伤仪器。考察了 500 μL、600 μL、700 μL、800 μL、900 μL和1000 μL 10%三氯乙酸除蛋白的效果。结果显示,当添加量为500 μL时,提取液中仍有絮状蛋白沉淀,堵塞萃取小柱,过柱困难;当添加量为600 μL时,提取液中有少量气泡,影响萃取效率;当添加量为900 μL及以上时,由于三氯乙酸添加量过多,使蛋白迅速沉淀、凝结,容易将目标物包裹在其中,导致雌激素的回收率低;添加量为700 μL和800 μL时,除蛋白效果差别不大,且前者目标物的回收率更高。因此,选择添加700 μL 10%三氯乙酸去除基质中的蛋白质。另外,对比了2 mL、5 mL、8 mL、10 mL、15 mL和20 mL的提取溶剂对回收率的影响。结果显示,除己烷雌酚外,提取溶剂体积在2~10 mL范围内,回收率均呈现上升的趋势,且10 mL、15 mL和20 mL之间对回收率的影响效果无明显差别(图4)。当提取溶剂体积低于10 mL时,己烷雌酚,质谱峰宽而乱,重复性差;当提取溶剂体积≥10 mL时,峰形明显改善,重复性好。因此,为节省溶剂和提高检测效率,选择提取溶剂体积为10 mL。
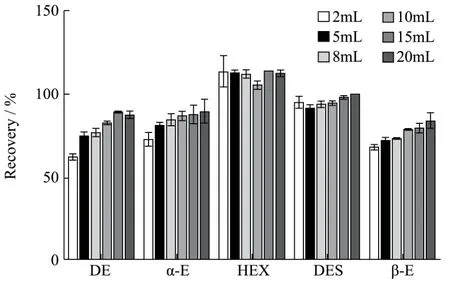
图4 不同体积提取剂对回收率的影响Fig.4 Effect of different volume extractants on recovery rate
净化方法:采用固相萃取的净化方法,分别用HLB和Max小柱对提取液进行净化。结果显示,HLB小柱对17α-雌二醇和17β-雌二醇有较好的净化效果,回收率在71.90%~116.30%范围内,但对其它3种雌激素的净化效果均不理想,峰宽且响应值低;而Max柱不仅能够良好的去除饲料基质中的色素和有机酸,而且对5种雌激素的净化效果好,过柱速度快,回收率均在76.30%~114.38%之间。因此,选择Max柱作为固相萃取小柱。
2.4 线性关系、检出限和定量限
按照1.2中的方法将混合标准溶液逐级稀释,配成系列混合标准工作液,按照本方法依次进行测定,以得到的目标物质的峰面积与加入内标的峰面积的比值为纵坐标(y),对应目标物质的浓度与内标物质的浓度的比值为为横坐标(x),绘制工作曲线。
由表 2可以看出,该方法的线性相关系数均在0.999以上,线性关系良好。以信噪比(S/N)≥10所对应的待测物浓度为该方法的定量限(LOQ),5种雌激素的LOQ均为1 μg/kg。

表2 5种雌激素的线性方程、线性范围、线性相关系数Table 2 Linear ranges, linear equations, correlation coefficients (r) of 5 compounds
2.5 回收率与精密度
单一植物源饲料、饲料添加剂、浓缩饲料、配合饲料和精料补充料空白样品,分别添加 1 μg/kg、2 μg/kg、5 μg/kg标准物质,按照1.4和1.5的方法对加标样品进行前处理和净化,每个水平平行测定6次,其加标回收率均在70.20%~114.37%之间,相对标准偏差为 0.15%~9.08%,保留时间的可变性小于 1%。该方法准确度和精密度符合饲料中激素残留检测的要求。

表3 5种雌激素的加标回收率和相对标准偏差Table 3 Recoveries and relative standard deviations (RSD, n=6) of five estrogens spiked in feed samples
2.6 实际样品分析
采用所建方法对法定监管的5种饲料分别抽取10个样品进行检测分析,均未检出上述5种激素。
3 结论
本文建立了饲料样品中17α-雌二醇、17β-雌二醇、己烷雌酚、己烯雌酚、和双烯雌酚的超高效液相色谱-三重四极杆质谱(UPLC-MS/MS)的方法。该方法简单、快速,灵敏度高;前处理净化效果好,能有效的降低基质效应;应用范围广,可作为饲料中5种雌激素的常规检测方法。

