2015年-2017年南昌地区无偿献血者血液检测淘汰情况分析
樊璐
(江西省血液中心,江西 南昌 330052)
无偿献血者血液标本采集后,血液检测的淘汰原因有 ALT升高或 HBsAg、抗-HCV、抗-HIV、抗-TP及核酸检测阳性。本文通过统计分析南昌地区2015年-2017年无偿献血人数、血液检测淘汰情况的变化趋势以及变化原因,了解当前本地区献血人群输血传播性疾病的流行情况,以便采取有效措施减少血液报废,预防经输血传播疾病的发生,为无偿献血招募和筛查策略提供参考依据。
1 材料与方法
1.1 调查对象 2015年1月1日-2017年12月31日江西省血液中心采集的自愿无偿献血者全血标本共179714例,其中男性112790例,女性66924例,献血者均符合 《献血者健康检查要求》(GB18467-2011), 体检、Hb和 HBsAg快速筛查合格,年龄 18~55 周岁,献血量 200~400ml。
1.2 试剂 EIA 试剂盒:HBsAg、抗-HCV、抗-HIV、抗-TP为厦门新创、北京万泰公司产品;NAT试剂盒:HBV/HCV/HIV(1+2型)核酸联合检测试剂为美国Roche公司产品;ALT检测试剂盒为德国Siemens、浙江东瓯公司产品;免疫印迹法HIV确证试剂盒:人类免疫缺陷病毒(HIV1+2型)抗体检测试剂盒为美国MP公司产品。所有试剂均为批检定合格产品,且在有效期内使用。
1.3 仪器 血清学检测系统:STAR全自动样本处理系统为瑞士Hamilton公司产品;XANTUS全自动加样仪为深圳爱康公司产品;FAME 24/20全自动酶免分析系统为瑞士Hamilton公司产品;核酸检测系统:Microlab STAR IVD混样仪为瑞士Hamilton公司产品;COBAS AmpliPrep核酸提取仪为美国Roche公司产品;COBAS TaqMan扩增仪为美国Roche公司产品;生化分析系统:全自动生化分析仪为德国Siemens公司产品;HIV确证检测系统:全自动免疫印迹仪为英国Bee Robotics公司产品。仪器设备均每年定期校准合格。
1.4 检测方法 ELISA 检测:HBsAg、抗-HCV、抗-HIV、抗-TP均采用ELISA方法检测。使用2个不同生产厂家的试剂盒对献血者血液标本进行初、复检平行检测。2种试剂初复检结果均为反应性判为阳性,1种试剂反应性者用相同试剂进行双孔复查,复查结果任意1孔有反应性则判为阳性。去除ELISA检测阳性的标本,ELISA非反应性标本继续进行NAT混样检测。NAT检测:采用PCR-荧光法,使用罗氏核酸检测系统及试剂进行HBV DNA、HCV RNA、HIV RNA联合6混样核酸定性检测,初次检测有反应性的单个pool,对其进行拆分试验。反应性混样中拆分出的反应性标本,判定为NAT阳性。HIV确证检测:抗-HIV阳性或HIV RNA阳性的血液标本送江西省血液中心HIV确证实验室进行蛋白免疫印迹法(Western blot testing,WB)确证试验。ALT检测:采用速率法,以ALT≤50U判为合格标准。所有检测均严格按照试剂说明书设定检测程序、操作和判断结果。
1.5 统计学分析 使用SPSS 21.0软件进行数据统计分析,采用χ2检验进行淘汰率的比较,以P<0.05为差异具有统计学意义。
2 结果
2.1 2015年-2017年南昌地区无偿献血者血液检测传染性指标淘汰结果统计
2.2 NAT筛查ELISA检测阴性的献血者血液结果罗氏COBAS S201核酸检测系统采用6样本汇集混样检测,对ELISA检测阴性的无偿献血者血液标本进行NAT筛查,并进一步拆分检测出反应性的单个样本。本中心2015年-2017年期间NAT阳性标本合计214例,其中213例反应性样本为HBV DNA阳性,1例为HIV RNA阳性,未检出HCV RNA阳性标本。
3 讨论
2015 年-2017年南昌地区无偿献血人群血液标本5项传染性指标检测总淘汰率为2.38%,淘汰率由高到低依次为ALT>HBsAg>抗-TP>抗-HCV>抗-HIV,其中ALT和HBsAg是最主要的不合格项。
ALT是非特异性检测肝炎病毒感染的替代指标,易受多种非病理性因素以及血液标本因素影响[1]。该指标检测不合格一直为血液报废的主要原因。2015年-2017年南昌地区献血者ALT检测淘汰率为1.07%,低于广东韶关1.94%[2]。随着ALT快速检测试纸条的应用,本中心在釆血初筛时严格把控,ALT淘汰率保持在适中水平。近三年本中心ALT淘汰率先降后升,是由于2017年团体采血比例上升,团采不具备开展采血前现场ALT初筛检测条件。该数据变化趋势提示,通过无偿献血宣教告知献血前应注意休息、清淡饮食,避免因非病理因素导致ALT值升高,同时在釆血前广泛进行ALT快速筛查,对降低ALT淘汰率十分必要。
我国是HBV感染高发区域,普通人群HBV流行率约为7.2%[3],对输血安全造成较大威胁。2015年-2017年南昌地区献血者HBsAg检测淘汰率为0.56%,高于江苏南京0.34%[4],这可能与江西地区人群HBV高感染率有关[5]。2015年-2017年ELISA双试剂筛查阴性血液标本中,NAT检出HBV DNA阳性标本213例,成功阻断了疑似乙肝窗口期、隐匿性感染或带有病毒变异株的血液流入临床。HBV DNA阳性反应率0.121%,高于河南焦作0.055%[6],接近江西新余0.15%[7],低于四川广元0.205%[8],该组数据反映出不同省份地域乙肝流行率差异。对于检测结果中NAT反应性标本绝大部分是HBV DNA阳性,分析原因是由于HIV和HCV的感染人数远少于HBV,也符合我国HBV感染为主的现状。以上数据分析显示,南昌地区献血人群HBV DNA阳性反应率较高,核酸检测大幅提高HBV检出的灵敏度,与酶免检测互为补充,开展NAT可明显降低HBsAg隐匿性感染和潜伏期感染的残余风险[9,10]。
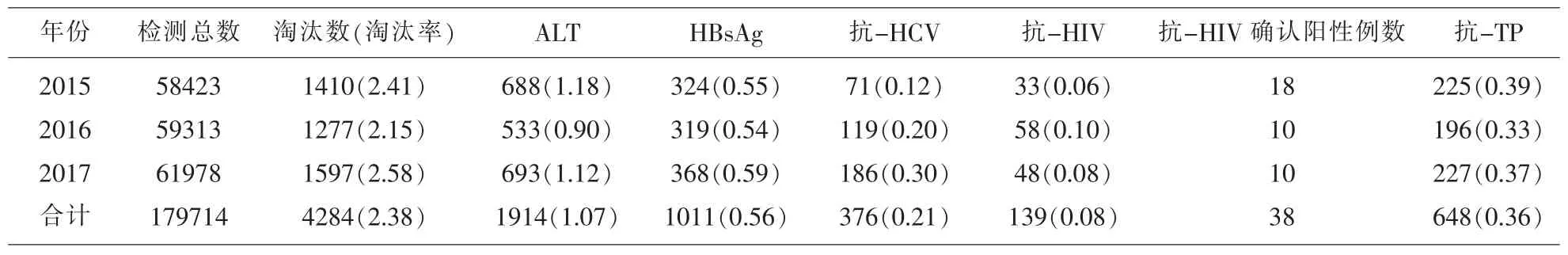
表1 2015年-2017年南昌地区无偿献血者血液检测传染性指标淘汰结果(n,%)

表2 2015年-2017年南昌地区无偿献血者血液核酸检测淘汰结果(n,%)
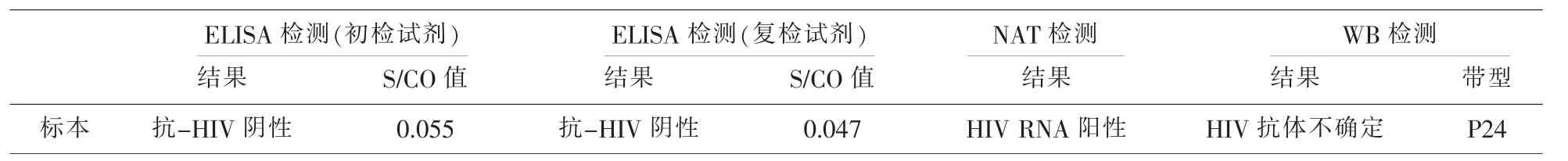
表3 1例HIV RNA阳性血液标本检测结果
中国为丙肝高发区,丙肝感染率3.2%[11],经血液制品传播是HCV感染的主要途径之一。2015年-2017年抗-HCV检测淘汰率为0.21%,低于江西抚州0.249%[12]、江苏南京0.27%[13]。近3年南昌地区献血者抗-HCV淘汰率逐年上升,表明HCV的传播仍然是南昌地区输血治疗需要关注的重要风险点。
2015 年-2017年南昌地区献血者抗-HIV检测淘汰率为0.08%,低于甘肃张掖0.137%[14]、新疆乌鲁木齐0.20%[15],139例抗-HIV ELISA初筛阳性标本中,38例经WB法检测为确证阳性,假阳性率73.19%。ELISA法检测抗-HIV出现假阳性结果,影响因素包括试剂包被抗原的种类及纯度、血液中含内源性物质、检测过程的影响等。大部分抗-HIV假阳性献血者被淘汰,造成血源流失,对献血者带来一定程度的心理阴影[16]。因此,本中心对假阳性献血人群建立了归队策略,保障献血者权益。2015年-2017年NAT检出HIV RNA阳性标本1例,经WB法确证检测,结论为HIV抗体不确定。此例血液标本ELISA检测无反应性,提示该标本可能处于ELISA检测“窗口期”。对于输血相关艾滋病,至少有90%风险来自于献血者“窗口期”捐献的血液[17]。本中心NAT成功拦截疑似HIV“窗口期”标本,阻止相关血液制品进入临床输注,避免了可能经输血感染艾滋病恶性事件的发生。
2015 年-2017年南昌地区献血者TP检测淘汰率为0.36%,低于河南濮阳0.77%[18]。有报道称近年来一些地区献血者梅毒感染率有上升趋势[19]。目前HBsAg/抗-TP联合检测金标试纸条已上市,以此方式增加献血前抗-TP快速筛查,不会提高人力及时间成本,更有利于提升输血安全[20]。
血液安全是临床输血的关键问题,为降低血液检测淘汰率,更好地为临床提供优质血液,笔者建议:1、采供血机构应选择特异性好、灵敏度高的检测方法和试剂,如酶免第四代进口试剂及核酸检测、化学发光试剂,从而尽可能缩短检测“窗口期”。2、体检釆血工作人员应加强对不适宜献血情况以及献血后回告途径的宣传,严格执行《献血者健康检查标准》,认真做好采血前健康征询与体检、初筛工作,充分使用ALT快速检测试纸、HB-sAg/抗-TP联合检测试纸进行筛查,提高对高危献血者的鉴别能力。3、血液检验工作人员应严格按照标准操作规程和试剂说明书进行检测操作,避免人为因素导致的假阳性或假阴性结果。

