肝癌组织HIF-1α、MRP表达水平及与临床病理学特征的关系
吉文伟,郭胜利,宋展
(1、南阳市中心医院胆道普外科,河南 南阳473000;2、南阳市中心医院普外科,河南 南阳473000)
肝癌一般是由遗传或环境等多种因素诱发的恶性肿瘤,具有较高的发病率和死亡率。随着化疗耐药和恶性肿瘤发生、发展机制研究的逐步深入,从分子水平对恶性肿瘤的治疗效果、耐药性及肿瘤转移已成为肿瘤的重要研究方向[1]。
相关资料[2]显示缺氧的微环境是影响肿瘤治疗效果的重要原因。滕凤猛[3]的研究证实在缺氧的微环境下恶性肿瘤可通过乏氧诱导因子-1(Hypoxia inducible factor-1,HIF-1)改善肿瘤内细胞的代谢并促进肿瘤内部生成新的血管,进而加速肿瘤的生长速度。HIF-1是一类广泛存在于人体和哺乳动物的逆转录因子,主要分为HIF-1α和HIF-1β两个亚型单位。相关研究[4]也发现多药耐药蛋白(multidrug resistance protein,MRP) 的过度表达既是诱发肿瘤细胞多重耐药的主要机制,还可能与恶性肿瘤的恶性生物学行为具有密切联系。我们推测上述两种因子可能存在某种协同作用,但目前HIF-1α和MRP相关性研究相对较少。故此,本研究探讨肝癌组织HIF-1α、MRP表达水平及意义,现报道如下。
1 资料与方法
1.1 一般资料 选取2014年2月至2017年4月我院病理科保存的原发性肝细胞癌组织117例,其中男性71例,女性46例;年龄38~69岁,平均年龄(50.03±7.26)岁。同时选取40正常肝脏组织作为对照,其中男性28例,女性12例;年龄36~65岁,平均年龄(49.11±8.20)岁。纳入标准:⑴临床病理资料保存完整;⑵术前未接受过放疗、化疗等资料。排除标准:临床病理资料不完整。
1.2 实验方法 鼠抗人单克隆抗体 HIF-1α(1:50)、鼠抗人单克隆抗体MRP、SP试剂盒及DAB试剂盒均购置于南京建成生物研究所。免疫组化研究法检测HIF-1α、MRP表达情况,具体操作严格按照说明书进行。已知阳性反应片为阳性对照,PBS代替一抗为阴性对照。
1.3 结果判断 HIF-1α以细胞胞质或细胞核出现棕黄色颗粒为阳性表达,MRP以细胞膜或胞质出现棕黄色颗粒为阳性表达[5]。每张切片随机选取5个高倍视野,根据染色强度和着色细胞比例进行评分[6,7]:⑴染色强度:不着色为 0分,浅黄色为 1分,棕黄色为2分,棕褐色为3分;⑵着色细胞比例:无着色细胞为0分,着色细胞比例<25%为1分,25%~50%为2分,>50%为3分。将染色强度和着色细胞比例得分相乘,最终得分≤3分为阴性,>3分为阳性[5]。
1.4 统计学处理 统计分析采用SPSS 19.0软件,计数资料比较使用χ2检验,相关性采用Spearman相关分析,以P<0.05表示差异具有统计学意义。
2 结果
2.1 肝癌组织和癌旁组织HIF-1α、MRP表达 肝癌组织HIF-1α、MRP阳性表达率明显高于癌旁组织(P<0.05),见表 1。
2.2 HIF-1α表达与肝癌临床病理特征的关系HIF-1α表达与肝癌肿瘤包膜、门静脉癌栓、TNM分期、分化程度和淋巴结转移有关(P<0.05),与患者年龄、性别、HBsAg 和肿瘤直径无关(P>0.05)。见表2。

表1 肝癌组织和癌旁组织HIF-1α、MRP表达
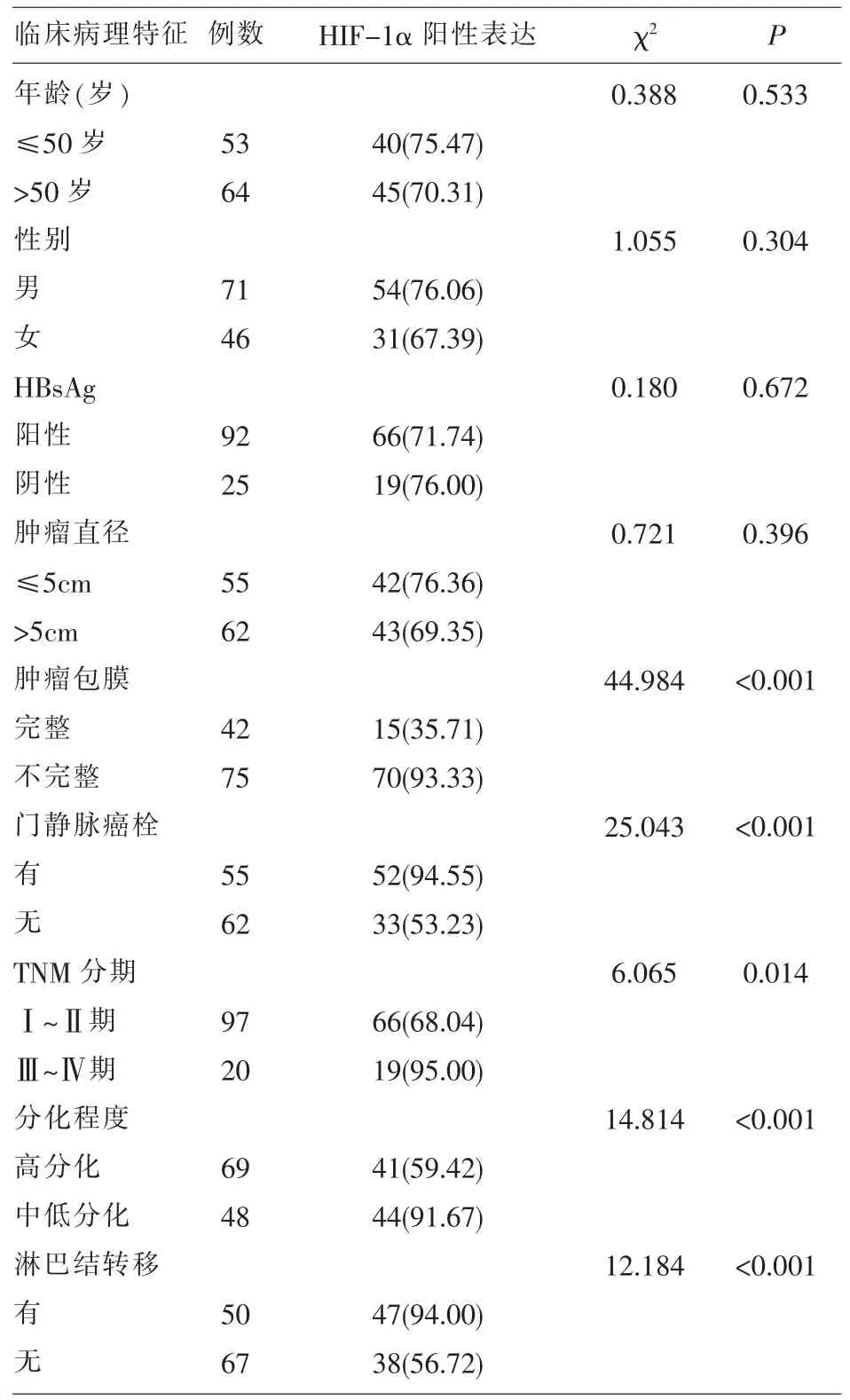
表2 HIF-1α表达与肝癌临床病理特征的关系
2.3 MPR与与肝癌临床病理特征的关系 MRP表达与肝癌分化程度、淋巴结转移有关(P<0.05),与患者年龄、性别、HBsAg、肿瘤直径、肿瘤包膜、门静脉癌栓和TNM分期无关(P>0.05);见表3。
2.4 肝癌组织 HIF-1α、MRP相关性 肝癌组织HIF-1α 表达与MRP表达呈正相关 (rs=0.737,P<0.05),见表 4。
3 讨论
有氧环境下HIF-1可经羟基化后结合泛肽连接酶,进而通过自身泛肽化而降解;缺氧环境下HIF-1无法被羟基化,导致体内HIF-1浓度升高[8]。张志强[9]的研究发现HIF-1含量升高时,可参与恶性肿瘤相适应的基因转录,进而形成新生血管和维持肿瘤细胞的能量代谢。最新的研究[10,11]提示,缺氧环境下,抑制HIF-1表达可作为肿瘤治疗的新途径。肿瘤快速增长过程中,因恶性肿瘤细胞快速增殖进而诱发细胞内部缺氧,在多种肿瘤中均发现的HIF-1的高表达,推测HIF-1可参与肿瘤的浸润、生长和转移等病理生理过程[12]。
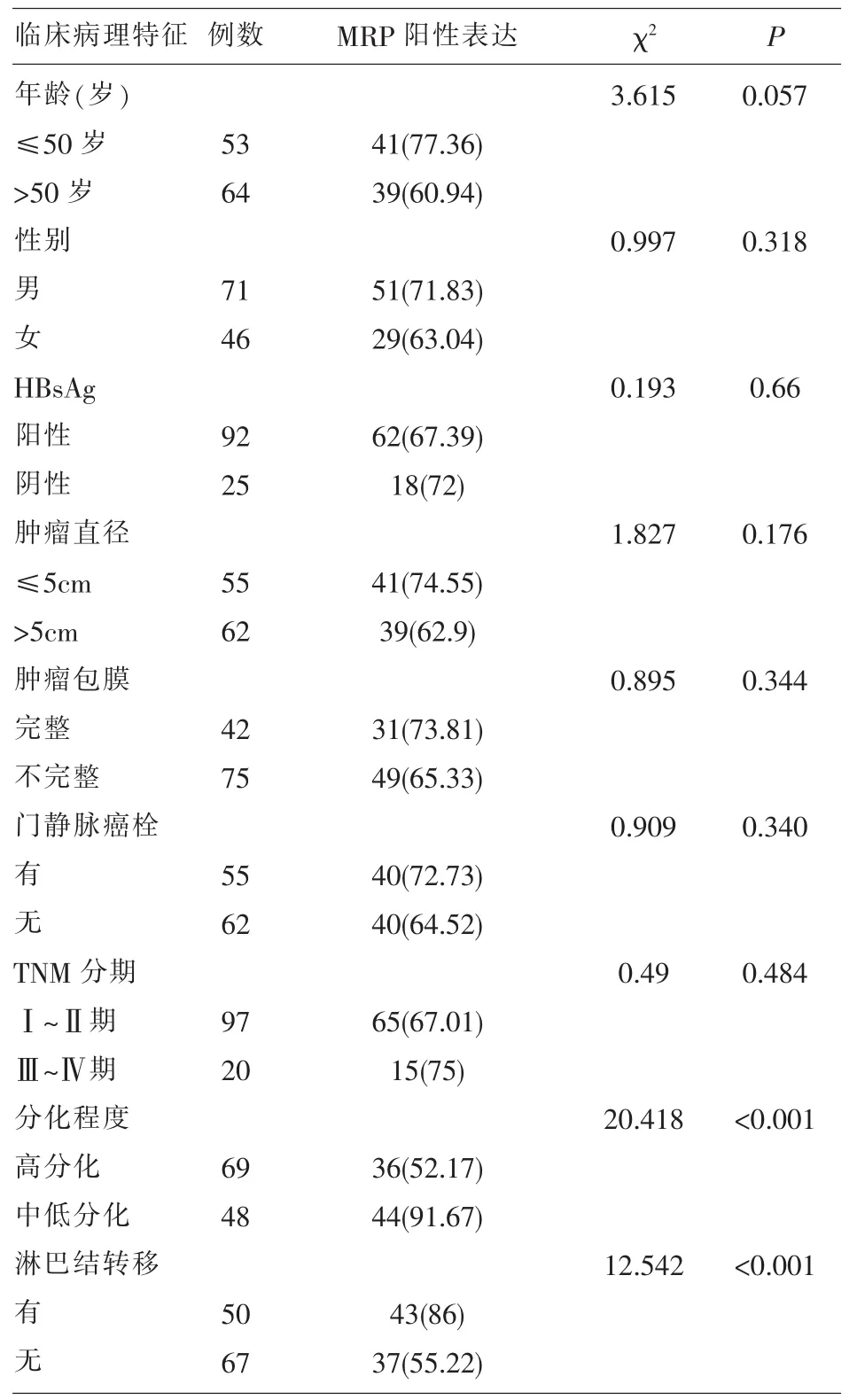
表3 MRP表达与肝癌临床病理特征的关系

表4 肝癌组织HIF-1α与MRP表达相关性
本研究结果显示肝癌组织HIF-1α、MRP阳性表达率分别为72.65%和68.38%,明显高于癌旁组织(P<0.05)。HIF-1α表达升高是肝癌发生过程的重要因素,随着肿瘤细胞的持续增殖,HIF-1α也随缺氧环境的加重而高表达,并参以调节肿瘤细胞适应缺氧环境的过程,进而进一步加速肿瘤细胞的恶性增殖[13]。该结果还提示MRP蛋白在肝癌组织的高度表达可能在肝癌细胞耐药过程中具有重要生物学作用。
本研究中HIF-1α、MRP表达与肝癌临床病理特征的关系结果显示:肿瘤包膜不完整、有门静脉癌栓、TNM分期Ⅲ~Ⅳ期、中低分化和有淋巴结转移患者HIF-1α阳性表达率分明显高于肿瘤包膜完整、无门静脉癌栓、TNM分期Ⅰ~Ⅱ期、高分化和无淋巴结转移患者(P<0.05);中低分化和有淋巴结转移患者MRP阳性表达率分别为91.67%和86.00%,明显高于高分化和无淋巴结转移患者(P<0.05)。上述结果提示HIF-1α有潜力成为评估肝癌恶性分化程度、病情变化及淋巴结转移的重要因子指标;同时说明在不同病理特征的肝癌组织中MRP存在表达差异,提示MRP对肝癌的恶性发展过程具有重要影响,可作为判断肝癌患者淋巴结转移和分化程度的重要分子指标。
MPR与与肝癌临床病理特征的关系结果显示MRP表达与肝癌分化程度、淋巴结转移有关 (P<0.05),与患者年龄、性别、HBsAg、肿瘤直径、肿瘤包膜、门静脉癌栓和TNM分期无关(P>0.05)。该结果提示MPR与肝癌的发生、发展过程具有密切联系。肝癌组织HIF-1α、MRP相关性研究发现肝癌组织 HIF-1α表达与 MRP表达呈正相关 (P<0.05)。上述结果说明肝癌的浸润转移和恶性增殖过程中,癌细胞在缺氧条件下,HIF-1α表达增高,MRP的表达增高也可能参与了缺氧条件下稳定细胞在内环境中的作用过程。MRP的耐药机制研究[14]提示HIF-1α可通过调整细胞缺氧适应能力进而提高肿瘤的多药耐药,并推测两种因子可能存在协同作用。在缺氧环境下HIF-1α与MRP具有同样的蛋白同源性结果,正常条件下两种因子还可以在维持维持细胞内环境稳定中发挥作用[15]。
综上所述,肝癌组织HIF-1α、MRP表达呈高表达,HIF-1α、MRP之间可能存在协同作用,与患者临床病理特征有一定关系。

