血浆Hcy、D-D、CD62E+微颗粒水平与ACI患者病情的关系
刘艳丽
(郑州市第二人民医院神经内科,河南 郑州 450000)
急性脑梗死 (acute cerebral infarction,ACI)的发生,能够导致患者病死率的显著上升。流行病学研究显示,ACI的发病率可达223-455/10万人左右[1]。特别是在合并有动脉粥样硬化或者基础性高血压的人群中,ACI的发病率更高。
不同的因子能够导致血管内皮的损伤、促进炎症性损伤、增加氧化应激障碍等,进而促进ACI的脑血管损伤、脑组织的梗死及缺血再灌注损伤过程。 同型半胱氨酸(homocysteine,Hcy)、D-二聚体(D-dimer,D-D)能够反应患者体内的局部氧化应激障碍,并能够诱导下游细胞炎症因子如IL-6、IL-10的激活,促进神经元细胞膜完整性的破坏,增加缺血基础上的脑组织的坏死程度[2,3];CD62E+微颗粒是标记有CD62+的内皮微颗粒因子,其表达浓度的上升能够提示血管内皮的损伤及内皮细胞的凋亡等病理过程[4]。为了进一步评估Hcy、DD、CD62E+微颗粒水平在促进ACI病情进展过程中的作用,从而为临床上ACI的病情进展提供参考,本次研究选取我院收治的120例ACI患者,探讨了相关指标的表达及其与患者脑神经功能的评分关系,报告如下。
1 资料与方法
1.1 一般资料 选取我院收治的120例ACI患者(ACI组),同期健康体检对象60例作为对照组,收集时间2016年1月-2016年12月。ACI组,男66例、女 54 例,年龄 51~82 岁,平均 66.0±12.2 岁,起病至入院时间间隔 4~24h,平均 12.5±5.8h;合并疾病:高血压79例、糖尿病32例、高血脂25例;入院24h NIHSS评分:<5分49例、≥5分71例。对照组,男34例、女26例,年龄47~79岁,平均64.3±11.8 岁。 两组患者的年龄、性别比较,差异均无统计学意义(P>0.05)。
1.2 纳入排除标准
1.2.1 纳入标准 ⑴ACI患者的诊断标准参考中华医学会制定的诊断标准;⑵起病后24h内入院;⑶入院后经CTA、MRI检查确诊;⑷对照组研究对象来源于我院体检健康的自愿者。
1.2.2 排除标准 ⑴脑出血;⑵颅内肿瘤、动脉瘤;⑶肝肾功能疾病;⑷凝血功能疾病;⑸内风湿、结缔组织疾病。
1.3 指标检测方法 CD62E+微颗粒的检测:采用流式细胞技术检测相关指标的水平,横向提示侧向散光,纵向提示前向散光,C门0-0.082um微颗粒,对于C门进行分析,D门为直径为0-0.082um标记有CD62E+微颗粒的微颗粒。
所有患者均于入院24h内采集空腹静脉血约5ml,自然抗凝后以3000r/min离心10min,取上清液采用酶联免疫吸附法测定血清中Hcy、D-D水平,检测试剂盒购自北京中杉金桥生物有限公司,具体检测步骤严格按照试剂盒说明书进行操作。
1.4 NIHSS评分标准 NIHSS评分标准:该量表主要包括了意识水平、凝视、视野、面瘫、上肢运动、下肢运动、肢体共济失调、感觉、语言、构音障碍、消退和不注意11个项目,总分0~42分,评分越高,患者的神经缺损功能越严重;0~1分(正常);1~4 分(轻度);5~15 分(中度);15~20 分(中重度);21~42 分(重度)。
1.5 统计学方法 统计软件采用SPSS 16.0,计量资料采用均数±标准差(±s)进行统计描述,组间比较采用t检验;相关性分析采用Pearson线性相关分析法。以P值<0.05为差异具有统计学意义。
2 结果
2.1 两组研究对象的血浆 Hcy、D-D、CD62E+微颗粒水平比较 ACI组患者的血浆Hcy、D-D、CD62E+微颗粒水平显著的高于对照组,差异具有统计学意义(P<0.05),见表 1。
表1 两组研究对象的血浆Hcy、D-D、CD62E+微颗粒水平比较(±s)
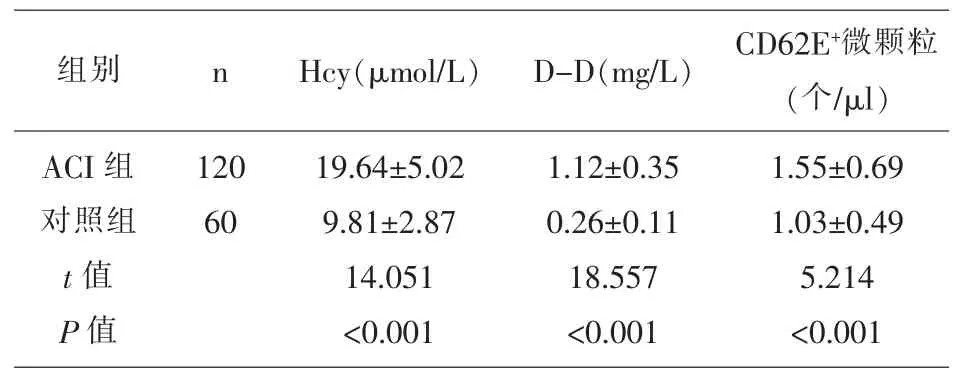
表1 两组研究对象的血浆Hcy、D-D、CD62E+微颗粒水平比较(±s)
组别 n ACI组对照组t值P值120 60 Hcy(μmol/L) D-D(mg/L) CD62E+微颗粒(个/μl)19.64±5.02 9.81±2.87 14.051<0.001 1.12±0.35 0.26±0.11 18.557<0.001 1.55±0.69 1.03±0.49 5.214<0.001
2.2 不同 NIHSS评分 ACI患者的血浆 Hcy、D-D、CD62E+微颗粒水平比较 NIHSS评分<5分组ACI患者的血浆Hcy、D-D、CD62E+微颗粒水平显著的低于NIHSS评分≥5分组ACI患者,差异具有统计学意义(P<0.05),见表 2。
表2 不同NIHSS评分ACI患者的血浆Hcy、D-D、CD62E+微颗粒水平比较(±s)

表2 不同NIHSS评分ACI患者的血浆Hcy、D-D、CD62E+微颗粒水平比较(±s)
NIHSS分组 n<5分≥5分t值P值49 71 Hcy(μmol/L) D-D(mg/L) CD62E+微颗粒(个/μl)14.63±3.96 22.04±4.71 9.026<0.001 0.85±0.27 1.33±0.30 8.969<0.001 1.30±0.55 1.64±0.61 3.122 0.002
2.3 ACI患者的血浆 Hcy、D-D、CD62E+微颗粒水平与NIHSS评分的关系 ACI患者的血浆Hcy、DD、CD62E+微颗粒水平与NIHSS评分均呈正相关关系(P<0.05),见表 3。

表3 ACI患者的血浆Hcy、D-D、CD62E+微颗粒水平与NIHSS评分的关系
3 讨论
ACI的病情进展较为隐匿,但可以短时间内突然发病,基础合并症越多,病情越为严重,ACI急性发作的临床预后越差。长期的临床随访研究显示,ACI的病死率可达15%以上,其远期中枢神经系统的并发症发生率也可达25%以上[5]。现阶段临床上对于ACI的发病或者病情进展缺乏可靠的评估指标,虽然头颅CT或者磁共振等检查,能够在一定程度上评估ACI的病情及临床预后,但其评估的灵敏度或者特异度等指标较差,敏感性较低,对于患者治疗后的中枢神经系统功能的动态随访价值不高。
Hcy能够影响到半胱氨酸或者胱氨酸的代谢,导致含巯基氨基酸代谢障碍,影响到氧化应激损伤,促进氧化还原反应平衡系统的的紊乱,从而在促进神经元细胞的线粒体损伤、神经元细胞的氧化因子破坏。Hcy还能够刺激下游单核细胞或者巨噬细胞,加剧脑胶质细胞的炎症性损伤,促进脑组织间质成分的代偿性炎症性增生[6,7];D-D的上升能够促进血小板性微血栓的形成,增加脑组织缺血基础上的脑血管的血流灌注阻力的增加,血流灌注水平的下降进而可以促进患者脑组织的缺血再灌注损伤的发生,同时D-D的上升还能够增加ACI恢复期的脑出血的发生,增加血管内皮的通透性,为炎症因子的浸润提供条件[8,9];CD62E+微颗粒是血管内皮损伤后释放的细胞膜表面糖蛋白碎片,其携带有CD62+抗原表位,能够评估ACI患者脑血管内皮细胞的损伤程度[10,11]。部分研究探讨了Hcy或者D-D的表达与ACI的病情关系,认为高表达的Hcy或者D-D是促进患者临床预后恶化的重要风险,但对于CD62E+微颗粒的表达分析研究不足。
本次研究发现,在ACI患者血清中,Hcy、DD、CD62E+微颗粒水平等均存在明显程度的高表达,相关指标的高表达能够促进患者病情的进展,这主要考虑与不同的因子能够在影响到炎症因子的富集、血管内皮的损伤、增加补体激活导致的神经元细胞膜完整性的破坏等方面发挥作用[12]:⑴Hcy对于体内还原型谷胱甘肽表达的影响,能够促进神经元突触模式糖蛋白配体的激活,干预神经元内的炎症信号通路的表达;⑵D-D的高表达能够影响到纤维蛋白酶的激活,促进血栓的形成,增加局部组织血流灌注的低灌注、高阻力表现;⑶在脑血管内皮细胞的凋亡过程中,细胞破碎分解过程中释放的CD62E+微颗粒水平,能够诱导下游补体成分C3、C4的上调,促进自身免疫性复合物的沉积导致的脑组织的损伤。吕东等[13,14]研究者在探讨了不同临床预后特别是病死率较高的ACI患者血清中的相关指标的表达情况,Hcy可平均上升25%以上,而治疗敏感性越差、远期的并发症越多,Hcy的上升越为明显。但部分研究者并未发现DD的持续性高表达趋势,认为D-D的表达在早期可明显上升,但在动态随访过程中,D-D的表达随着梗死脑组织部位的血流恢复而逐渐下降,其动态表达分析仍然需要后续研究的进一步探讨。NIHSS评分是评估患者中枢神经系统功能的重要指标,其包括了意识水平、凝视、视野、面瘫、上肢运动等方面的评分,评分越高患者的临床预后越差,本次研究中Hcy、D-D、CD62E+微颗粒水平表达越高,患者的神经系统功能评分越高,临床预后越差,同时其表达与患者的NIHSS评分密切相关,这主要考虑与Hcy、D-D、CD62E+等相关指标的高表达对于患者缺血部位脑组织的细胞凋亡、坏死、缺血性半暗带的形成、神经胶质成分的纤维化及脂肪变性等病理过程的影响有关[15]。
综上所述,ACI组患者的血浆 Hcy、D-D、CD62E+微颗粒水平显著升高,并且与患者神经功能缺损程度具有一定的关系。

