胸腔积液中巨噬细胞细胞因子的表达
王莹,杨军平,杨小军,肖亮,梁华
(江西中医药大学附属医院,江西 南昌 330006)
检测胸腔积液的方法多种多样,但各有局限性,例如临床比较常用、最简单、最特异的方法—胸水脱落细胞学检查,阳性率比较低,只有约为30%[1-3]。这是由于在细胞学诊断中经常会遇到不典型的细胞形态,难以鉴别其来源及性质。而目前有很多的学者采用生物学免疫标记物检测方法来弥补细胞学诊断中的盲区,提高判断胸腔积液性质的准确性。本研究中我们采用酶联免疫检测IL-6、TNF-α、IL-13、TGF-β1 及 RT-PCR 技术检测 IL-6、TNF-α、Arg-1 mRNA 相结合的方法研究巨噬细胞因子在不同性质胸腔积液细胞中的表达差异,同时结合临床病史资料,进一步探讨其临床诊疗价值。
1 资料和方法
1.1 一般资料 所有患者均为2016年5月至2017年12月期间在我院呼吸科住院治疗的70例胸腔积液患者,其中良性胸腔积液患者39例,男性26例,女性13例,平均年龄52岁,均经过胸水脱落细胞学检查、PPD试验、痰找抗酸杆菌、细菌培养或临床诊断性治疗等方法明确诊断。39例中脓胸伴胸腔积液21例,低蛋白血症伴胸腔积液7例,心功能衰竭伴胸腔积液5例,肺炎旁性胸腔积液3例,胰腺炎2例,寄生虫感染1例。另外恶性胸腔积液患者31例,男性21例,女性10例,平均年龄56岁,均经胸部CT检查、胸水脱落细胞学检查、支气管镜检查和活检、淋巴结活检、胸膜活检或肿块穿刺等方法诊断为恶性胸腔积液。其中肺癌25例,乳腺癌伴胸膜转移和食道癌伴胸膜转移各2例,恶性胸膜间皮瘤1例,恶性淋巴瘤1例。经过统计学分析,两组患者性别、年龄比较无显著性差异 (P>0.05)。标本处理步骤:取新鲜胸腔积液200ml加入 3.8%肝素抗凝管中,以 2500r/min,离心15min,收集沉淀后置于-80℃冰箱内保存;取新鲜胸腔积液20ml,进行积液常规检测、积液生化分析及积液CEA检测,同时患者采血检测血清CEA。
1.2 方法
1.2.1 酶联免疫吸附试验(ELISA)检测 取胸腔积液患者血液,立即分离血清,进行IL-6、TNF-α、IL-13、TGF-β1 细胞因子进行检测。IL-6、TNF-α、IL-13、TGF-β1 酶联免疫检测试剂盒均购于深圳晶美生物工程有限公司,全部操作严格按说明书进行。
1.2.2 RT-PCR 检测 IL-6、TNF-α、Arg-1 mRNA 表达水平 按照实验步骤,取-80℃冰箱保存的胸水沉淀细胞,用Trizol试剂提取RNA,按照试剂盒说明逆转录cDNA。引物序列;IL-6:正向引物5'-CCACTGCCTTCCCTACTTCA -3'; 反 向 引 物 5'-ACAGTGCATCATCGCTGTTC-3';TNF-α: 正向引物 5'-GCCAATGGCATGGATCTCAA-3';反向引物5'-CCCTTGAAGAGAACCTGGGA-3';Arg-1: 正向引物 5'-ACCCTGACCTATGCGTCATT-3';反向引物 5'-ATTCCCAGAGCTGGTTGTCA -3';GAPDH:正向引物 5'-GCTACACTGAGGACCAGGTT-3';反向引物 5'-CCCAGCATCAAAGGTGGAAG-3'。 PCR反应条件循环扩增,测定相对含量。
1.3 统计学处理 实验结果输入SAS 9.0统计软件分析,表达水平比较采用t检验,P<0.05为差异有显著性。相关分析用直线相关分析法(先对数据作对数转换后作Pearson相关性分析)。
2 结果
2.1 不同性质胸腔积液患者血清 IL-6、TNF-α、IL-13、TGF-β1表达水平 见表 1。
2.2 不同性质胸腔积液中 IL-6、TNF-α、Arg-1 mRNA表达水平 见表2。
2.3 积 液 CEA 与 胸 腔 积 液 TNF-α、IL-6、Arg-1mRNA及血清CEA相关性分析 胸腔积液TNF-α、IL-6、Arg-1mRNA 的表达与血清癌胚抗原、胸腔积液癌胚抗原的表达呈现不同的正相关性 (r=0.399,P<0.05;r=0.498,P<0.01;r=0.547,P<0.01)。见表3。
表 1 各组 IL-6、TNF-α、IL-13、TGF-β1 表达水平(±s)
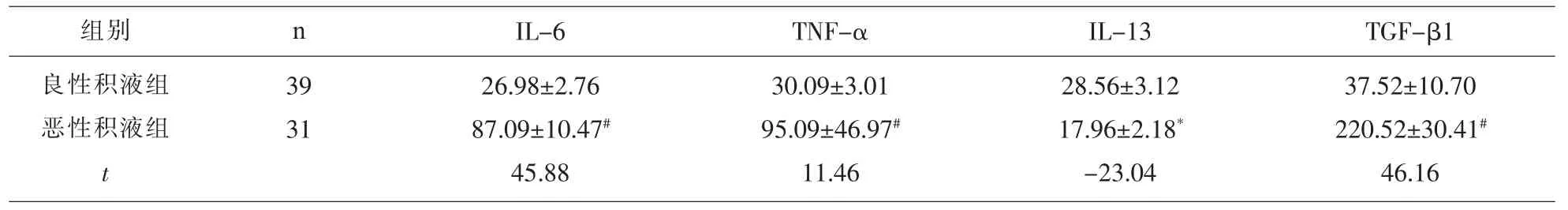
表 1 各组 IL-6、TNF-α、IL-13、TGF-β1 表达水平(±s)
注:与良性积液组比较,#P<0.01,*P<0.05。
组别 n良性积液组恶性积液组t 39 31 IL-6 TNF-α IL-13 TGF-β1 26.98±2.76 87.09±10.47#45.88 30.09±3.01 95.09±46.97#11.46 28.56±3.12 17.96±2.18*-23.04 37.52±10.70 220.52±30.41#46.16
表 2 各组 IL-6、TNF-α、Arg-1 mRNA表达量(±s)
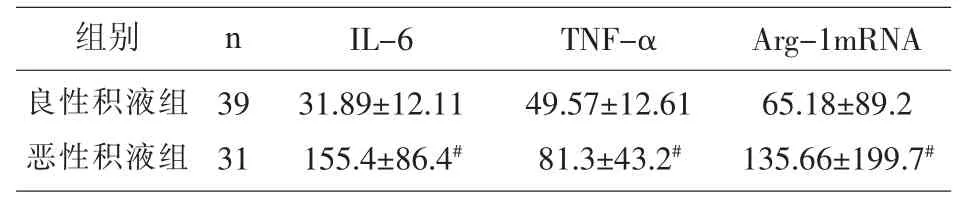
表 2 各组 IL-6、TNF-α、Arg-1 mRNA表达量(±s)
注:与良性积液组比较,#P<0.01。
65.18±89.2 135.66±199.7#组别良性积液组恶性积液组n IL-6 39 31 31.89±12.11 155.4±86.4#TNF-α Arg-1mRNA 49.57±12.61 81.3±43.2#
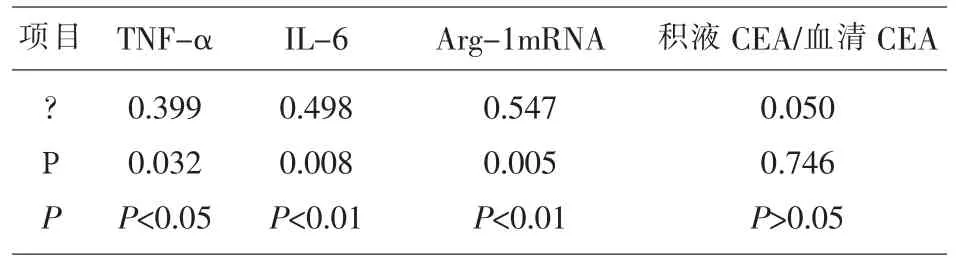
表3 积液CEA与胸腔积液TNF-α、IL-6、Arg-1mRNA及血清CEA相关性分析
3 讨论
引起胸膜腔积液的原因很多,但是从细胞免疫的角度来说,是因为激活的免疫细胞聚集在病变部位,这些免疫细胞产生多种细胞因子,有效地发挥局部细胞免疫作用。IL-6是单核巨噬细胞与T细胞产生的促炎因子,IL-13是活化T细胞产生的抗炎因子,TNF-α是活化的巨噬细胞产生的前炎症因子,TGF-β1具有双面效应,正常表达时抑制炎症反应,过度表达时发生炎症性病理变化,综上所知,这些细胞因子都是参与炎症反应的[4-6]。本研究结果表明:恶性胸腔积液中患者血清IL-6、TGF-β1、TNF-α含量均升高,说明胸腔局部合成的 IL-6、TNF-α、TGF-β1 增多,是导致胸膜组织病理学改变、引起胸腔积液渗出的主要原因之一。IL-6是基质细胞和免疫系统细胞产生的多效细胞因子,其在机体发生炎症反应、免疫调节与机体防御中起到重要的作用。IL-6是公认的促炎细胞因子,体液中IL-6的水平反映了局部炎症反应的强度。恶性胸腔积液中IL-6含量增加的原因可能是由于癌细胞分泌的细胞因子,通过自分泌环路或旁分泌环路调节肿瘤细胞的免疫活性,导致局部强烈的炎症反应,从而诱导IL-6的形成与产生。TNF-α是重要的炎性介质,由活化的巨噬细胞与T淋巴细胞产生的双效炎症因子,TNF-α通过损伤内皮细胞,使血管损伤,导致癌症组织的局部血流受阻断而引起出血、缺氧坏死现象。TGF-β1是具有多种功能的蛋白小分子多肽,是TGF-β家族的一员。它在细胞的生长、分化、免疫调节、炎症、胚胎发育和组织修复等方面发挥重要的作用,TGF-β1在肿瘤细胞中可诱导血管内皮生长因子的表达,通过调节成纤维细胞,产生胞外基质蛋白和细胞粘附蛋白,降低胞外基质的降解酶的生成,增加抑制降解酶的蛋白生成,从而调节胞外基质的粘附性,并通过增加蛋白水解酶活性启动与细胞粘附分子的结合,促进肿瘤的侵袭和转移。TGF-β1表达增高见于肿瘤性疾病如宫颈癌、肝癌,有研究证实在肺癌组织和血清中 TGF-β1 存在高表达[7-9]。 TGF-β1对肿瘤的直接影响一般是通过Smads依赖途径或者干扰Smads依赖途径的介导来完成[10],且其高表达与预后密切相关。有文献报道,细胞因子在释放入血的同时,贮存在肿瘤组织的周围及因肿瘤导致的胸腹水中,恶性肿瘤也在胸膜转移,胸膜通透性增加。TGF-β1释放入胸腔积液中。本文显示,在恶性胸膜炎中TGF-β1的表达升高,恶性胸腔积液TGF-β1含量与良性积液组相比差异具有统计学意义(P<0.05),原因可能在炎症反应初期,TGF-β1招募和激活损伤部位的各种细胞,促使TGF-β1在局部不断增加。有报道,支气管灌洗液中TGF-β1高表达的原因,与癌症病变的分期密切相关[11],文献报道[12]恶性积液中的TGF-β1表达明显高于脓胸和漏出液,我们的结果与文献报道的基本一致。精氨酸酶(arginase,Arg)是一种参与尿酸循环的酶,有研究发现Arg-1在肝组织内高表达,在胸腔组织中也表达[13]。近年来有研究报道Arg-1是一种非常敏感的胸腔细胞肿瘤标记物,但报道结果差异性大。Fujiwara 和 McKnight[14,15]等研究发现 Arg-1阳性率分别为81%和84.4%,略低于我们的实验结果,可能与我们所采用的方法和判断标准不一样有关。我们研究结果发现Arg-1在恶性胸腔积液中的表达明显高于良性胸腔积液,结果提示Arg-1是一种比较敏感的判断胸腔积液细胞性质来源的标记物。

