小鼠胚胎电转外源物质条件的优化
樊英智,邬明丽,李世鹏,高 源,赖振雨,雷初朝,党瑞华
(西北农林科技大学 动物科技学院,陕西杨凌 712100)
细胞转染是指将外源分子如DNA、RNA等导入真核细胞的技术。细胞转染的方法有很多:生物学方法(即以病毒为载体的转染方法)、化学方法(磷酸钙共沉淀法、EDTA-葡聚糖法、阳离子脂质体法、阳离子聚合物法)、物理方法(显微注射法、基因枪法、电穿孔法、激光照射法、声孔效应法、磁性纳米颗粒等)。其中大部分方法对设备和操作的要求都较高,且效率不高。而电穿孔技术是利用电流来增加细胞膜的可透性,高效快速地将外源物质转入细胞中,操作简便,效率较高[1-3]。目前,新兴的CRISPR/Cas9技术具有高度适应性、组装简便性、高特异性,成为当前最常用的基因组编辑方法,通过电转可以将编辑组件导入胚胎实施精确编辑,进一步推动在实践中的应用,但此方面的研究鲜见报道。由于mRNA具有不稳定性,且电转需将构建的mRNA置于靶细胞所处的环境中,但mRNA在该环境易被分解,这给试验带来极大的不便[4]。另外,体外转录法获得mRNA成本相对较高。因此,本研究以大分子荧光染料四甲基罗丹明标记的葡聚糖(Tetramethylrhodamine-labelled dextran)、带绿色荧光蛋白标记的质粒pLL3.7、体外转录的绿色荧光蛋白mRNA作为替代基因编辑组件的外源物质,探索电穿孔法将外源物质导入小鼠胚胎的最优条件。
1 材料与方法
1.1 材 料

1.2 方 法
1.2.1 引物设计 根据NCBI数据库(http://www.ncbi.nlm.nih.gov/tools/primer-blast/)pLL3.7质粒中eGFP(enhanced green fluorescent protein)基因的CDS区设计引物,引物序列见表1。其中,上游引物包含T7启动子序列。引物均由上海生工生物工程有限公司合成。

表1 eGFP的CDS区引物序列Table 1 Primer sequence of eGFP-CDS
1.2.2eGFP质粒的准备 将带有eGFP标记的pLL3.7质粒转化到感受态细胞中,并用LB培养基培养。然后进行质粒提取,分装后-80 ℃ 冰箱过夜,再用冷冻干燥机冻干,在-20 ℃冰箱保存,备用。

1.2.4 细胞培养 对HEK293T细胞进行复苏,然后在37 ℃、φ=5% CO2培养箱中培养。当细胞长至90% 融合时,进行传代。再转移到37 ℃、φ=5% CO2培养箱中培养。
1.2.5 pLL3.7质粒和eGFPmRNA表达效率验证 转染前1 d将细胞按每孔2×105个细胞铺于24孔板中。转染时DNA/RNA(μg)和转染试剂(μL)用量为1∶2.5最佳[5]。RNA转染时,所用器械、枪头、EP管等均为RNA级。
1.2.6 荧光染料的准备 用灭菌的PBS溶解四甲基罗丹明标记的葡聚糖(Tetramethylrhodamine-labelled dextran),制备2 mg/mL的溶液,按每管30 μL分装在灭菌的PCR管中,-20 ℃长期保存(避光,避免反复冻融)。
1.2.7 小鼠超排 选取8~15周龄的健康雌鼠,腹腔注射0.5 mL PMSG(激素孕马血清促性腺激素,10 u/mL)。48 h后每只雌鼠腹腔注射0.5 mL hCG(人绒毛膜促性腺激素,10 u/mL),然后雌雄鼠同笼。16 h后检查雌鼠是否出现阴道栓,出现阴道栓说明受孕成功,此时胚龄定为0.5 d,再经过24 h,为1.5 d。
1.2.8 小鼠胚胎采集和电转 采集0.5 d受精卵:查明有阴道栓当天,在解剖室脱颈处死小鼠,剪开腹腔,掀开内脏,暴露子宫,剪取子宫和卵巢之间的输卵管后,放在盛有PBS的培养皿中。在解剖镜下用PBS清洗3次,用解剖针挑破输卵管上部膨大部分,游离出团块状受精卵,即为0.5 d胚胎,解剖镜下观察到胚胎处于1细胞期; 如采集1.5 d受精卵:在查明有阴道栓之后,将成功受孕的雌鼠分笼饲养,24 h后脱颈处死小鼠,剪取子宫和卵巢之间的输卵管后,放在盛有PBS的培养皿中,PBS清洗3次,用注射器吸取少量PBS,找到输卵管的上方开口,将注射器插入输卵管开口处,将PBS溶液注射进输卵管中,利用冲力冲出受精卵,可在解剖镜下观察到胚胎处于2细胞期。
将电转仪上的参数设置好,准备电转。将采集到的0.5 d的小鼠受精卵团块迅速放在透明质酸酶中消化38 s。在解剖镜下观察到受精卵基本散开时,利用制备好的转移工具将胚胎转移到电转液中,清洗3次; 1.5 d的小鼠胚胎直接用电解液清洗3次。最后将带有电转液的胚胎转移到电转槽中,利用更细的针将多余的电转液吸出,迅速加入用电转液稀释的待电转溶液(含有罗丹明染料、eGFPmRNA和eGFP质粒)。启动电转仪,同时在解剖镜下观察极板之间是否出现气泡,以此作为电转成功标志。然后迅速将胚胎和电转液一同吸出,用M16培养基清洗3~6次,转入培养基液滴中培养,加入矿物油将其完全覆盖。培养皿置于37 ℃、φ=5% CO2湿度饱和的培养箱内培养。
1.2.9 数据分析 分别观察电转罗丹明染料、eGFPmRNA和eGFP质粒后24 h的胚胎发育情况及荧光率,统计并分析相同脉冲电压条件下0.5 d和1.5 d胚胎的荧光率,以及相同细胞期不同电转电压的胚胎荧光率。使用SPSS 17.0软件进行统计分析,组间差异显著性标准为P<0.05。
2 结果与分析
2.1 pLL3.7质粒和eGFP mRNA表达效率验证
pLL3.7质粒携带eGFP标签,质粒大小为7 649 bp,与预期一致,如图1(右)所示。PCR得到带T7启动子的eGFP-CDS,片段大小为979 bp,与预期一致,如图1(左)所示。eGFPmRNA体外转录如图2 所示,片段大小为783 bp,与预期一致。
左图为eGFP模板检测 Left picture indicates detection of eGFP-CDS;M.DNA marker DL2000;1.coGFP质粒 coGFP plasmid;2.pLL3.7质粒 pLL3.7 plasmid;右图为pLL3.7eGFP质粒检测 Right picture indicates detection of pLL3.7eGFP;M.DNA marker DL 15000;1~2.pLL3.7质粒 pLL3.7 plasmid
图1eGFPpLL3.7质粒及体外转录模板检测
Fig.1DetectionofeGFPpLL3.7plasmidandtemplatesforinvitrotranscription

M.DNA marker DL2000;1.eGFPpLL3.7 mRNA 加尾后 TheeGFPpLL3.7 mRNA with tail;2.eGFPpLL3.7 mRNA 未加尾片段 TheeGFPpLL3.7 mRNA without tail
图2转录产物检测
Fig.2Detectionoftranscriptionproduct
pLL3.7质粒和eGFPmRNA制备完成后,以相同浓度使用DfectorTM、RfectorTM(上海吉荧)转染剂转染HEK293T细胞,培养24 h后利用荧光显微镜拍照,结果见图3,环状质粒荧光率约为70%,eGFPmRNA荧光率约为50%,对照组与试验组经过相同的转染步骤,转染液中未加外源物质。以上结果说明pLL3.7质粒和eGFPmRNA在HEK293T细胞中能高效正常工作,可用于胚胎电转。
2.2 电穿孔法将荧光染料、eGFP质粒和eGFP mRNA导入小鼠胚胎的条件优化
正常胚胎形态饱满,0.5 d为1细胞期,1.5 d为2细胞期,2.5 d为4细胞期,3.5 d为8细胞期;而异常的胚胎会出现不均等分裂、细胞核固缩等现象。0.5 d的小鼠胚胎由卵丘细胞包裹成团,需要用透明质酸酶将包裹在胚胎周围的卵丘细胞消化开。将荧光染料电转导入胚胎后,立即用荧光显微镜观察,判断其是否成功导入,然后立刻放回培养箱。24 、48 h后继续观察胚胎发育情况,记录电穿孔后胚胎荧光率及发育情况。
分别采集0.5 d和1.5 d胚胎,根据参考文献[6-8]设计不同脉冲电压,相同的电转间隔:电转电压X V,脉冲长度0.5 ms,脉冲间隔50 ms,脉冲次数3次,衰减率10%(+)。电转电压10 V,脉冲长度50 ms,脉冲间隔50 ms,脉冲3次,衰减率40%(+ -)。
电转罗丹明染料(2.0 mg/mL)进入胚胎,24 h 后胚胎发育情况如表2所示。在0.5 d的胚胎中,80、90 V均未能将罗丹明导入胚胎,110、150 V 虽然能将罗丹明导入胚胎,但最终没有正常发育。在1.5 d胚胎中,50 V未能将罗丹明导入,80 V只有极个别胚胎导入罗丹明,但随后正常发育的胚胎中未见有罗丹明;110 V时罗丹明的导入率约为63%,但其中只有部分胚胎能正常发育,最终导入罗丹明的胚胎存活率为27%;而当电压为150 V时,虽然罗丹明导入率有所提升,但正常发育的胚胎急剧下降,且最终发育正常的胚胎中未发现罗丹明。

图3 pLL3.7质粒和eGFP mRNA活性验证Fig.3 Validation of pLL3.7 vector and eGFP mRNA expression
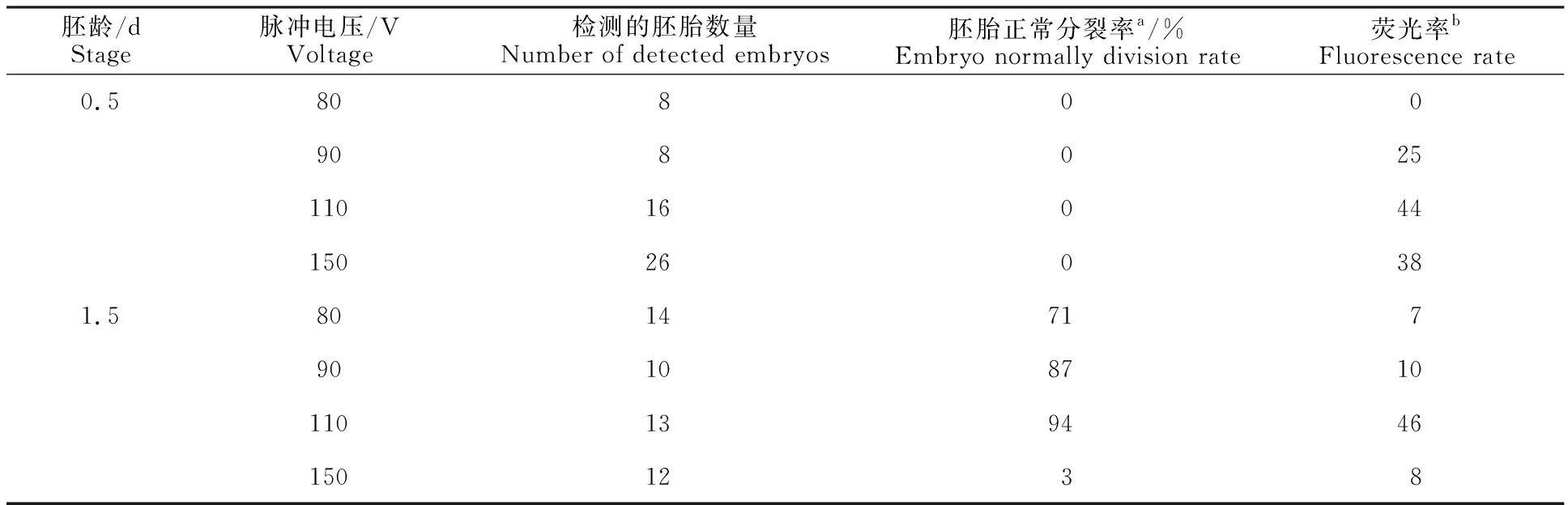
胚龄/d Stage脉冲电压/V Voltage检测的胚胎数量Number of detected embryos胚胎正常分裂率a/%Embryo normally division rate荧光率bFluorescence rate0.58080090802511016044150260381.58014717901087101101394461501238
注:a表示3.5 d正常发育至8~16细胞期的胚胎数与总胚胎数之比,取个位数。b表示电穿孔1 d后胚胎荧光率。下同。
Note: a.3.5 days ratio of number of embryos that normally develop to 8-16 cell stage to total number of embryos,in single digits.b.Embryo fluorescence rate one day after electroporation.The same below.
分别电转eGFP质粒(2.2 μg/μL)及eGFPmRNA(420 ng/μL)进入胚胎,24 h后胚胎发育情况如表3和4所示,低电压电转后胚胎发育较好。高电压条件下,胚胎大多无法正常发育。无论何种电压,eGFP质粒均不能被导入。eGFPmRNA在高电压情况下可导入0.5 d胚胎,但不能正常发育。

表3 电转eGFP质粒后胚胎发育情况Table 3 Embryo development after introducing eGFP plasmid
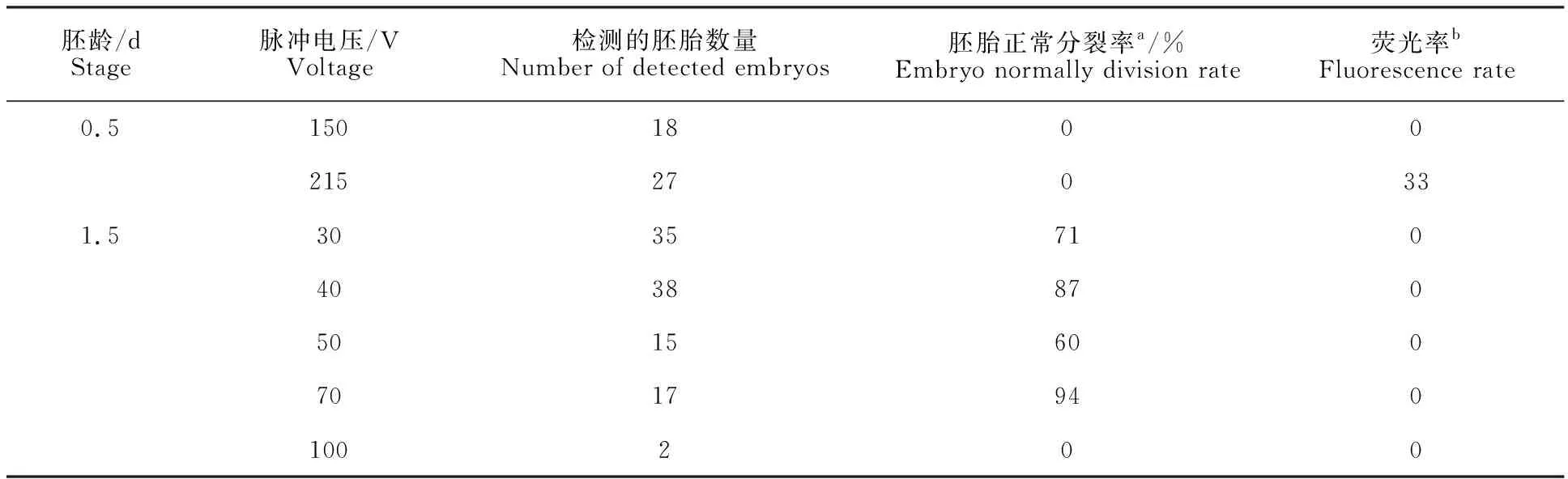
表4 电转eGFP mRNA后胚胎发育情况Table 4 Embryo development after introducing eGFP mRNA
3 讨 论
目前,常用的细胞转染方法转染效率较低、成本高,能用于转染胚胎的很少[9-12]。电穿孔转染法的作用机制是在高强度电脉冲条件下使细胞膜结构发生改变,使其膜上出现孔道,该孔道具有暂时性、亲水性以及可逆性特点,促使大分子物质可进入靶细胞,这种转染方式操作简便,且具有较高的转染率,通用性强,成本相对较低[7-8]。
本研究探索电穿孔法将外源物质导入小鼠胚胎的最优条件,先进行预试验即pLL3.7质粒和eGFPmRNA的表达效率验证。结果显示,pLL3.7质粒和eGFPmRNA均能在HEK293T细胞中表达,但pLL3.7质粒的绿色荧光明显较eGFPmRNA强,已知在转染相同浓度的核酸条件下,荧光强度受转染效率和表达效率的影响。转染质粒和mRNA使用的是吉荧生物的转染试剂,该试剂对这2种转染物质的转染效率均较高。推测eGFPmRNA在操作过程中存在一定程度的降解,但eGFPmRNA能够在细胞中表达,说明设计的体外转录体系正确。
本研究分别用0.5 d和1.5 d的小鼠胚胎探索电穿孔法导入外源物质的最佳条件。试验使用荧光染料和绿色荧光蛋白作为观察的标记物代替基因编辑组件,这样可省略突变检测环节,大大简化试验操作,缩短试验周期。试验首先选择的荧光染料是质量浓度为2 mg/mL的罗丹明。结果显示(表2),110 V是较理想的电压条件(P<0.05),且1.5 d的胚胎比0.5 d的胚胎更耐受电刺激,同样的电压条件下,1.5 d的胚胎存活率明显较0.5 d高(P<0.05)。然后将携带eGFP荧光标记的pLL3.7质粒作为外源物质进行离体胚胎电穿孔试验。虽然pLL3.7质粒质量浓度已达2.2 μg/μL,试验用110、150 V甚至更高的220 V电压,但结果均显示pLL3.7质粒未能被导入胚胎并表达,原因可能是质粒分子较大,而0.5 d 胚胎有透明带保护,质粒不易导入。最后,本研究尝试将体外转录得到的eGFPmRNA(电转质量浓度为420 ng/μL)通过电穿孔的方法导入胚胎,在用215 V高电压将mRNA导入0.5 d胚胎后,可以观测到绿色荧光,说明mRNA分子较小,能够进入胚胎并正常表达,但在胚胎后期发育中,没有正常分裂的胚胎,多数呈畸形,可能是高电压影响胚胎正常发育。
4 结 论
本研究结果表明,在体外通过电穿孔法将外源物质导入胚胎时的最佳电转条件为:电转电压110 V,脉冲长度0.5 ms,脉冲间隔50 ms,脉冲3次,衰减率10%(+);电转电压10 V,脉冲长度50 ms,脉冲间隔50 ms,脉冲次数3次,衰减率40%(+ -)。电压过高或过低均会导致电转效率或后期成活率显著下降,且1.5 d的胚胎(2细胞期)比0.5 d的胚胎(1细胞期)更适合电转。

