具杀虫活性雷公藤内生菌的分离与筛选
张宏利,高保卫,闫 合,冯俊涛 ,张 兴
(1.西北农林科技大学,旱区作物逆境生物学国家重点实验室,陕西杨陵 712100; 2.西北农林科技大学,无公害农药研究服务中心,陕西杨陵 712100)
植物内生菌是指一类生活史的一定阶段或全部阶段生活于健康植物的各种组织和器官内部的真菌或细菌,它们不仅包括互惠共利的和中性的内生共生微生物,也包括那些潜伏在宿主体内的病原微生物。植物内生菌可通过组织学方法或从严格表面消毒的植物组织和汁液中分离获得[1]。内生菌具有广泛性与多样性的特点,它们的代谢产物结构新颖、生物活性多样,已受到医药学、农药学和微生物学等多个领域的重视。从植物中筛选与开发具有农用价值的内生菌资源一直是新农药开发的重要研究内容[2-3]。
雷公藤(TripterygiumwilfordiiHook.f.)为卫矛科(Celastraceae)雷公藤属(Tripterygium)植物,又名黄藤根、霹雳木、断肠草等,广泛分布于中国长江流域以南。该植物是传统的植物源杀虫剂,在民间很早即被用于害虫防治。研究表明,雷公藤对鳞翅目、双翅目、鞘翅目、蜚蠊目等多种昆虫不仅表现出较强的毒杀作用,而且还有较强的拒食、麻醉、生长发育抑制和种群抑制等多种特异性杀虫作用[4-7]。雷公藤杀虫活性显著,其活性成分为生物碱类化合物,但该类化合物主要分布于根皮,这从资源上限制了该植物在农业上的应用。因此,如果能从与雷公藤共生的内生菌或其代谢物中寻找到杀虫活性成分,将会对该植物在农业上的应用奠定基础。鉴于此,本研究对雷公藤内生菌进行分离培养,经活性筛选后,以期获得杀虫活性较高的菌株。
1 材料与方法
1.1 植物材料
雷公藤新鲜植株,2011年3月采于福建省,挑选无可见病斑的雷公藤(生长3 a)根、茎、叶,分别放入自封袋,带回实验室4 ℃保存,3 d之内进行分离。材料由西北农林科技大学生命科学学院李玉平副教授鉴定并保存于西北农林科技大学无公害农药研究服务中心,样品编号为20130301。
1.2 供试昆虫
桃蚜(Myzuspersicae):采自西北农林科技大学附近农田桃树叶片,为大小一致健康的蚜虫。
卤虫(Artemiasaline):孵化后约4 h的I期卤虫无节幼体,孵化条件为25 ℃持续光照24 h,由西北农林科技大学无公害农药研究服务中心提供。
淡色库蚊(Culexpipienspallen)3龄幼虫,25 ℃温室培养,由西北农林科技大学无公害农药研究服务中心提供。
1.3 培养基
1.3.1 内生真菌分离纯化培养基 PDA培养基:土豆200 g,葡萄糖20 g,琼脂18 g,蒸馏水1 L。
麦芽膏培养基:麦芽膏15 g,琼脂15 g,蒸馏水1 L,pH 7.4~7.6。
雷公藤煎汁培养基:10 g植物样品熬制成汁,加入PDA培养中,定容至1 L。
上述培养基含抗生素最终质量浓度为链霉素50 μg/mL、氯霉素40 μg/mL。
1.3.2 内生细菌分离纯化培养基 TSA:胰蛋白胨15 g,大豆胨5 g,氯化钠3 g,琼脂15 g,蒸馏水1 L,pH 7.2~7.4。
NBY:牛肉汁3.5 g,酵母膏2.0 g,磷酸氢二钾2.0 g,磷酸二氢钾0.5 g,葡萄糖2.5 g,琼脂 15 g,蒸馏水1 L,pH 7.2~7.4。
NA:蛋白胨5 g,牛肉膏2.0 g,葡萄糖2.5 g,琼脂15 g,氯化钠3 g,蒸馏水1 L,pH 7.0~7.2。
上述培养基含抗生素最终质量浓度为放线菌酮40 μg/mL。
1.3.3 内生放线菌分离纯化培养基 高氏一号培养基:可溶性淀粉20 g,磷酸氢二钾0.5 g,七水硫酸镁0.5 g,七水硫酸亚铁0.01 g,氯化钠0.5 g,硝酸钾1 g,琼脂15 g,蒸馏水1 L,pH 7.2~7.4。
HVA:腐殖酸1.0 g,碳酸钙0.02 g,磷酸氢二钠 0.5 g,七水硫酸镁0.5 g,氯化钠1.7 g,七水硫酸亚铁0.01 g,维生素B10.5 mg,维生素B20.5 mg,维生素B60.5 mg,生物素0.25 mg,烟酸0.5 mg,肌醇0.5 mg,泛酸0.5 mg,对氨基苯甲酸0.5 mg,琼脂15 g,蒸馏水1 L,pH 7.2~7.4。
水琼脂培养基:葡萄糖10 g,酪蛋白水解物4.0 g,磷酸氢二钾0.5 g,七水硫酸镁0.2 g,二水氯化钙0.1 g,柠檬酸铁10 mg,七水硫酸钴0.01 mg,五水硫酸铜0.1 mg,硼酸1.5 mg,水合硫酸锰0.8 mg,四水钼酸铵0.2 mg,七水硫酸锌0.6 mg,琼脂18 g,蒸馏水1 L,pH 7.2~7.4。
上述培养基含抗生素最终质量浓度为萘啶酸15 μg/mL、制霉菌素50 μg/mL。
1.3.4 发酵培养基 内生真菌发酵培养基为PDB(PDA培养基不加入琼脂),内生细菌发酵培养基为NB(NA培养基不加入琼脂),内生放线菌发酵培养基为小米浸提液培养基(小米10 g,葡萄糖5 g,氯化钠2 g,可溶性淀粉10 g,碳酸钙2 g,pH 7.2~7.4)。
1.4 主要试剂
0.39 g/mL的次氯酸钠溶液,φ=75%酒精,甘油,萘啶酸(上海晶纯),放线菌酮(科昊生物工程有限责任公司),链霉素(西安舟鼎国生物技术公司),氯霉素(科昊生物工程有限责任公司)。
1.5 主要仪器设备
ES-315高压灭菌锅(TOMY)、HPG-208B光照培养箱(哈尔滨东明器械厂)、ZHWY-2112B超净工作台(苏州安泰空气技术有限公司)、D8611超纯水处理器(Barnstead)、U410低温冰箱(New Brunswick Scientific)。
1.6 雷公藤植物材料的前处理及内生菌的分离
用自来水将无病斑的植物样品冲洗30 min,叶直接摘下,将茎和根切成40 mm长的小段,根部样品在超声清洗仪中清洗1 min。无菌条件下先用φ=75%乙醇溶液浸泡样品5 min,然后用有效氯质量浓度为3.125 mg/L的次氯酸钠溶液浸泡 10 min,最后用φ=75%的乙醇浸泡1 min。消毒后的植物样品在无菌水中冲洗3遍,用无菌滤纸吸干表面的冲洗液。表面消毒后,剪去根和茎的两端,将木质部和韧皮部分开,弃去木质部,将韧皮部和叶片切成10 mm×10 mm的小段,用无菌手术刀片将组织块划伤,转移到上述培养基上,有伤口的一面朝向培养基,每个平板接5~6片组织块。平板上做相应的标记,在光周期L∶D=12∶12 的条件下培养15 d,光周期26 ℃,暗周期20 ℃。同时以最后一次冲洗样品的无菌水,涂布于无菌平板,作为空白对照,以检验表面消毒的彻底性。
1.7 雷公藤内生菌的纯化和保藏
待组织块的边缘有菌丝长出,挑取菌丝接于新的相应的培养基平板继续培养,直到纯培养,然后分别于4 ℃和-70 ℃冰箱中保存。
1.8 不同菌株内生菌对卤虫的杀虫活性
称取卤虫卵0.25 g于100 mL量筒中,用NaHCO3将人工海水(按表1配制)的pH调至8.0~8.5,取90 mL加入量筒中,置于25 ℃光照培养箱内,用小型充气泵从量筒的底部缓慢地充气,使虫卵保持悬浮,持续光照使其孵化。24 h后得到孵出约4 h的Ⅰ期卤虫的无节幼体,然后利用卤虫的趋光性,用吸管收集,备用。将上述人工海水培养24 h的卤虫用移液枪吸取100 μL到96孔板内,每孔虫数为10~15头,再加入100 μL无菌发酵液,每处理重复8次,20~25 ℃光照条件下培养,24 h后用解剖镜检查并记录结果。
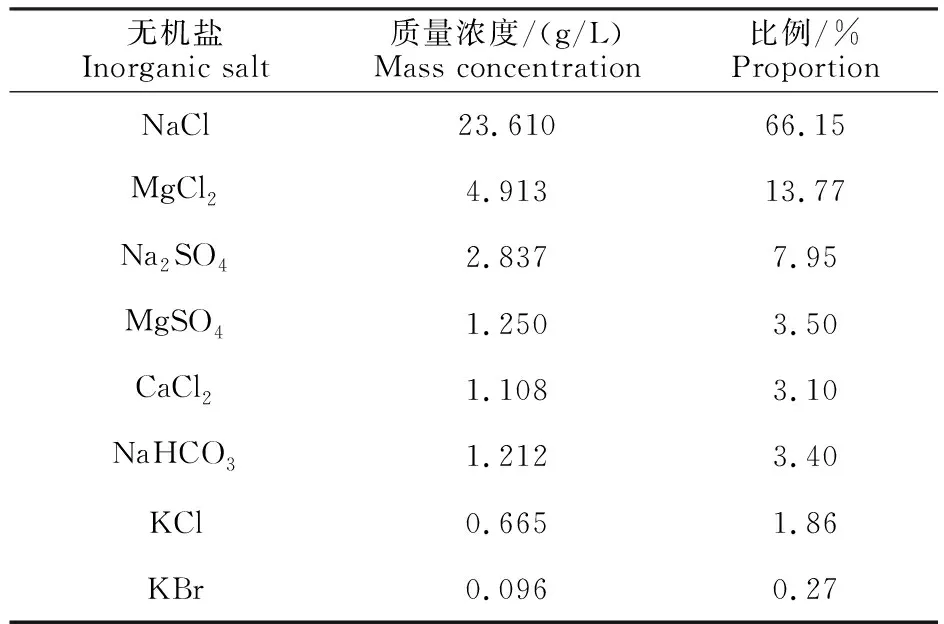
表1 人工海水配方Table 1 Formulation of artificial seawater
1.9 不同菌株内生菌对3龄蚊幼的杀虫活性
发酵液对3龄蚊幼活性测试:分别取各菌株的无菌发酵液10 mL加入到25 mL烧杯中,再用纱网捕捉10头3龄蚊幼分别加入烧杯中。每个处理重复3次,以未接种的无菌发酵液为空白对照,12 μg/mL雷公藤总碱为药剂对照。
菌丝粗提物对蚊幼活性测试:取1.5 g菌丝得到的提取物用0.05 mL甲醇溶解,用蒸馏水定容至10 mL,即菌丝质量浓度为0.15 g/mL。摇匀后用纱网捕捉10头3龄蚊幼,分别加入烧杯中。每个处理重复3次,以φ=0.5%甲醇溶液为空白对照,10 μg/mL雷公藤总碱为药剂对照。置于养虫室20~25 ℃,光周期L/D=12 h/12 h。在24 h时记录并计算校正死亡率。
死亡率=死亡虫数/供试试虫总数×100%
校正死亡率=(处理死亡率-对照死亡率)/(1-对照死亡率)×100%
1.10 活性菌株发酵液萃取物及菌丝粗提物对桃蚜活性的测定
采用浸虫浸液法。桃蚜采自桃树,将带蚜虫的桃树叶片基部用湿棉球保湿,镜检蚜虫数量,保留生长发育较一致的蚜虫,分别在粗提物(吐温80体积分数为1%)中浸3~4 s,取出后用吸水纸吸干蚜虫周边的药液,放置在培养皿中,每处理蚜虫数为80~100头。粗提物分别用φ=5%的甲醇溶解,菌丝粗提物质量浓度设定为(以菌丝的质量计) 0.15 g/mL,发酵液浓缩(以相对于原发酵液体积计)10倍,φ=5%的甲醇溶液为空白对照,30 μg/mL雷公藤总碱为药剂对照。28 ℃、24 h 后镜检存活数,计算死亡率。
将上述方法得到的杀蚜活性较高菌株的菌丝粗提物设置5个质量浓度,同样方法测定其毒力并计算LC50值。
2 结果与分析
2.1 雷公藤内生菌的分离
从雷公藤植株中共分离得到内生菌183株(表2),其中真菌111株,放线菌23株,细菌49株。真菌比例最大,占总分离菌株数的60.66%,细菌占总分离株数的26.78%,放线菌占总分离株数的12.57%。雷公藤植株不同部位的内生菌数量有较大的差异,其中根部分离得到的内生菌最多(89株),占总数的48.63%,叶部次之(72株),占总数的39.35%,茎部分离得到的内生菌最少(22株),占总数的12.02%。

表2 雷公藤不同组织内生菌的组成及分布Table 2 Isolation of endophytes from different tissue of Tripterygium wilfordii
2.2 不同菌株内生菌对卤虫的杀虫活性
测定183株内生菌发酵液对卤虫的毒杀活性,24 h后检查卤虫死亡情况,结果表明(表3),卤虫死亡率在90%以上的有11-3-8、11-3-37、11-6-58、11-6-76、11-6-73等34株菌株,占供试菌株的18.58%,其中死亡率达到100%的有21株菌株,占供试菌株的11.48%。对卤虫有毒杀活性的菌株在雷公藤根部分布最多(表4),共有19株,占分离总株数的10.93%;其次是叶部,有11株,占分离总株数的6.01%;茎部得到的活性菌株最少,仅3株,占分离总株数的1.64%。由表4可知,34株活性菌株中有33株真菌,1株放线菌。

表3 183株内生菌发酵液对卤虫的毒杀活性统计Table 3 Insecticidal activity against Artemia of 183 endophytes fermentation broth (24 h)
注:“-”为此处菌株编号略。下同。
Note: “-”Omitting of the strain number.The same below.

表4 对卤虫有毒杀活性的菌株在植物不同组织的分布Table 4 Distribution of insecticidal activity against Artemia strains in different tissues
2.3 不同菌株内生菌对3龄蚊幼的杀虫活性
183株内生菌发酵液对蚊幼活性测试结果显示(表5),10 μg/mL雷公藤总碱对蚊幼的毒杀效果为78.64%。24 h死亡率在70%以上的菌株有11-3-37、11-6-59、11-6-76、11-6-71等18株,占分离总株数的9.83%。对蚊幼有毒杀活性的菌株在雷公藤根部分布最多(表6),共有13株,占分离总株数的7.10%;其次是叶部,有5株,占分离总株数的2.73%;茎部没有得到活性菌株。从微生物类群上看,活性菌株主要是真菌。

表5 183株内生菌发酵液对3龄蚊幼的毒杀活性统计(24 h)Table 5 Insecticidal activity against 3rd instar larvae of Culex pipiens of 183 endophytes fermentation broth(24 h)
注:10 μg/mL雷公藤总碱为药剂对照,对蚊幼的毒杀效果为78.64%。
Note: 10 μg/mL alkaloids ofTripterygiumfor pharmaceutical control,the mortality rate on the larvae ofCulexpipienswas 78.64%.
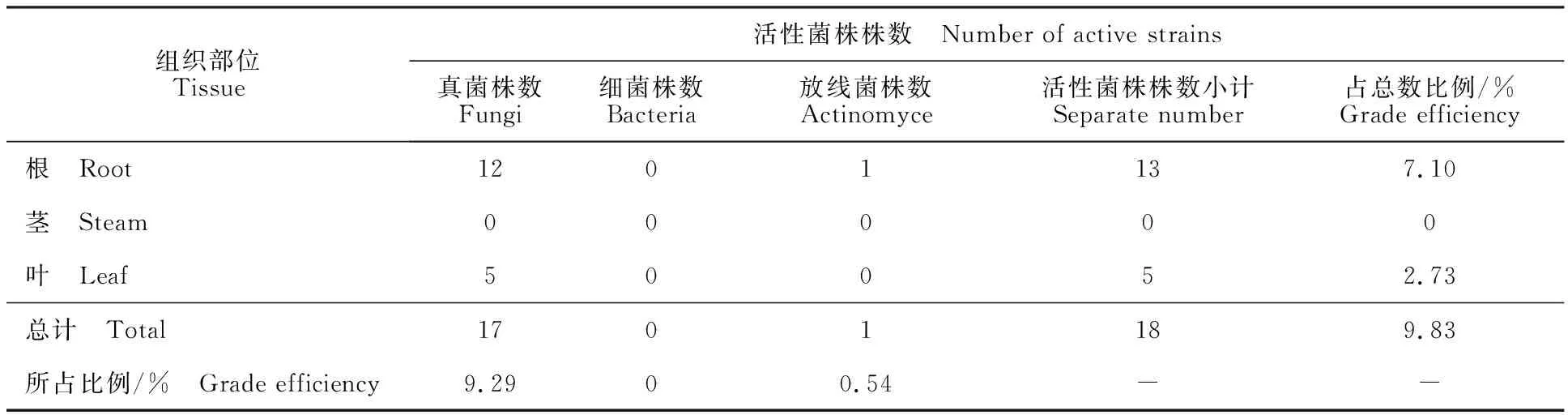
表6 对3龄蚊幼有毒杀活性的菌株在植物不同组织的分布Table 6 Distribution of insecticidal activity against 3rd instar larvae of Culex pipiens strains in different tissues
从以上结果可知,有34株菌株发酵液对卤虫有较高的活性,其中有18株同时对蚊幼有较高的毒杀活性。经过多次发酵试验验证这18株菌株对蚊幼的毒杀活性相对稳定,可以作为下一步杀虫活性研究的供试菌株。这些菌株的发酵液对卤虫和蚊幼的毒杀效果都在70%以上,其中有11株菌株发酵液对蚊幼的毒杀活性达到100%,高于10 μg/mL雷公藤总碱对蚊幼的毒杀效果(78.64%)。从活性菌株在植物的不同组织分布上看,活性菌株主要集中在根部组织和叶部组织,分别占分离总株数的7.10%和2.73%,茎部组织没有活性菌株分布。从微生物类群上看,活性菌株中有17株真菌和1株放线菌,分别占分离总株数的9.29%和0.54%,真菌占绝大多数。
2.4 18株内生菌发酵产物对桃蚜的杀虫活性
采用浸虫浸液法测试18株内生菌发酵产物对蚜虫的毒杀活性,结果表明6株内生菌具有一定杀蚜虫活性,其中11-6-76、11-6-71和11-2-43菌株的菌丝粗提物杀蚜活性较高,处理24 h后蚜虫的死亡率分别为70.75%、66.83%和60.95%;11-3-37、11-6-76、12-2-47和11-2-43菌株的发酵液也具有较高的杀蚜活性,处理24 h后蚜虫的死亡率分别为82.74%、78.64%、76.97%和64.48%。11-6-76 和11-2-43 菌株的发酵液和菌丝粗提物均具有较高的杀蚜活性(表7)。
2.5 3株内生菌菌丝粗提物的杀蚜活性毒力测试
对杀蚜活性较好的3株菌株12-2-47、11-6-76和11-3-37的菌丝粗提物进行毒力测定,结果显示(表8),菌株11-3-37、11-6-76 和12-2-47菌丝粗提物对蚜虫的LC50分别为34.8 mg/mL,31.2 mg/mL和46.4 mg/mL。
通过用粗提物测试杀蚜活性结果得到2株活性较好的菌株,其中菌株11-6-76的发酵液和菌丝粗提物均有较高的活性,死亡率分别为 78.64%和70.75% ,菌株11-3-37的菌丝粗提物对蚜虫的毒杀活性也比较好,死亡率为82.74%,活性均高于药剂对照。

表7 不同菌株内生菌代谢产物的杀蚜活性(24 h)Table 7 Insecticidal activity of strains crude extracting agaist Myzus persicae(24 h)
注:试验所设对照死亡率为0,同列死亡率后的不同小写字母表示差异达显著水平(P<0.05)。
Note:Control mortality is 0,column followed by different letters were significantly different (P<0.05) by Duncan’s multiple rang test.

表8 3株菌株胞内代谢产物杀蚜活性测定(24 h)Table 8 Insecticidal activity of 3 strains crude extracting agaist Myzus persicae(24 h)
注:毒力方程中x为质量浓度对数,y为死亡率机率值。
Note: In the virulence equation,xis logarithm of mass concentration andyrepresents mortality probability.
3 讨 论
本研究表明,雷公藤组织内存在丰富的内生菌,不同组织内生菌的数量、种类有一定差异,在具有杀虫活性的菌株中,放线菌占的比例最高。通过对雷公藤组织处理的消毒液进行培养,发现培养基上无菌落生长,表明本研究中所分离得到的菌株为雷公藤组织内的内生菌。
目前,对雷公藤内生菌的研究主要集中在内生真菌上,对内生细菌和放线菌的分离研究较少。对菌株活性的研究也主要集中在医药领域,农用活性的相关研究只有很少的文献报道,且仅限于抑菌活性的相关研究。宋萍等[8]从雷公藤不同组织器官中共分离得到22株不同形态型的内生真菌,组织部位包括植株的根、茎、叶,其中植株枝中的分离数量高于根和叶。22株内生真菌中大多数都具有一定程度的抑菌活性。通过对金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escherichiacoli)、白色念珠菌(Candidaalbicans)、枯草芽孢杆菌(Bacillussubtilis)等的活性筛选,发酵液提取物的抑菌活性好于菌丝体提取物,并得到对病原真菌具有较好抑制作用的内生真菌。申屠旭萍等[9]从雷公藤植株中分离得到36株内生真菌,通过活性筛选得到一株对黄瓜立枯病菌、水稻纹枯病菌、葡萄炭疽病菌、黄瓜枯萎病菌等均具有较好抑制效果的内生真菌。随着对药用植物资源研究的深入,寄生于药用植物体内的内生菌不断被发现,他们不但对寄主植物次生代谢产物的产生具有一定的促进作用,而且自身也会产生与植物活性物质相同或类似的物质。例如,王梅霞等[10]报道一株从银杏中分离的内生真菌EG4的次生代谢物中含有黄酮。
本研究通过对雷公藤内生菌杀虫活性的筛选发现其中部分菌株发酵液具有较好的杀虫活性,它们的杀虫活性是否与发酵产物含有雷公藤生物碱有关需要做进一步的分离验证。

