2种霉菌毒素吸附剂对牦牛体重及血清生化指标的影响
赵佳琦,文勇立*,安雅静,李子谦,齐沛森,李 强,扎 升,亡 头,侯定超
(1.西南民族大学青藏高原研究院,四川成都 610041;2.四川省畜牧总站,四川成都 610041;3.金川县畜牧兽医服务中心,四川金川 624100)
霉菌毒素是由霉菌产生的次级代谢产物,广泛存在于发霉饲料原料(如玉米及秸秆、白酒糟)中,常见有黄曲霉毒素B1(AFB1)、玉米赤霉烯酮(ZEA)等。霉菌毒素导致动物肝功能损伤、生产性能下降等,并在机体内积累、富集、放大,经食物链危及人类健康[1]。由于反刍动物对霉菌毒素的耐受性高于单胃动物,往往未引起人们重视,但若其摄入被霉菌毒素污染的饲料,会使瘤胃微生态紊乱,抑制瘤胃发酵性能,影响血清生化指标,进而危害消化、繁殖等功能[2-3]。防治霉菌毒素污染的常用方法是在饲料中添加吸附剂[4],其中,酵母细胞壁提取物(YCW)和蒙脱石(MMT)应用广泛。YCW主要成分为β-葡聚糖和甘露寡糖,可吸附、降解霉菌毒素,改善瘤胃菌群结构[5]。MMT属水合铝硅酸盐类(HSCAS)吸附剂,能够与霉菌毒素结合形成稳定的复合物[6]。这2种吸附剂可减轻霉菌毒素对禽、猪生长及肝细胞的危害,降低血清转氨酶浓度,提高饲料转化率[7-8]。目前关于以上2种吸附剂的相关研究一般针对家禽或单胃动物,涉及牦牛等反刍动物的研究鲜见报道[9],且忽略多种吸附剂混合使用。
牦牛是青藏高原地区重要的生产生活资料、经济发展支柱。为提高生产水平,部分地区将天然放牧转变为舍饲、半舍饲养殖,其饲料投入品不可避免受到霉菌毒素污染。因此,本试验旨在研究2种吸附剂对牦牛体重及血清生化指标的影响,为相关研究及生产提供参考。
1 材料与方法
1.1 试验材料 MMT(>95%,赤峰和明生化工有限公司)、YCW(甘露寡糖≥20%,β-葡聚糖30%~40%,安琪酵母股份有限公司)。
1.2 试验设计 试验于2018年4月11日—5月21日在四川省阿坝藏族羌族自治州金川县庆宁牦牛养殖场进行,预试期、正试期各20 d,预试期测定牦牛的体重和日采食量(干物质基础,下同),选取体重和采食量差异较小(标准偏差在5%以内)、健康、发育良好的牦牛32头,雄性,年龄3.5岁。日粮精粗比为1:3.6(主要有玉米秸秆、玉米、白酒糟;主要营养成分为干物质83.94%、粗蛋白质12.55%、粗脂肪2.37%、粗纤维97.12%[10]),每天饲喂2次(06:00和18:00),自由采食和饮水,每次饲喂前先将吸附剂掺于部分饲料中混匀,待采食完全后再投喂剩余饲料。经测定,平均体重、采食量分别为(288.25±12.04)kg和(9.00±0.31)kg。采用两因素多水平随机试验设计,参考产品说明书及文献[11],MMT 4水平(占日粮干物质比例,下同)分别为0(对照)、0.1%、0.2%、0.4%,YCW 4水平分别为0(对照)、0.2%、0.4%、0.6%,MMT各水平与YCW各水平交叉组合形成4×4共16个组合,设1组重复,共计牦牛32头。试验分组见表1。
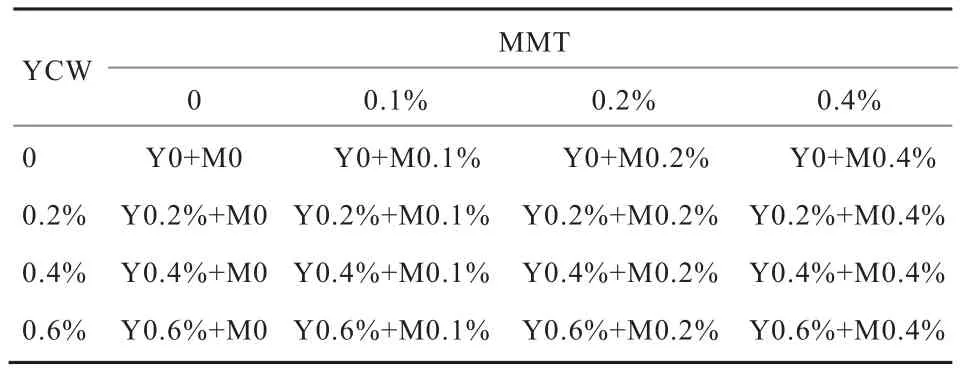
表1 试验分组
1.3 样品采集 血样采集:于结束试验第2天,颈静脉采血10 mL,4 000 r/min离心15 min,取血清,冷冻保存。
饲料样品采集:采用《饲草产品抽样技术规程》(NY/T 2129-2012)采集3种饲料样品,于预试期前4 d,每天在06:00和18:00饲喂前每种饲料各采集2个样品(100 g/个),避免杂质和微生物污染,置塑料袋,冷藏。
1.4 测定指标与方法 牦牛增重量:分别在正试前1 d和结束试验第2天空腹称重,后者与前者之差为增重量。
日采食量:预试期连续3 d,逐日测定并记录每头牦牛每天的喂料量和剩料量,二者之差为采食量。依照《饲料中水分和其他挥发性物质含量的测定》(GB/T 6435-2006)将风干饲料换算为干物质含量。
饲料AFB1含量:采用《饲料中AFB1的测定 酶联免疫吸附法》(GB/T 17480-2008)及微波消解仪(CEM MARS6,美国 Py NN Inc.)、酶联免疫检测仪(Bio-Tek ELX808,中国,宝特科技有限公司)、AFB1酶联免疫试剂盒(中国,百奥森科技有限公司;含AFB1标准品,以色列,FERMENTEK公司),测定玉米粉、白酒糟和玉米秸秆样品中AFB1含量。
血清生化指标:采用全自动生化分析仪(日立7600)测定谷丙转氨酶(ALT)、谷草转氨酶(AST)、白蛋白(ALB)、碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)、谷氨酰氨基转移酶(GGT)和总胆汁酸(TBA)。
1.5 统计分析 根据文献[12]介绍的方法,采用SPSS 22.0进行多变量方差分析,并估计单因子效应及交互效应,采用LSD法进行水平间多重比较,结果用平均值±标准误表示。
2 结果与分析
2.1 饲粮中AFB1含量 由表2可知,与《饲料卫生标准》(GB 13078-2017)中霉菌毒素限量比较,玉米粉的AFB1含量平均值在安全范围内,但玉米秸秆和白酒糟AFB1含量存在部分超标现象。
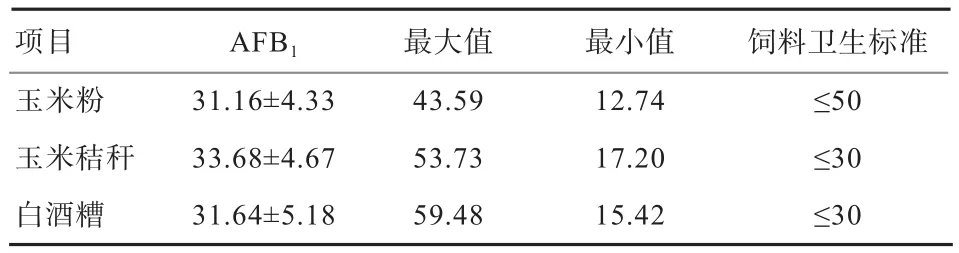
表 2 饲粮中 AFB1 含量 μg/kg
2.2 2种吸附剂对牦牛增重及血清生化指标的影响 由表3可知,3种处理中MMT组和混合组(MMT+YCW)对增重及谷丙转氨酶(ALT)等7个血清生化指标的总体影响达到极显著水平(P<0.01),而YCW组对各变量总体影响不显著(P>0.05)。以上说明,饲料中添加MMT或混合添加2种吸附剂对牦牛增重及血清生化指标具有影响。
方差分析显示,MMT组对增重及ALT的影响极显著(P<0.01);YCW仅对ALT作用显著(P<0.05);混合组对增重及ALT的影响显著(P<0.05),说明饲料中单独添加MMT或YCW或同时添加2种吸附剂均对牦牛增重量及ALT具有影响。
2.3 MMT对牦牛增重及血清生化指标的影响 由表3可知,M0.1%组增重量显著高于M0组和M0.2%组(P<0.05),M0.2% 组 低 于 对 照 组(P>0.05) 和M0.4%组(P<0.05),M0.4%组高于M0组(P>0.05),表明,MMT添加量为0.1%时,具有提高增重的作用。M0.1%组ALT浓度显著低于M0组、M0.2%组、M0.4%组(P<0.01),M0.2%组高于M0组(P>0.05),M0.4%组 高 于 M0组、M0.2%组(P>0.05), 提 示MMT添加量大于0.1%时,对牦牛肝功能可能存在不利影响。AST浓度大小顺序为M0.2%组<M0.4%组<M0.1%组<M0组(P>0.05),LDH和TBA浓度大小顺序为M0.2%组<M0.1%组<M0.4%组<M0组(P>0.05), 以 及 ALB浓 度 M0.2% 组 <M0.4% 组<M0组 <M0.1%组(P>0.05)。表明,当 MMT添加量达到0.2%时AST、LDH和TBA浓度最低,之后升高;而ALB浓度变化相反,添加量0.2%时最高,之后降低,但由于差异不显著,结果有待于进一步验证。此外,M0.1%组、M0.2%组、M0.4%组中ALP和GGT浓度随着MMT添加量的升高而逐渐下降(P>0.05)。
2.4 YCW对增重及血清生化指标的影响 由表3可知,各组中增重量大小顺序为Y0.2%组>Y0.6%组>Y0.4%组>Y0(P>0.05),表明,YCW添加量为0.2%时,促进牦牛生长。Y0.4%组中ALT浓度显著低于其他3组(P<0.05),其他3组差异不显著(P>0.05),表明日粮中添加YCW能有效降低ALT浓度,且当添加量为0.4%时ALT浓度最低,添加量达到0.6%时ALT浓度升高。各组中ALB浓度大小顺序为Y0.2%组>Y0组 >Y0.6% 组 >Y0.4% 组(P>0.05),LDH和 TBA浓度大小顺序均为Y0.4%组<Y0.6%组<Y0.2%组<Y0组(P>0.05)。可见,在YCW添加量为0.2%时ALB浓度最高,添加量为0.4%时LDH和TBA浓度最低(P>0.05),但由于结果差异不显著,尚有待进一步验证。与Y0组相比,3个YCW组ALP浓度均有所升高(P>0.05)。Y0.2%组、Y0.4%组、Y0.6%组AST和GGT浓度随YCW添加量的升高呈下降趋势(P>0.05),与MMT对GGT影响的变化规律一致。
2.5 混合组对牦牛增重及血清生化指标的交互效应分析鉴于前述混合组(MMT+YCW)对增重量及ALT浓度的影响差异显著(P<0.05),而对其余指标影响差异均不显著(P>0.05)。因此,仅对增重量及ALT进行分析,由表3可知,各混合组比较,Y0.2%+M0.1%组的增重量均值最大(71.50 kg),其次为Y0.4%+M0.1%(61.00 kg)。这表明以MMT为0.1%、YCW为0.2%混合使用时牦牛体重增长较大;各混合组中,Y0.4%+M0.1%组ALT浓度最低(9.0 IU/L),其次为Y0.6%+M0.1%组(15.50 IU/L)。这表明以MMT为0.1%、YCW为0.4%混合使用时血清ALT浓度较低。
3 讨 论
3.1 MMT和YCW对牦牛增重及血液生化指标的影响本试验在日粮中添加MMT,牦牛增重量显著提高,这与Norouzian等[13]在羔羊日粮中添加HSCAS类吸附剂的结果一致。且本试验所用的饲料中,玉米秸秆和白酒糟均存在霉菌毒素污染的现象,表明牦牛增重显著提高是MMT对霉菌毒素吸附作用的结果[14]。当MMT添加量为0.1%时,增重量最大,之后显著下降,这一变化与王黎文等[11]、Grabherr等[15]研究奶牛饲粮中MMT添加量对日均采食量影响的规律一致。可见,过高剂量MMT不利于牦牛增重,究其原因,目前认为可能有3点:其一,MMT具有较大的膨胀性[14],吸水膨胀形成触变凝胶体,阻碍食糜在瘤胃中的消化作用,产生“饱感”;其二,MMT可能影响饲料适口性,从而影响采食[16];其三,MMT可能对饲料中氨基酸、维生素等营养物质有非选择性吸附的特点,从而影响动物对营养成分的吸收[17]。本试验中,当MMT添加量达0.4%时,出现牦牛增重量上升的现象,有待进一步研究。本试验中添加YCW牦牛增重量有升高趋势,与Young等[18]、Tao等[19]对肉牛及荷斯坦犊牛日增重的相关研究结果一致,但由于结果差异不显著,尚需进一步验证。
ALT和AST是反映肝功能是否正常的重要指标。霉菌毒素可损害肝脏功能,使血清中ALT、AST、LDH等浓度升高[20],而HSCAS类物质可减轻霉菌毒素对畜禽肝脏、肾脏等的损伤。本试验中ALT浓度在MMT添加量为0.1%时最低,之后随着MMT添加量的增加而升高,且该处理组的ALT浓度显著低于对照组,AST浓度也有所降低,该趋势与张建刚等[21]研究结果吻合,因此,本试验推荐MMT添加剂量不超过0.1%,但该推荐剂量低于上述研究对奶牛日粮中添加0.5%MMT的推荐剂量[21],可能与牦牛体重小、采食量小以及基础日粮、霉菌毒素感染等不同情况有关。
YCW能提高动物的非特异性免疫功能,降低血清中ALT和AST水平[3,22]。Swamy等[23]将葡甘露聚糖添加到被霉菌毒素污染的饲料发现,可改善肉鸡血清酶的异常情况。王兆钧[24]也发现β-葡聚糖可缓解霉菌毒素对动物机体的不良影响。但上述文献均未指出吸附剂的有效添加量。本试验中在YCW添加量为0.4%时,ALT浓度显著低于对照组,因此,将该剂量作为推荐剂量。
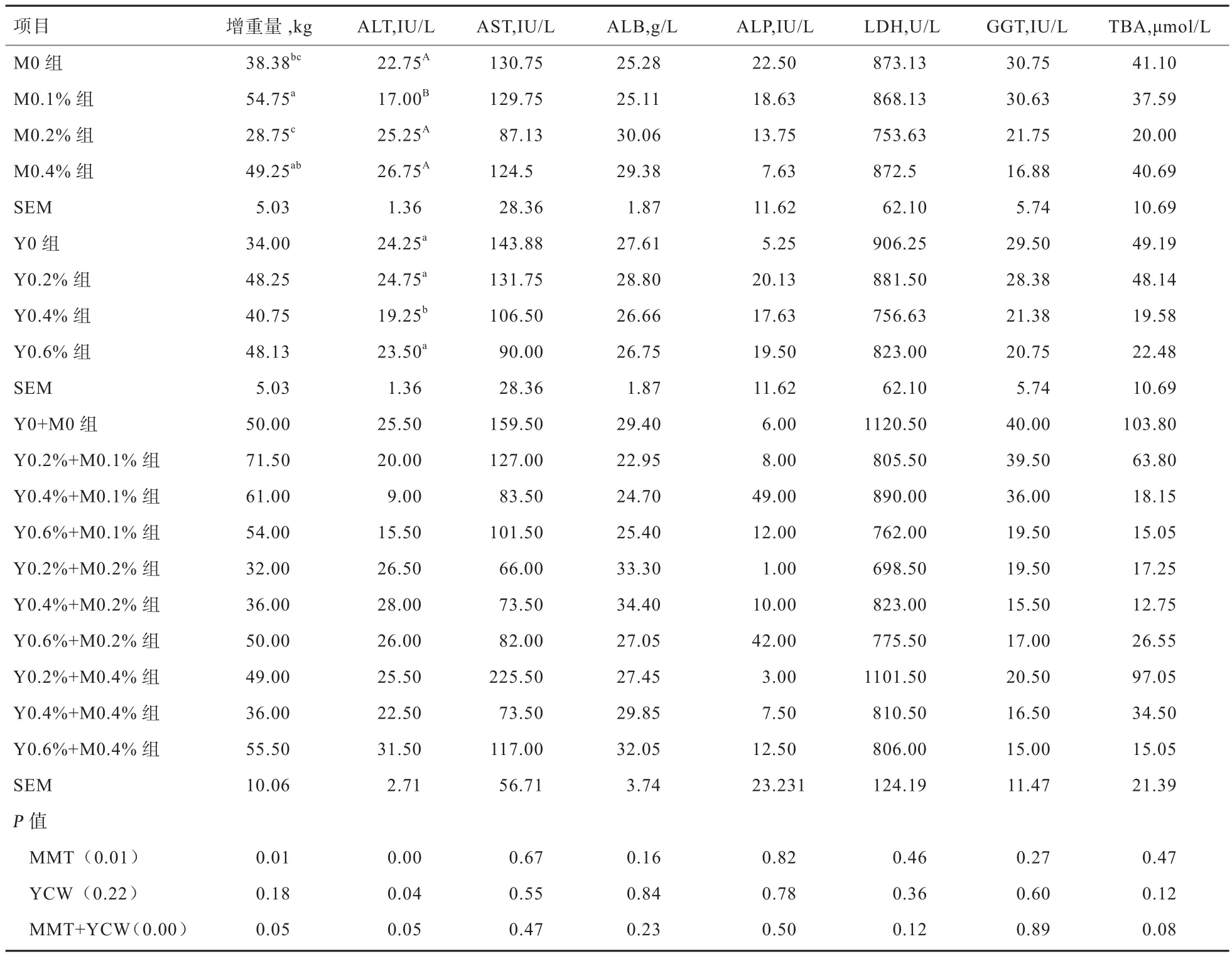
表3 MMT和YCW对牦牛增重及血清生化指标的影响
LDH、GGT、TBA也能反映肝脏的健康状况。本试验添加2种吸附剂后,上述3个指标的浓度均有下降趋势。ALB能反映动物营养状况和免疫水平[25]。本试验单独添加2种吸附剂均使ALB浓度有所上升,这与Devegowda等[26]的研究结果一致。以上说明2种吸附剂能够维持ALB浓度,从而促进机体对营养物质的代谢。
3.2 2种吸附剂混合使用的效果 本试验2种吸附剂混合使用显著提高牦牛增重量,降低血清ALT浓度,这一结果与吕明斌等[16]、陈光明等[27]对肉鸡的相关研究吻合。但就检索文献看,未见二者配合使用时的推荐剂量,本试验Y0.2%+M0.1%组的牦牛增重量最大,且其ALT浓度低于对照组,由此说明该剂量吸附剂不仅可显著提高增重量,还有效保护肝脏的正常生理功能,可作为推荐使用剂量。此外,混合使用吸附剂时增重量的最大值大于2种吸附剂单独使用时的最大值,混合使用吸附剂时ALT浓度最小值也小于2种吸附剂单独使用时的最小值,可见,两者混合使用较单独使用任意一种吸附剂的作用效果更好,这也与陈光明等[25]的试验结果一致。张彩霞等[28]针对体外吸附试验也指出MMT与YCW配合使用较单一吸附剂的作用效果显著。这是由于MMT仅适于吸附带有极性基团的霉菌霉素,而不易吸附极性不强的霉菌毒素[29],但YCW中β-葡聚糖恰好弥补了MMT的这一缺陷。β-葡聚糖呈非常稳定的螺旋结构,可通过氢键和范德华力与多种霉菌毒素相互作用[5]。而YCW中甘露寡糖(MOS)成分还起到免疫增强剂的作用,MOS不但能促进有益菌增殖,还能吸附病原菌,改善肠道微生态,增强动物非特异性免疫,提高动物抵抗力[30]。因此,2种吸附剂功能互补,使作用效果更显著。
4 结 论
适量添加MMT或YCW或混合使用2种吸附剂能促进牦牛体重增长,保护肝功能,且混合使用较单独使用,效果更优。牦牛日粮中MMT适宜添加量为0.1%,YCW为0.4%。推荐以MMT为0.1%、YCW为0.2%联合使用,可显著增加牦牛增重量,并具有保护肝功能的作用。

