多环芳烃分子印迹柱-高效液相色谱荧光检测法快速测定烤肉中15 种多环芳烃
阳文武,谭顺中,郭 娅,*,周 浓
(1.重庆市万州食品药品检验所,重庆 404000;2.重庆三峡学院生物与食品工程学院,重庆 404000)
多环芳烃(polycyclic aromatic hydrocarbons,PAHs)是由2 个或2 个以上苯环稠合而成的一类芳香族化合物,主要由有机物质(包括油、木材、垃圾废物和煤)的热解和不完全燃烧产生,在食品加工过程(如熏、烤、烘培、煎、炸等)中可能产生PAHs。PAHs具有“三致”(致癌、致畸和致突变)毒性,属于持久性有机污染物[1-3]。欧盟委员会835/2011号文件《Amending regulation(EC) No 1881/2006 as regards maximum levels for polycyclic aromatic hydrocarbons in foodstuffs》规定,熏、烧、烤肉制品中苯并(a)芘的限量为2 μg/kg(欧盟委员会No1881/2006号文件《Setting maximum levels for certain contaminants in foodstuffs》规定限量为5 μg/kg),且PAH4(䓛、苯并(a)蒽、苯并(b)荧蒽、苯并(a)芘)的总量不大于12 μg/kg(欧盟委员会No1881/2006号文件规定总量不大于30 μg/kg),而我国GB 2762—2017《食品安全国家标准 食品中污染物限量》中仅对PAHs中的苯并(a)芘规定了限量为5 μg/kg(GB 2762—2012《食品安全国家标准 食品中污染物限量》中也为5 μg/kg),暂未对其他PAHs规定限量值。鉴于烤肉在日常生活中的重要性,对烤肉中PAHs的含量水平进行监测对确保烤肉安全具有十分重要的意义。
目前,关于PAHs污染情况的文献报道集中在水[4-6]、大气[7-9]、土壤[10-12]及食用油[13-15]等方面,对烤肉中PAHs的污染状况却鲜有报道。检测PAHs的方法主要有高效液相色谱-荧光检测(high performance liquid chromatography-fluorescence detection,HPLC-FLD)法[16-18]、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)法[19-21]、高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLC-MS/MS)法[22-24]等,大部分已有报道多采用索氏提取法[25-27]、超声波提取法[28-30]等。索氏提取法整个过程耗时长,有机溶剂用量大,不适合实验室大批量的检验工作,本研究用少量乙腈超声提取后,采用多环芳烃分子印迹柱(molecular imprinting column of PAHs,MIP-PAHs)净化,净化后的样品进行HPLC-FLD检测。
1 材料与方法
1.1 材料与试剂
烤鸭(15 批次)、烤鸡肉(2 批次)、烤肉(2 批次)、烤羊肉(2 批次)、烤牛肉(3 批次)样品购自重庆市东北片区(包括万州区、梁平区、忠县、开州区、云阳县、奉节县、巫山县、巫溪县及城口县)不同摊位。
乙腈、正己烷、二氯甲烷(均为色谱纯) 北京迪马科技有限公司;15 种PAHs混合标准溶液 北京曼哈格生物科技有限公司;苊、芴、芘、菲、蒽、萘、荧蒽、苯并(a)蒽、苯并(a)芘、二苯并(a,h)蒽、苯并(b)荧蒽、茚并(1,2,3-c,d)芘、苯并(k)荧蒽、苯并(g,h,i)苝、䓛标准溶液 美国ChemService公司;MIP-PAHs 德国CNW公司。
1.2 仪器与设备
Agilent 1260高效液相色谱仪(配备荧光检测器)美国安捷伦科技有限公司;KH-2000DB超声波清洗器昆山禾创超声仪器有限公司;摩尔基因型1850C超纯水机上海摩勒科学仪器有限公司;IKA MS3涡旋振荡器德国IKA公司;Waters固相萃取装置 美国Waters公司;Sartorius SQP分析天平 瑞士梅特勒-托利多公司;BiotageTurboVap2氮吹仪 瑞典Biotage公司;4-16S离心机 德国Sigma公司。
1.3 方法
1.3.1 标准溶液的配制
单标溶液配制:分别准确量取各种单标溶液适量,用乙腈稀释成质量浓度为10 ng/mL的单标溶液。
PAHs标准中间液配制:准确移取0.1 mL PAHs混合标准溶液(15 种PAHs的质量浓度均为200 μg/mL)于100 mL棕色容量瓶中,用乙腈定容,得质量浓度为200 ng/mL的标准中间液,4 ℃保存,有效期为3 个月。
PAHs标准工作液配制:分别准确移取0.05、0.25、0.50、1.00、2.50 mL PAHs标准中间液于10 mL棕色容量瓶中,用乙腈定容,配制成质量浓度分别为1、5、10、20、50 ng/mL的系列标准工作液。
1.3.2 样品前处理
样品提取:称取2 g(精确到0.000 1 g)试样于50 mL离心管中,加入10 mL乙腈,涡旋振荡30 s后,超声提取30 min,4 500 r/min离心5 min;吸取上清液于氮吹管中,下层用10 mL乙腈重复提取1 次,合并提取液于氮吹管中,35 ℃氮吹至近干;加入5 mL正己烷,涡旋振荡30 s溶解,待净化。
样品净化:依次用5 mL二氯甲烷和5 mL正己烷活化MIP-PAHs固相萃取柱,将待净化溶液全部上样,用2 mL正己烷洗涤氮吹管并入柱中,用正己烷淋洗2 次,每次3 mL,弃去淋洗液,再用10 mL二氯甲烷洗脱并收集净化液至离心管;35 ℃氮吹至近干,用乙腈定容至1.0 mL,过0.22 μm滤膜,待测。
1.3.3 仪器条件
色谱柱:Waters PAHs C18柱(4.6 mm×250 mm,5 μm);流动相:乙腈和水;柱温35 ℃;流速1.2 mL/min;进样量10 μL;对流动相梯度洗脱程序进行优化。
1.3.4 方法的线性范围、检出限及定量限测定
在优化所得测定条件下,对配制的标准工作液进行测定,以待测PAHs的峰面积(y)为纵坐标,各PAHs的质量浓度(x)为横坐标,绘制标准曲线。在空白基质中依次加入较低质量浓度的标准溶液后进行测定,以3 倍信噪比(RS/N=3)和10 倍信噪比(RS/N=10)分别确定方法的检出限和定量限。
1.3.5 方法的回收率和精密度测定
称取2 g(精确到0.000 1 g)空白试样,分别进行5.0、10.0、25.0 μg/kg 3 个加标水平的基质加标回收实验,按照1.3.2节进行样品前处理,并进行HPLC-FLD分析,计算平均回收率和方法精密度(相对标准偏差(relative standard deviation,RSD))。每个添加水平均平行测定6 次。
2 结果与分析
2.1 样品净化方式的选择
称取空白样品,按照10.0 μg/kg的添加水平进行加标回收实验,比较MIP-PAHs和以900 mg硫酸镁、100 mg N-丙基乙二胺(primary secondary amine,PSA)、100 mg C18为填料的净化管2 种净化方式对烤肉样品的净化效果。

表1 2 种净化方式回收率的比较Table 1 Comparison of recovery rates of two purification methods
由表1可知,MIP-PAHs和以900 mg硫酸镁、100 mg PSA、100 mg C18为填料的净化管净化的回收率分别为80.6%~95.8%和60.7%~75.7%,MIP-PAHs固相萃取柱的分析结果优于以900 mg硫酸镁、100 mg PSA、100 mg C18为填料的净化管,因此选择MIP-PAHs净化。
2.2 色谱条件的优化
流速和流动相的不同配比直接影响PAHs的出峰时间及分离效果,考察表2~3中的2 种仪器条件对PAHs分离效果的影响。由图1可知,以表3中的参数作为仪器条件时,标准溶液色谱图的基线不平,以表2中的参数作为仪器条件时,标准溶液色谱图的基线平稳,且空白加标样品可以实现较好地分离。
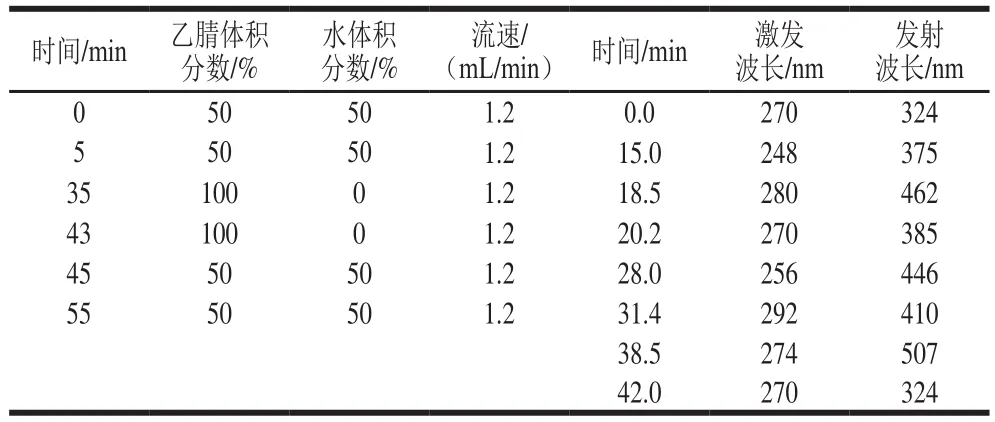
表2 流动相洗脱梯度、流速及荧光检测器梯度(1)Table 2 Mobile phase gradient program, fl ow rate and fl uorescence detection gradient (1)
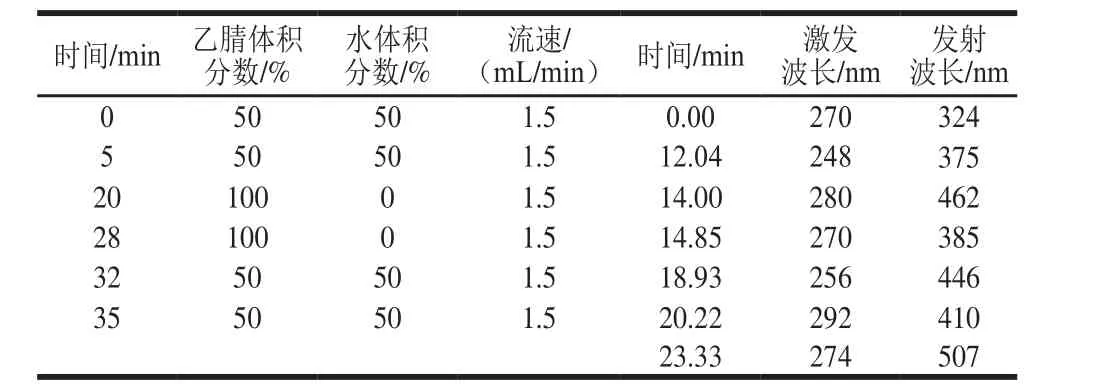
表3 流动相洗脱梯度、流速及荧光检测器梯度(2)Table 3 Mobile phase gradient program, fl ow rate and fl uorescence detection gradient (2)

图1 不同色谱条件下标准溶液和空白加标样品的色谱图Fig. 1 Chromatogram of standard solution and spiked blank sample under different chromatographic conditions
2.3 方法的线性范围、检出限及定量限

表4 方法的线性范围、检出限及定量限Table 4 Linear ranges, LODs and LOQs of the method
由表4可知,用HPLC-FLD法测定时,PAHs在质量浓度1~50 ng/mL线性范围内均呈良好的线性关系,r>0.999 5,方法检测限为0.33~3.30 μg/kg,定量限为1.0~10.0 μg/kg。
2.4 方法的回收率和精密度
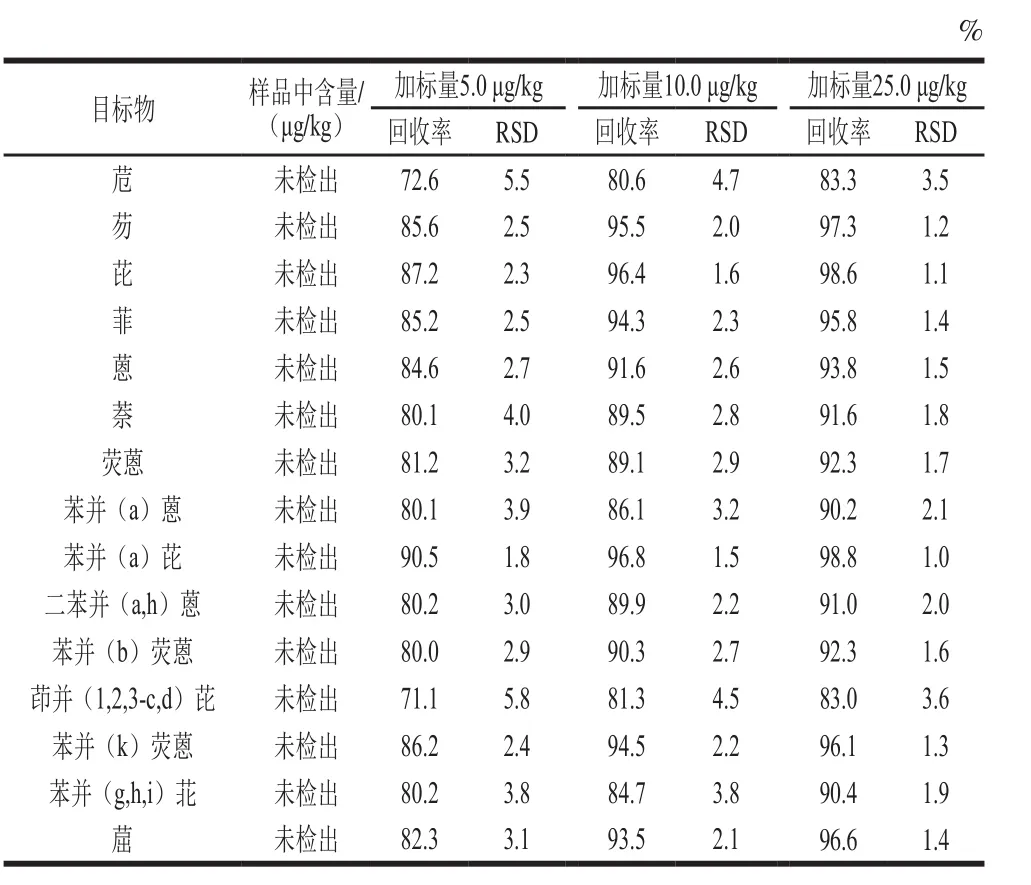
表5 方法回收率和RSDs(n=6)Table 5 Recovery and precision (RSDs) of the method (n= 6)
由表5可知,HPLC-FLD法中各PAHs在5.0、10.0、25.0 μg/kg 3 个加标水平的回收率分别为71.1%~90.5%、80.6%~96.8%及83.0%~98.8%,RSD分别为1.8%~5.8%、1.5%~4.7%及1.0%~3.6%,表明方法准确度和精密度均满足分析要求。

表6 样品PAHs含量测定结果Table 6 PAHs contents of real samples
2.5 实际样品测定
按照1.3.2节处理样品,将处理好的样品在优化所得条件下进行测定,外标法定量。
由表6可知:15 种PAHs在24 份烤肉样品中均有检出,其中烤鸡肉2和烤肉1中苯并(a)芘含量大于5.0 μg/kg;烤鸭13、烤肉2和烤羊肉1中苯并(a)芘含量大于2.0 μg/kg,且PAH4(䓛、苯并(a)蒽、苯并(b)荧蒽、苯并(a)芘)总量均大于12.0 μg/kg;烤鸡肉1和烤牛肉2中苯并(a)芘含量小于2.0 μg/kg,但PAH4总量均大于12.0 μg/kg;24 份烤肉样品中有2 份不符合我国标准,7 份不符合欧盟标准。由此可见,单一控制苯并(a)芘的含量不足以保证烤肉的质量,为提高其安全性,且与国际接轨,应尽快提高我国熏、烧、烤肉制品中PAHs的限量标准。
3 结 论
比较MIP-PAHs和以900 mg硫酸镁、100 mg PSA、100 mg C18为填料的净化管2 种净化方式对烤肉样品的净化效果,结果表明:采用MIP-PAHs净化时,空白样品加标回收率高,且能减少其他物质对目标物的干扰。流速和流动相的不同配比直接影响PAHs的出峰时间及分离效果。在进行预实验时,参照GB 5009.265—2016《食品安全国家标准 食品中多环芳烃的测定》中的色谱条件,但标准溶液中的15 种PAHs目标物分离不理想,且基线不平,最终通过不断摸索确定了本研究中的色谱条件。
本研究用少量乙腈超声提取样品后,采用MIP-PAHs净化,净化后的样品进行HPLC-FLD检测。结果表明,烤肉中15 种PAHs的加标回收率为71.1%~98.8%,RSD为1.0%~5.8%,该方法高效、快速、灵敏度高,可以用于烤肉中15 种PAHs的定量分析。

